Какие соединения могут проявлять только восстановительные свойства
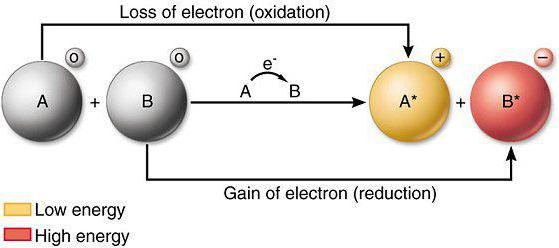
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым – соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
– Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
– S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4

Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
– Mn+7 принимает 5 e = Mn+2 2 является окислителем,
– 2I- отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
– серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
– Mn+7 принимает 5 e= Mn+2 2,
– S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
– нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
– Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
– Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
– 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
– Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции – фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла – алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Источник
Определение
Окислительно -восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления одного или нескольких элементов.
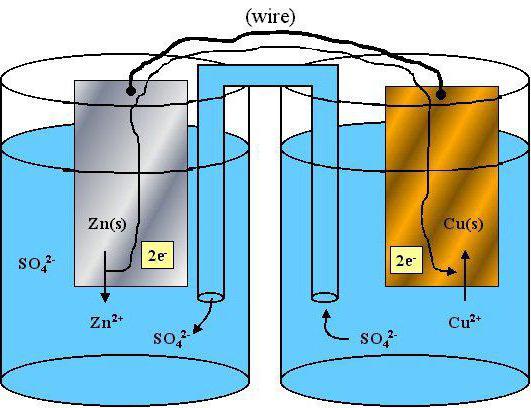
Окислительно-восстановительные реакции играют важную роль в природе и технике. Фотосинтез, дыхание, брожение, накопление энергии в клетках сопровождаются переносом электронов. Разделяя процессы окисления и восстановления, удается превращать энергию химических реакций в электрическую. Этот принцип лежит в основе работы гальванических элементов и аккумуляторов.
К числу ОВР принадлежат все реакции между простыми и сложными веществами, между двумя простыми веществами, а также некоторые случаи взаимодействия сложных веществ:
$overset{0}{Fe} + overset{+2}{Cu}overset{+6}{S} overset{-2}{O_4} = overset{+2}{Fe}overset{+6}{S} overset{-2}{O_4} +overset{0}{Cu}$
$2overset{0}{Mg} + overset{0}{O_2} = 2overset{+2}{Mg}overset{-2}{O}$
$2overset{+1}{K} overset{-1}{I} + 4overset{+1}{H}overset{+5}{N}overset{-2}{O_3} = overset{0}{I_2} + 2overset{+4}{N}overset{-2}{O_2} + 2overset{+1}{K} overset{+5}{N}overset{-2}{ O_3} + 2overset{+1}{H_2}overset{-2}{O}$
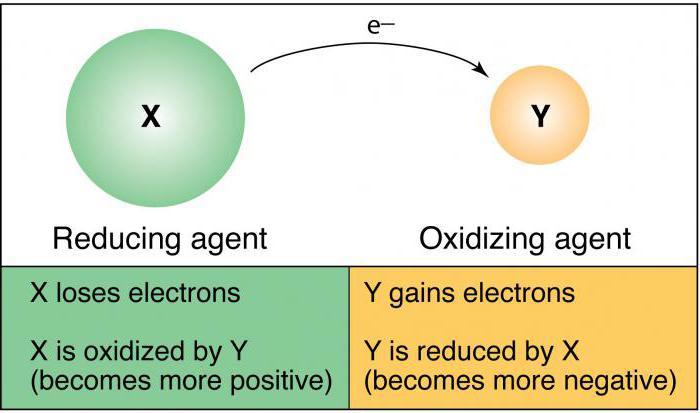
При окислительно-восстановительных реакциях происходит переход электронов от одних атомов к другим.
Определение

Атом, отдающий электрон, то есть повышающий свою степень окисления, называют восстановителем, а атом, принимающий электрон (его степень окисления понижается) – окислителем.
Часто термины окислитель и восстановитель переносят и на вещества, в состав которых входят соответствующие атомы. В результате реакции окислитель восстанавливается, а восстановитель окисляется.
Определение
Процесс отдачи атомом электронов называется окислением, а процесс принятия атомом электронов – восстановлением.
Запомни! Нельзя путать название процесса передачи электронов с функцией атома, которую он проявляет в этом процессе.
Восстановителем может быть атом элемента, а восстановление – это процесс принятия электронов.

| $underline{O}$кислитель | $underline{textrm{В}}$осстановитель |
|---|---|
| $underline{textrm{В}}$зял электроны | $underline{O}$тдал электроны |
| $underline{textrm{В}}$осстановился | $underline{O}$кислился |
| $S^{+6} + 2bar{e} rightarrow S^{+4}$ | $S^{-2} -2bar{e} rightarrow S^{0}$ |
| степень окисления $downarrow$ | степень окисления $uparrow$ |
| процесс восстановления | процесс окисления |
| Типичные окислители: | Типичные восстановители: |
|
|
Есть ряд мнемонических правил, которые позволяют лучше запомнить разницу между этими понятиями:
По первым буквам слов можно составить следующие сокращения:
ОВВ: окислитель – взял $bar{e}$ – восстановился
ВОО: восстановитель – отдал – окислился
 2. Или использовать словосочетание “окислитель-грабитель”.
2. Или использовать словосочетание “окислитель-грабитель”.3. Запомнить стихотворение:
Восстановитель — это тот, кто электроны отдает.
Сам отдает грабителю, злодею-окислителю.
Отдает — окисляется, сам восстановителем является.
КЛАССИФИКАЦИЯ ОВР
Определение
Окислительно-восстановительные реакции в которых окислитель и восстановитель входят в состав разных соединений называют межмолекулярными, а ОВР, в которых и окислитель, и восстановитель входят в состав одного и того же соединения – внутримолекулярными.
К числу внутримолекулярных принадлежат реакции термического разложения некоторых веществ, например, сульфата меди(II):
$2CuSO_4 stackrel{700^circ C}{=} 2CuO + 2SO_2 + O_2$
$mathrm{S^{+6} + 2e^– rightarrow S^{+4}}$ |2 2 окислитель, процесс восстановления
$mathrm{2O^{–2} – 4e^– rightarrow O_2^0}$ |4 1 восстановитель, процесс окисления
__________________________________________________________________________________________
$mathrm{2S^{+6} + 2O^{–2} rightarrow 2S^{+4} + O_2^0}$
Внутримолекулярные ОВР, в свою очередь, также делятся на два типа: реакции диспропорционирования и сопропорционирования.
Определение
Внутримолекулярные окислительно-восстановительные реакции, в которых окислителем и восстановителем является один и тот же элемент, который в начале реакции находится в одной степени окисления, называют диспропорционированием.
К числу таких реакций принадлежит, например, разложение пероксида водорода на воду и кислород.
$2H_2overset{-1}{O_2} rightarrow 2H_2overset{-2}{O} + overset{0}{O_2}$.
Определение
Внутримолекулярные окислительно-восстановительные реакции, в результате которых атомы одного и того же элемента, находящиеся в разных степенях окисления, приобретают одну промежуточную, называют сопропорционированием.
Примером служит взаимодействие сернистого газа с сероводородом, приводящее к образованию серы:
$2H_2overset{-2}{S} + overset{+4}{S}O_2 = 3overset{0}{S} + 2H_2O$.
Источник
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Сегодня – особенный день. “И что же в нем такого необычного?” – спросите вы. Отвечаю. Я, наконец-то, добралась до моего самого любимого царства-королевства, до моих конфет и пирожных, малинок и клубничек! Окислительно-восстановительные реакции! Вы даже не представляете, насколько это интересно!
Мои ученики в процессе подготовки к экзамену по химии, проходят несколько стадий вызревания. Первое серьезное испытание на прочность – газы! Это из серии “гестапо отдыхает”. Решив огромное количество газовых задач, по сравнению с которыми 28-е задачи ЕГЭ – детский лепет, народ полностью структурирует свой мозг и настраивает мышление на профессиональное восприятие химии по-взрослому.
Вторая ступень химической зрелости и мудрости – окислительно-восстановительные реакции. Они приучают к усидчивости и внимательности. Набравшись опыта в написании ОВР, ребята начинают чувствовать себя ломоносовыми, клапейронами и менделеевыми в одном флаконе. За спиной вырастают крылья и… понеслось! Дальнейшее изучение химии проходит на едином дыхании, профессиональный рост – в геометрической прогрессии. На этой стадии мои ученики уже могут заткнуть за пояс каждого второго школьного преподавателя химии!
Понимая всю серьезность материала статьи, я отключила мобильную связь с внешним миром – с Карлсоном, Алисой (которая из страны Чудес), Сири, Фрекен Бок (тем более, что она работает химичкой в школе, где учится Малыш) и всеми остальными озорниками и хулиганами. Оставила только астральную связь для служебного пользования. Возможно, музы на чаек залетят или еще кто-нибудь забредет. А мы с вами займемся самым интересным делом – будем раскладывать по полочкам все накопленные мною знания по теории и практике окислительно-восстановительных реакций. Долго будем этим заниматься. Пока не надоест. Итак, поехали!
Окислительно-восстановительные реакции (ОВР) – химические реакции, в результате которых происходит изменение степеней окисления элементов.
ОВР протекают с участием двух участников – окислителя и восстановителя, и состоят из двух противоположных процессов:
1) Окисление – процесс отдачи электронов (восстановитель отдает электроны окислителю, восстановитель окисляется – окислитель восстанавливается).
2) Восстановление – процесс присоединения электронов (окислитель присоединяет электроны от восстановителя, окислитель восстанавливается – восстановитель окисляется).
Кто же вы, господа окислители и восстановители? Как вас узнать среди огромного количества химических веществ? Сегодня разберем самые общие характеристики участников ОВР (окислителей и восстановителей) на отдельных примерах. После изучения технологии написания ОВР (в следующей статье), поработаем с целыми семействами окислителей и восстановителей, с неорганическими и органическими веществами, проводя реакции в разных средах. А пока – читаем внимательно!
Окислитель – атом в составе молекулы или иона, который присоединяет электроны от восстановителя. Происходит процесс восстановления окислителя (его степень окисления снижается).
Окислительная активность – способность атома отбирать электроны у других атомов.
Окислительно-восстановительный потенциал (редокс-потенциал) – показатель окислительной активности, мера способности атомов химического элемента присоединять электроны (восстанавливаться). Стандартные потенциалы окислительно-восстановительных пар помещены в таблицу.
Чем выше стандартный потенциал окислительно-восстановительной пары, тем выше окислительная активность атомов элемента, тем он – более сильный окислитель
Окислительную активность определяют два фактора:
1) Электроотрицательность. Чем выше электроотрицательность химического элемента, тем выше окислительная активность простого вещества. В Периодической Системе Элементов электроотрицательность растет в сторону правого верхнего угла (слева направо и снизу вверх). Самый сильный окислитель – фтор, на втором месте – кислород.
2) Степень окисления. Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (она равна номеру группы). Почему? Да, потому что у такого атома на внешнем уровне вообще нет валентных электронов. Ни одного. Все валентные электроны он где-то потерял (отдал кому-то) и остался гол, как сокол (в чем мать родила). Больше отдавать нечего, поэтому можно только присоединять.
У вас часто возникает вопрос – почему при дефиците электронов формируется положительная степень окисления или положительный заряд иона (т.е. почему у окислителя валентные электроны в дефиците или отсутствуют, а его заряд +n)? Да, потому что электроны заряжены отрицательно, а протоны (в ядре) – положительно. В электронейтральном атоме протоны и электроны уравновешены (сколько протонов, столько электронов). Если электроны убрать, то проявятся положительные заряды протонов, которые никуда не деваются в химических реакциях (их можно сдвинуть с насиженного места только ядерными реакциями). Теперь понятно? Если все еще “ежик в тумане”, читайте эту и следующие статьи. Я буду рассматривать все тяжело понимаемые моменты с разных сторон. В конце концов, все станет на свои места и туман рассеется.
Давайте, придумаем образ окислителя. Кто вы, мистер-окислитель? Это – захватчик, завоеватель, грабитель, который скачет на коне и, угрожая, копьем и ружьем, отбирает электроны у восстановителей (часто, отбирает все, что есть). Окислитель не только безжалостный разбойник, но еще и жадина – очень проблематично вернуть назад электроны, которые забрал окислитель. Как только окислитель ограбит восстановителя (заберет у него электроны) он тут же падает вниз по градационной шкале степеней окисления (“падает в глазах окружающих”).
Пример сильного окислителя – перманганат-ион. Его часто используют в различных ОВР. Обратите внимание, в зависимости от среды реакции, перманганат-ион образует различные продукты.
Ребята, не слушайте училок-химичек, которые заставляют запоминать продукты ВСЕХ окислительно-восстановительных реакций. Если вы забыли образующиеся вещества и просите помочь, они орут, обзывая вас неучами и и бездельниками. При этом, сами срочно хватают спасательный учебник по химии и пафосно зачитывают вам и всему классу продукты конкретной реакции. Вы задайте этим глупым училкам вопрос – помнят ли они дни рождения всех своих родственников? Что касается меня, то после 16-ти часов работы (такое тоже бывает), я часто забываю номер своего телефона. Но… ЛЮБУЮ ОВР напишу за пару минут (как говорят, темной ночью под кроватью)! Потому, что знаю особые секреты окислительно-восстановительных реакций, которые, между прочим, собираюсь раскрыть моим ученикам и всем моим читателям.
Постепенно, статья за статьей, мы будем изучать технологию написания окислительно-восстановительных реакций, знакомиться с целыми семействами окислителей и восстановителей, их особенностями, характером поведения в разных средах, предполагаемыми продукты. Лукавить не буду, кое-что нам, все-таки, придется запомнить. Совсем немного. Чуть-чуть. Примерно 15 точек, включающих продукты ОВР и основные рекомендации. И вы напишите ЛЮБУЮ окислительно-восстановительную реакцию! В ЛЮБОЙ среде!
Первое задание: запомните три продукта восстановления перманганат-иона (выделено красным цветом) в зависимости от среды протекания окислительно-восстановительной реакции (кислая, нейтральная или щелочная).
Восстановитель – атом в составе молекулы или иона, который отдает электроны окислителю. Происходит процесс окисления восстановителя (его степень окисления повышается).
Восстановительная активность – способность атома отдавать электроны другим атомам.
Восстановительную активность определяют два фактора:
1) Радиус атома. Чем больше радиус атома химического элемента, тем выше восстановительная активность простого вещества. В Периодической Системе Элементов радиус атома увеличивается в сторону левого нижнего угла (справа налево и сверху вниз).
2) Степень окисления. Чем ниже степень окисления атома в составе молекулы или иона, тем ярче проявляется восстановительная активность.
Только свойства восстановителя проявляют атомы с минимально возможной степенью окисления. Для неметаллов она равна “восемь минус номер группы”. Для металлов – ноль. Как только восстановитель отдаст электроны окислителю, он поднимется вверх по градационной шкале степеней окисления (“растет в глазах окружающих”).
Посмотрите, как ведет себя сера в роли восстановителя в разных веществах (с разными степенями окисления).
Настало время придумать образ восстановителя. Кто вы, мистер-восстановитель? У меня восстановитель ассоциируется с добрым дедушкой-альтруистом, который одаривает электронами каждого желающего окислителя.
Как же вас различить, господа окислители и восстановители в группе веществ, предложенных для реакций?!
Окислитель можно отыскать по высокой (иногда, максимально высокой) степени окисления, кроме того, мы изучим многие семейные портреты окислителей. Продукты окислителей мы ЗАПОМНИМ (их около 10, не более), кроме того, проведем анализ процесса восстановления окислителя по градационной шкале степеней окисления.
Восстановитель отыщем по низкой (иногда, максимально низкой) степени окисления. Продукт восстановителя будем устанавливать путем анализа с использованием градационных шкал степеней окисления. Хотя… сделаю вам подарок. Читайте мнемоническое стихотворение. Пригодится.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7 (903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
Репетитор по химии и биологии кбн В.Богунова
Источник
