Какие соединения азота обладают и окислительными и восстановительными свойствами

Азот – неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.
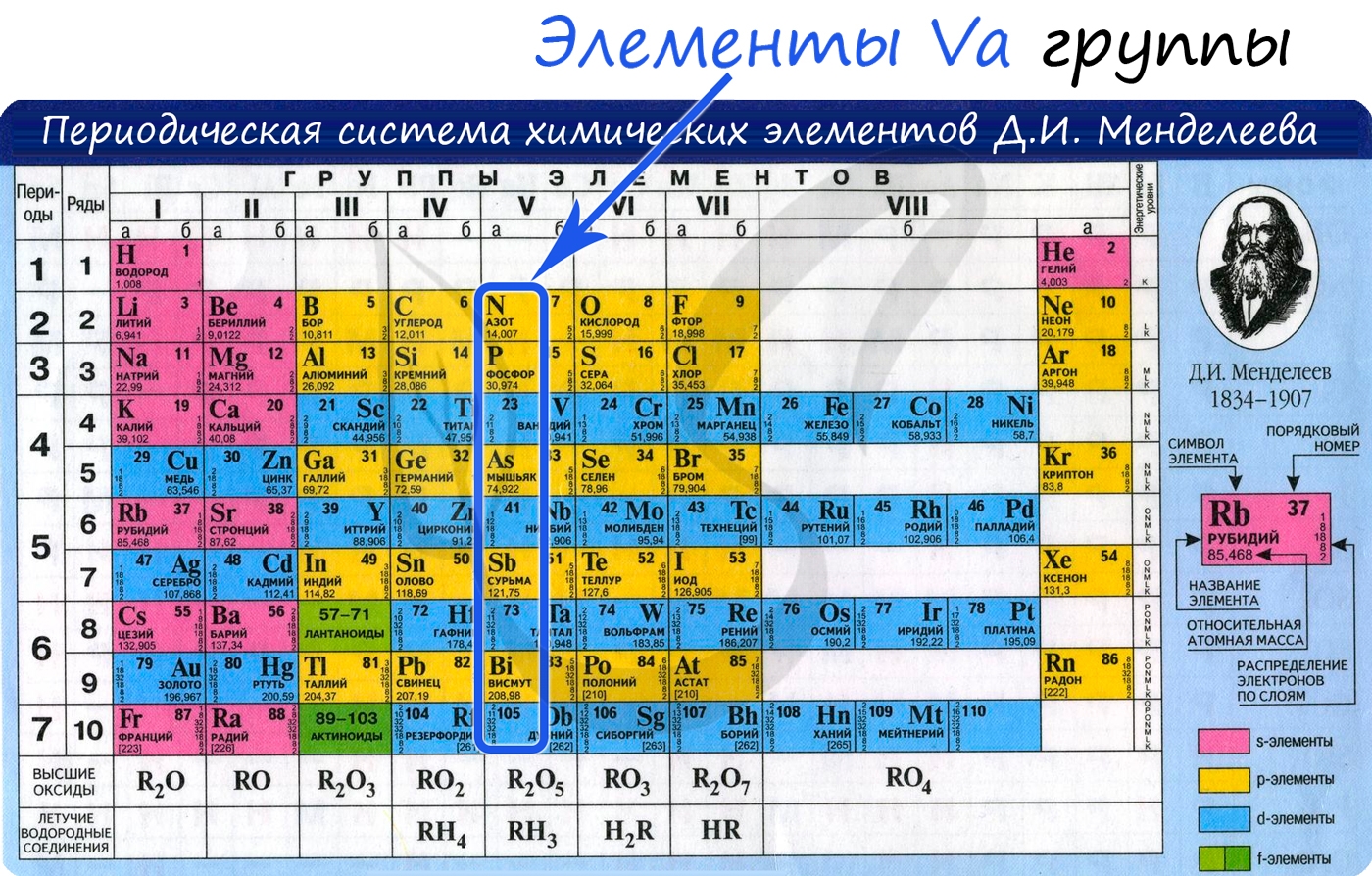
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма – полуметалл, висмут – металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N – 2s22p3
- P – 3s23p3
- As – 4s24p3
- Sb – 5s25p3
- Bi – 6s26p3
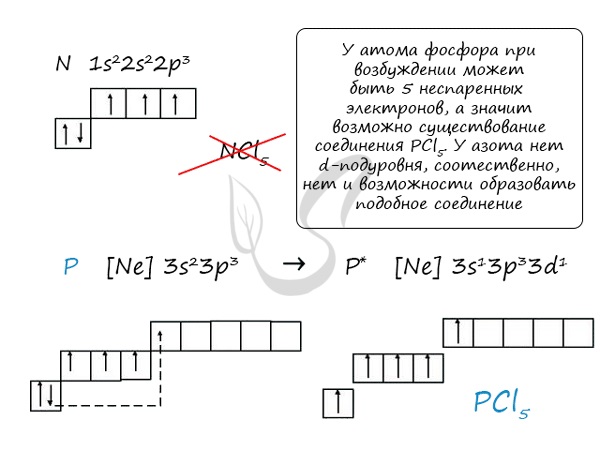
Основное и возбужденное состояние азота
При возбуждении атома азота электроны на s-подуровне распариваются и переходят на p-подуровень. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, что проявляется в особенностях электронной конфигурации возбужденного состояния.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух – во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 – индийская селитра, калиевая селитра
- NaNO3 – чилийская селитра, натриевая селитра
- NH4NO3 – аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
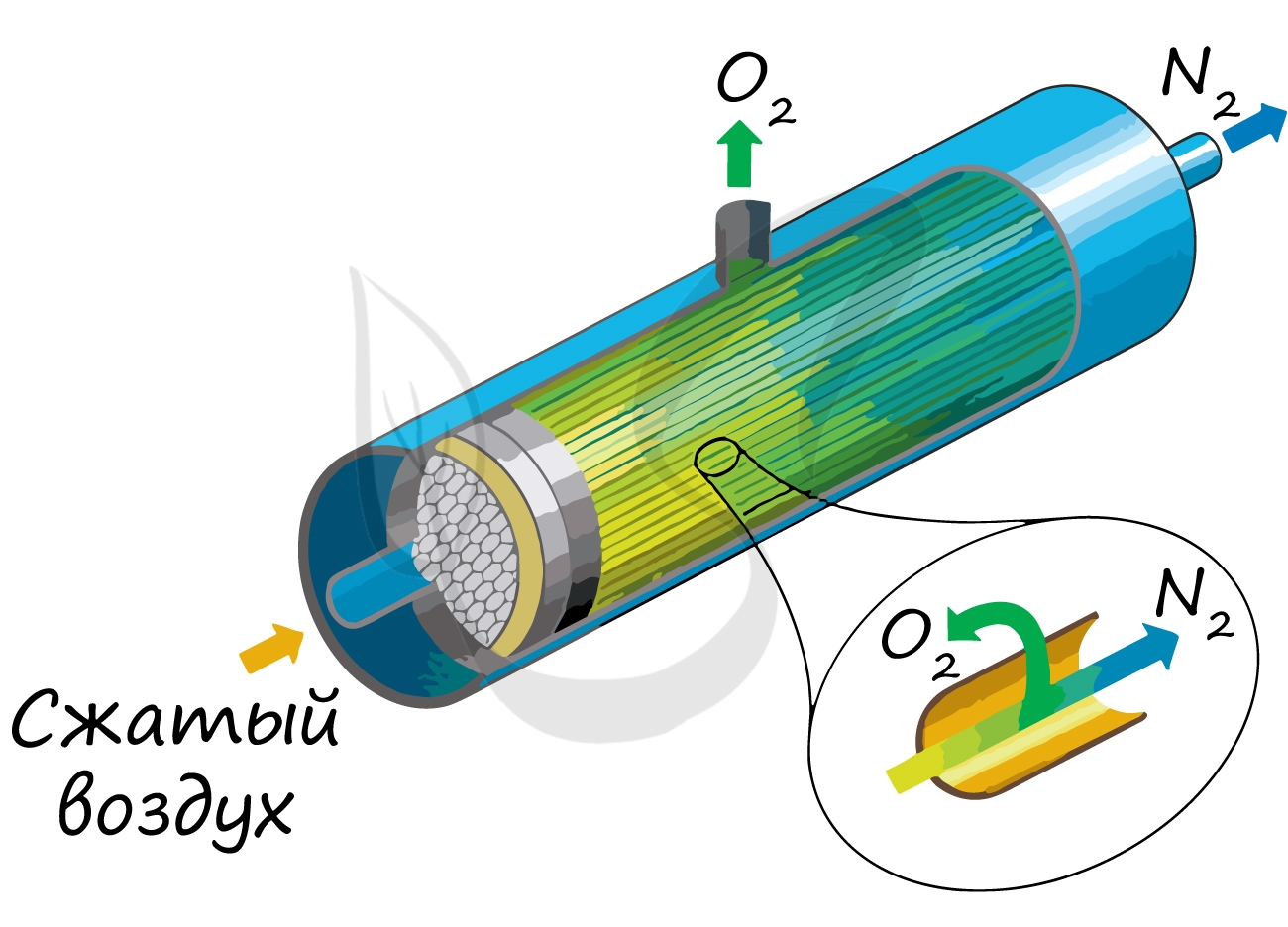
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает – он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
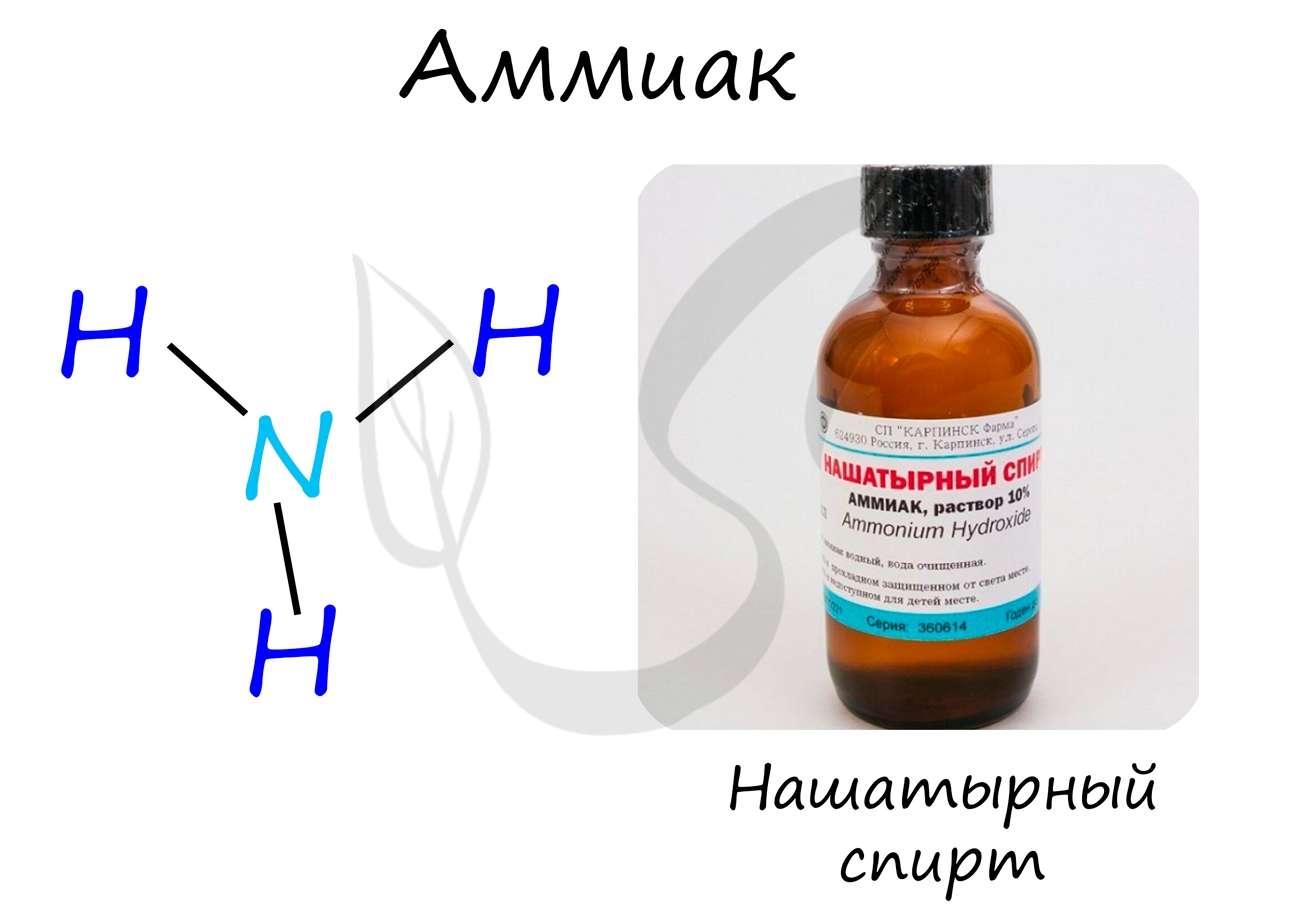
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение – гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода – реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония – NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I – N2O
Закись азота, веселящий газ – N2O – обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II – NO
Окись азота – NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях – в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа – оксида азота IV – NO2.
NO + O2 → NO2

Оксид азота III – N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем
охлаждением полученной смеси газов до температуры – 36 °C.
As2O3 + HNO3 → H3AsO 3 + NO↑ + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислота – HNO2, соли которой называются нитриты (NO2-).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV – NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 – на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам – азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
3. Химические свойства соединений азота с точки зрения изменения степеней окисления
Правило 3.1. Аммиак в реакциях, как правило, окисляется до азота:
4NH3 + 3O2 → 2N2 + 6H2O (t)
8NH3 + 3Cl2 → N2 + 6NH4Cl (в атмосфере хлора)
+ 6NH4Cl (в атмосфере хлора)
2NH3 + 3CuO → 3Cu + N2 + 6H2O
+ 6H2O
2NH4Cl + 4CuO → 3Cu + N2 + CuCl2 + 4H2O
+ CuCl2 + 4H2O
2NH3 + 3H2O2 → N2 + 6H2O (t)
+ 6H2O (t)
2NH3 + 2K2FeO4 + 5H2SO4 → Fe2(SO4)3 + N2 + 2K2SO4 + 8H2O
+ 2K2SO4 + 8H2O
8NH3 + 3KBrO4 → 3KBr + 4N2 + 12H2O
+ 12H2O
2NH3 + 3KClO → 3KCl + N2 + 3H2O
+ 3H2O
4NH3 + 3Ca(ClO)2 → 3CaCl2 + 2N2 + 6H2O
+ 6H2O
2NH3 + 2NaMnO4 → 2MnO2 + N2
+ N2 + 2NaOH + 2H2O
+ 2NaOH + 2H2O
2NH3 + 6NaMnO4 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
+ 6H2O
2NH3×H2O + 2KMnO4 → 2MnO2 + N2
+ N2 + 2KOH + 4H2O
+ 2KOH + 4H2O
Исключения:
Чтобы легко запомнить следующие реакции, нужно помнить, что нитрат аммония разлагается при нагревании на оксид азота (I) и воду
(NH4NO3 → N2O + 2H2O):
NH4Cl + KNO3 → N2O + KCl + H2O
+ KCl + H2O
А также нужно помнить термическое разложение нитрита аммония на азот и воду (NH4NO2 → N2 + 2H2O):
NH4Cl + NaNO2 → N2 + NaCl + 2H2O
+ NaCl + 2H2O
Реакции термического разложения нитрата и нитрита аммония также часто встречаются на экзамене.
В присутствии катализатора аммиак окисляется кислородом до оксида азота (II), а не простого вещества:
4NH3 + 5O2 → 2NO + 6H2O (t, Pt)
Правило 3.2. Нитриды (и для аналогии фосфиды) активных металлов легко реагируют с водой и растворами кислот:
1. Реакции с водой:
Mg3N2 + H2O → 3Mg(OH)2 + 2NH3
Na3N + H2O → NaOH + NH3
Ca3P2 + 6H2O → 3Ca(OH)2 +2PH3
2. В реакциях с кислотами образуются соли (в случае нитридов) или фосфин (в случае фосфидов):
Ca3N2 + HCl → 3CaCl2 + 2NH4Cl
Zn3P2 + 6HCl → 3ZnCl2 + 2PH3
Азотная кислота
Правило 3.3. Чем более разбавленной является кислота, тем более сильным окислителем она является.
Изменение степени окисления азота в реакциях с сильным восстановителем:
N+5 + 8e → N–3 (NH3 или NH4NO3) очень разбавленная HNO3
N+5 + 5e → N0 (N2) разбавленная HNO3
N+5 + 4e → N+1 (N2O) разбавленная HNO3, концентрированная
Изменение степени окисления азота в реакциях со слабым восстановителем:
N+5 + 3e → N+2 (NO) разбавленная HNO3
N+5 + 1e → N+4 (NO2) концентрированная HNO3
Восстановители:
Сильные:
- Металлы от Li до Al
Слабые:
- Металлы, начиная с Fe
- Неметаллы
- Соли (если можем окислить)
- Оксиды (если можем окислить)
- HI и йодиды, H2S и сульфиды
10HNO3(оч. разб.) + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3(разб.) + 4Mg → 4Mg(NO3)2 + N2O + 5H2O (возможно образование N2)
8HNO3(разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
4HNO3(конц.) + 3Cu → 3Cu(NO3)2 + 2NO2 + 2H2O
С неметаллами образуются соответствующие кислоты:
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t) (из галогенов реакция идет только с йодом)
4HNO3(конц.) + C → CO2 + 4NO2 + 2H2O
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб.) + 3P +2H2O → 3H3PO4 + 5NO
6HNO3(конц.) + S → H2SO4 + 6NO2 + 2H2O
2HNO3(разб.) + S → H2SO4 + 2NO
Окисляем анион:
8HNO3(к) + H2S → H2SO4 + 8NO2 + 4H2O
+ 4H2O
8HNO3(к) + Na2S → Na2SO4 + 8NO2 + 4H2O
+ 4H2O
4HNO3(конц.) + CuS → Cu(NO3)2 + S + 2NO2
+ 2NO2 + 2H2O
+ 2H2O
8HNO3(конц.) + CuS → CuSO4 + 8NO2 + 4H2O
8HNO3 + Cu2S → 2Cu(NO3)2 + S + 4NO2
+ 4NO2 + 4H2O
+ 4H2O
12HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + 10NO2 + 6H2O
+ 6H2O
16HNO3(к) + Mg3P2 → Mg3(PO4)2 + 16NO2 + 8H2O
+ 8H2O
16HNO3(к) + Ca(HS)2 → H2SO4 + CaSO4 + 16NO2 + 8H2O
+ 8H2O
8HNO3(к) + AlP  → AlPO4 + 8NO2 + 4H2O
В избытке кислоты фосфаты растворяются:
11HNO3(к, изб.) + AlP → H3PO4 + Al(NO3)3 + 8NO2 + 4H2O
+ 4H2O
Окисляем металл соли или оксида:
10HNO3(к) + Fe3O4 → 3Fe(NO3)3 + NO2 + 5H2O
+ 5H2O
4HNO3(к) + FeO → Fe(NO3)3 + NO2 + 2H2O
+ 2H2O
HNO3(к) + FeSO4 → Fe(NO3)3 + NO2 + H2SO4 + H2O
+ H2SO4 + H2O
4HNO3(к) + CrCl2 → Cr(NO3)3 + NO2 + 2HCl + H2O (ионы Cl– азотная кислота окислить не может)
+ 2HCl + H2O (ионы Cl– азотная кислота окислить не может)
Одновременное окисление катиона и аниона:
14HNO3(к) + Cu2S → H2SO4 + 2Cu(NO3)2 + 10NO2 + 6H2O
+ 6H2O
Нитраты
Правило 3.4. С металлами (Al, Zn, Mg) нитраты восстанавливаются до аммиака:
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3 + 8Na[Al(OH)4]
+ 8Na[Al(OH)4]
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3 + 4Na2[Zn(OH)4]
+ 4Na2[Zn(OH)4]
KNO3 + 4Mg + 6H2O → NH3 + 4Mg(OH)2
+ 4Mg(OH)2 + KOH
+ KOH
Правило 3.5. При сплавлении в щелочной среде нитраты восстанавливаются до нитритов:
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
3NaNO3 + Cr2O3 + 2Na2CO3 → 3NaNO2 + 2Na2CrO4 + 2CO2
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
3NaNO3 + Fe2O3 + NaOH → 3NaNO2 + 2Na2FeO4 + 2H2O
3KNO3 + Fe + 2KOH → 3KNO2 + K2FeO4 + H2O
Правило 3.6. Неметаллами нитраты восстанавливаются до азота либо нитрита:
2KNO3 + C → 2KNO2 + 2KNO2 + CO2
2KNO3 + S → 2KNO2 + SO2
Правило 3.7. С солями аммония, по сути, идет разложение нитрата аммония:
KNO3 + NH4Cl → N2O + KCl + 2H2O (NH4NO3 → N2O + 2H2O)
+ KCl + 2H2O (NH4NO3 → N2O + 2H2O)
Правило 3.8. В случае нитрата слабого металла именно метал будет окислителем, а не азот:
8AgNO3 + PH3 + 4H2O → Ag + H3PO4 + HNO3
Правило 3.9. Термическое разложение нитратов:
MNO3 → MNO2 + O2 M – металл, находящийся в ряду напряжений металлов левее Mg, исключая Li.
M – металл, находящийся в ряду напряжений металлов левее Mg, исключая Li.
MNO3 → MO + NO2 + O2
+ O2 M – металл, находящийся в ряду напряжений металлов от Mg до Cu (Mg и Cu включительно), а также Li.
M – металл, находящийся в ряду напряжений металлов от Mg до Cu (Mg и Cu включительно), а также Li.
MNO3 → M + NO2 + O2
+ O2 M – металл, находящийся в ряду напряжений металлов правее Cu.
M – металл, находящийся в ряду напряжений металлов правее Cu.
Нитриты
Правило 3.11. Сильными окислителями нитриты окисляются до нитратов:
3KNO2 + 2CrO3 + 3H2SO4 → 3KNO3 + Cr2(SO4)3 + 3H2O
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
NaNO2 + 2KMnO4 + 2KOH → NaNO3 + 2K2MnO4 + H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2 + 2KOH
+ 2KOH
KNO2 + H2O2 → KNO3 + H2O
KNO2 + I2 + H2O → KNO3 + 2HI
Правило 3.12. С восстановителями нитриты восстанавливаются до N2 или NO:
1) С солями аммония, по сути, идет разложение нитрита аммония:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O (NH4NO2 → N2 + 2H2O)
+ NaCl + 2H2O (NH4NO2 → N2 + 2H2O)
Ca(NO2)2 + (NH4)2SO4 → 2N2 + CaSO4 + 4H2O
+ CaSO4 + 4H2O
2) Соединениями I–, Fe2+ и др. нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2KI + 2H2SO4 → 2NO + I2
+ I2 + 2K2SO4 + 2H2O
+ 2K2SO4 + 2H2O
HNO2 + 2HI → 2NO + I2
+ I2 + 2H2O.
+ 2H2O.
Оксиды азота
Правило 3.14. Оксид азота (IV), как правило, восстанавливается до NO или N2:
2NO2 + P2O3 + 4KOH → 2NO + 2K2HPO4 + H2O
6NO2 + FeI2 → Fe(NO3)3 + I2 + 3NO
10NO2 + 4P → P2O5 + 10NO (возможно образование N2)
NO2 + SO2 → SO3 + NO
2NO2 + 2C → N2+ 2CO2
2NO2 + 2S → N2 + 2SO2
2NO2 + 4Cu → N2 + 4CuO
Правило 3.15. Оксид азота (IV) диспропорционирует в реакциях с водой и растворами щелочей и карбонатов щелочных металлов:
Т.к. оксиду NO2 соответствуют две кислоты, при взаимодействии с щелочью или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла:
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O 2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
3NO2 + H2O → 2HNO3 + NO (растворение газа в воде в отсутствии кислорода)
(растворение газа в воде в отсутствии кислорода)
В аналогичных реакциях с кислородом образуются только соединения с N+5 :
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
Правило 3.16. Оксид азота (II), как правило, окисляется до N+5 :
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
Другие реакции:
2NO + O2 → 2NO2(идет самопроизвольно на воздухе)
2NO + 2SO2 → N2 + 2SO3
2NO + 2Cu → N2 + 2CuO (500-600°C).
Правило 3.17. Как и все оксиды азота, N2O является окислителем, способным окислять металлы:
N2O + Cu → CuO + N2
N2O + Cu2O → 2CuO + N2 .
.
Источник
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
А также растворами кислот, например:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным. Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение. Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
а при недостатке кислорода оксид фосфора (III):
Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
Фосфиды активных металлов подобно нитридам гидролизуются водой:
А также водными растворами кислот-неокислителей:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1:
При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит:
Источник
