Какие сложные эфиры можно получить из продуктов спиртового

Сегодня, мы продолжим знакомство с различными классами органических соединений и поговорим о широко распространенных в природе сложных эфирах. Эта статья будет особенно полезна тем, кто подготавливается к сдаче ЕГЭ, изучает углубленно курс органической химии и просто тем, кому интересно вспомнить школьную программу по данной теме. Итак, приступим!
Что же такое сложные эфиры?
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами.
Таким образом, общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
Или:
Формулы отдельных простейших представителей класса сложных эфиров таковы:
Сложные эфиры широко распространены в природе. Специфический аромат ягод, плодов и фруктов в значительной степени обусловлен представителями этого класса органических соединений.
Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — так же, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое. Однако, вопрос применения и классификации сложных эфиров, мы затронем более обширно, чуть позже. А сейчас перейдем к не менее важному вопросу.
Изомерия сложных эфиров.
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку – с пропилового спирта, например, метилбутирату изомерны метилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки –СО–О–. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат, этилпропионат и метилбутират.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота, а метилформиату уксусная кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис- , транс-изомерия.
Теперь поговорим подробнее о разновидностях сложных эфиров.
Необходимо знать следующее.
Сложные эфиры жирных кислот и спиртов с длинными углеводородными радикалами, называют восками.
Напоминаю, жирные кислоты — это алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из чётного числа атомов углерода (от 4 до 24, включая карбоксильный) и могут быть как насыщенными, так и ненасыщенными.
Важнейшими представителями природных сложных эфиров являются жиры.
Жиры – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
Состав и строение жиров могут быть отображены общей формулой:
Где R – это радикалы входящие в состав высших карбоновых кислот:
– С3Н7 – масляной.
– С15H31 – пальмитиновой.
– С17Н35 – стеариновой
– С17Н33 – олеиновой.
– С17Н31 – линолевой.
Причем первые три радикала – это остатки предельных карбоновых кислот, а два последних – это остатки непредельных кислот.
В свою очередь, жиры классифицируют на твердые жиры и жидкие жиры (масла).
Физические свойства сложных эфиров.
Многие сложные эфиры, обладают приятными запахами цветов и фруктов. Они хорошо растворимы в спиртах, а вот в воде растворяются очень мало. Дело в том, что плотность сложных эфиров меньше чем у воды и поэтому они по большей части плавают на ее поверхности.
Сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения.
Способы получения сложных эфиров.
1. Реакция этерификации.
Реакция этерификации, является важнейшим из способов получения сложных эфиров.
Этерификация (от греч. eter — эфир и лат. facio — делаю) — это реакция образования сложных эфиров при взаимодействии кислот и спиртов.
В общем виде реакция этерификации может быть записана так:
Обратите внимание на то, что реакция этерификации обратима. Продукты этой реакции могут вернутся в состояние исходных веществ – спирта и кислоты. Таким образом, над стрелочкой, указывающей в сторону продуктов, мы можем написать – этерификация, а над стрелкой указывающей в сторону исходных веществ, можно написать – гидролиз сложного эфира.
О гидролизе сложных эфиров, мы поговорим чуть позже.
2. Получение сложных эфиров из хлорангидрирдов карбоновых кислот.
Хлорангидриды карбоновых кислот — это производные карбоновых кислот, в которых гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора.
Общая формула хлорангидридов карбоновых кислот такова:
Например, из хлорангидрида уксусной кислоты мы можем получить фенилацетат, путем следующей химической реакции:
Вместо фенола, в данной реакции можно использовать так же и его соли, например фенолят натрия:
Таким же образом эта реакция возможна и для предельных одноатомных и многоатомных спиртов, и их солей:
3. Получение сложного эфира, путем взаимодействия соли карбоновой кислоты и галогеналкана.
Химические свойства сложных эфиров:
1. Галогенирование.
Эта реакция характерна для сложных эфиров, содержащих непредельный углеводородный радикал. Реакция с бромной водой при этом, имеет особое значение, так как она качественная. Происходит обесцвечивание бромной воды.
2. Гидрирование.
Данная реакция так же характерна для сложных эфиров содержащих непредельный углеводородный радикал:
Эта реакция имеет большое практическое значение, так как именно она лежит в основе получения твердого жира – маргарина из жидкого растительного масла.
3. Гидролиз.
В зависимости от условий гидролиз бывает:
– Водный (без катализатора, при высоких температуре и давлении).
– Кислотный (в присутствии кислоты в качестве катализатора).
– Ферментативный (происходит в живых организмах).
Такой гидролиз является обратимым. Для смещения равновесия в сторону продуктов его проводят в присутствие щелочей (или например Na2CO3). При этом гидролиз протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Именно поэтому гидролиз жиров в щелочной среде, называют – омыливанием жиров.
Мыло, которое мы используем, представляет собой смесь солей, поскольку жир, из которого его получают, содержит остатки различных кислот. Натриевые соли высших кислот RCOONa имеют твердое агрегатное состояние, а калиевые RCOOK — жидкое (жидкое мыло). При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты.
Все мыла диссоциируют как сильные электролиты по уравнению:
RCOONa —> RCOO(-) + Na(+)
Очищающее действие мыла — сложный процесс. Молекула соли высшей карбоновой кислоты имеет полярную ионную часть (—COO-Na+) и неполярный углеводородный радикал, содержащий 12—18 атомов углерода. Полярная часть молекулы растворима в воде (гидрофильна), а неполярная — в жирах и других малополярных веществах (гидрофобна) . В обычных условиях частицы жира или масла слипаются между собой, образуя в водной среде отдельную фазу. В присутствии мыла картина резко изменяется. Неполярные концы молекулы мыла погружаются в капли масла, а полярные карбоксилат-анионы остаются в водном растворе. В результате отталкивания одноименных зарядов на поверхности масла оно разбивается на мельчайшие частицы, каждая из которых имеет ионную оболочку из анионов —СОО-. Наличие этой оболочки препятствует слиянию частиц, в результате чего образуется устойчивая эмульсия масла в воде. Эмульгирование жира, содержащего грязь, обусловливает очищающее действие мыла.
В жесткой воде, содержащей ионы Са2+ и Mg2+, мыло теряет свою моющую способность. Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде:
4. Взаимодействие с аммиаком.
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
5. Реакция горения.
Горение сложных эфиров происходит с образованием углекислого газа и воды:
2CH3COOCH3 + 7O2 = 6CO2 + 6H20
Применение сложных эфиров.
Сложные эфиры используются в парфюмерии, косметике, в качестве пищевых добавок, для изготовления искусственных волокон, краски, лаков, клея. Они служат исходными веществами в производстве многих фармацевтических препаратов
Благодаря тому, что они смешиваются со многими органическими веществами, они используются как растворители для лаков и красок.
Этилформиат и этилацетат используются как растворители целлюлозных лаков.
Винилацетат используется для производства поливинилацетатных смол, клеев и красок.
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности(изготовление мыла, духов, кремов) .
Сложные эфиры применяются для производства пластмасс, резины в качестве пластификаторов.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Отдельно стоит упомянуть, про биологическую роль жиров.
Жиры нам необходимы, точно так же, как белки и углеводы: они источник энергии и носители незаменимых веществ. Если организм лишить их, замедлится развитие организма в целом, будет угнетена репродуктивная функция, начнутся проблемы со здоровьем. У детей жиры и вовсе служат главным строительным материалом для развивающегося мозга. Наконец, целый ряд необходимых витаминов растворяется только в жирах и без них не усваивается организмом. Жиры выполняют различные функции:
– строительная (входят в состав клеточных мембран).
– энергетическая (1 г жира при окислении дает 9 ккал энергии).
– защитная (теплорегуляционная, механическая защита органов).
– запасная (запас энергии и воды).
– регулирующая (обмен веществ в организме).
Вот собственно и все, что нужно знать о сложных эфирах.
Так же рекомендую к прочтению:
Альдегиды и Кетоны.
Карбоновые кислоты.
То, что нужно знать о Спиртах.
Фенолы.
Удачи вам, в изучение химии и на сдачи экзаменов! До новых встреч!
Источник
У слова «Эстер» есть и другие значения; см. Эстер.
Сло́жные эфи́ры, или эсте́ры (от др.-греч. αἰθήρ — «эфир»), — производные оксокислот (как карбоновых, так и неорганических), имеющих общую формулу RkE(=O)l(OH)m, где l ≠ 0, формально являющиеся продуктами замещения атомов водорода в гидроксилах —OH кислотной функции на углеводородный остаток (алифатический, алкенильный, ароматический или гетероароматический); рассматриваются также как ацилпроизводные спиртов. В номенклатуре IUPAC к сложным эфирам относят также ацилпроизводные халькогенидных аналогов спиртов (тиолов, селенолов и теллуролов)[1].
Отличаются от простых эфиров (этеров), у которых два углеводородных радикала соединены атомом кислорода (R1—O—R2).
Сложные эфиры карбоновых кислот[править | править код]
В случае эфиров карбоновых кислот выделяются два класса сложных эфиров:
- собственно сложные эфиры карбоновых кислот общей формулы R1—COO—R2, где R1 и R2 — углеводородные радикалы.
- ортоэфиры карбоновых кислот общей формулы R1—C(OR2)3, где R1 и R2 — углеводородные радикалы. Ортоэфиры карбоновых кислот являются функциональными аналогами кеталей и ацеталей общей формулы R—C(OR′)2—R″ — продуктов присоединения спиртов к карбонильной группе кетонов или альдегидов.
Циклические сложные эфиры оксикислот называются лактонами и выделяются в отдельную группу соединений.
Синтез[править | править код]
Основные методы получения сложных эфиров:
- Этерификация — взаимодействие кислот и спиртов в условиях кислотного катализа, например получение этилацетата из уксусной кислоты и этилового спирта:
- Частным случаем реакции этерификации является реакция переэтерификации сложных эфиров спиртами, карбоновыми кислотами или другими сложными эфирами:
- Реакции этерификации и переэтерификации обратимы, сдвиг равновесия в сторону образования целевых продуктов достигается удалением одного из продуктов из реакционной смеси (чаще всего — отгонкой более летучих спирта, эфира, кислоты или воды; в последнем случае при относительно низких температурах кипения исходных веществ используется отгонка воды в составе азеотропных смесей).
- взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например получение этилацетата из уксусного ангидрида и этилового спирта:
- взаимодействие солей кислот с алкилгалогенидами
- Присоединение карбоновых кислот к алкенам в условиях кислотного катализа (в том числе и кислотами Льюиса):
- Алкоголиз нитрилов в присутствии кислот:
- Алкилирование карбоновых кислот арилиакилтриазенами:
Свойства и реакционная способность[править | править код]
Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества, температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
В ИК-спектрах сложных эфиров присутствуют характеристические полосы карбоксильной группы — валентных колебаний связей C=O на 1750—1700 см−1 и С—О на 1275—1050 см−1.
Атом углерода карбонильной группы сложных эфиров электрофилен, вследствие этого для них характерны реакции замещения спиртового остатка с разрывом связи ацил-кислород:
Такие реакции с кислородными нуклеофилами (водой и спиртами) зачастую катализируются кислотами за счёт протонирования атома кислорода карбонила с образованием высокоэлектрофильного карбокатиона:
который далее реагирует с водой (гидролиз) или спиртом (переэтерификация).
Гидролиз сложных эфиров в условиях кислотного катализа является обратимым, гидролиз же в щелочной среде необратим из-за образования карбоксилат-ионов RCOO−, не проявляющих электрофильных свойств.
Низшие сложные эфиры реагируют с аммиаком, образуя амиды, уже при комнатной температуре: так, например, этилхлорацетат реагирует с водным аммиаком, образуя хлорацетамид уже при 0 °C[2], в случае высших сложных эфиров аммонолиз идет при более высоких температурах.
Применение[править | править код]
Сложные эфиры широко используются в качестве растворителей, пластификаторов, ароматизаторов.
Эфиры муравьиной кислоты:
- HCOOCH3 — метилформиат, tкип = 32 °C; растворитель жиров, минеральных и растительных масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида.
- HCOOC2H5 — этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E.
- HCOOCH2CH(CH3)2 — изобутилформиат несколько напоминает запах ягод малины.
- HCOOCH2CH2CH(CH3)2 — изоамилформиат (изопентилформиат) растворитель смол и нитроцеллюлозы.
- HCOOCH2C6H5 — бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как растворитель лаков и красителей.
- HCOOCH2CH2C6H5 — 2-фенилэтилформиат имеет запах хризантем.
Эфиры уксусной кислоты:
- CH3COOCH3 — метилацетат, tкип = 58 °C; по растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель, однако он обладает большей токсичностью, чем ацетон.
- CH3COOC2H5 — этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести).
- CH3COOC3H7 — н-пропилацетат, tкип = 102 °C; по растворяющей способности подобен этилацетату.
- CH3COOCH(CH3)2 — изопропилацетат, tкип = 88 °C; по растворяющим свойствам занимает промежуточное положение между этил- и пропилацетатом.
- CH3COOC5H11 — н-амилацетат (н-пентилацетат), tкип = 148 °C; напоминает по запаху грушу, применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
- CH3COOCH2CH2CH(CH3)2 — изоамилацетат (изопентилацетат), используется как компонент грушевой и банановой эссенций.
- CH3COOC8H17 — н-октилацетат имеет запах апельсинов.
Эфиры масляной кислоты:
- C3H7COOCH3 — метилбутират, tкип = 102,5 °C; по запаху напоминает ранет.
- C3H7COOC2H5 — этилбутират, tкип = 121,5 °C; имеет характерный запах ананасов.
- C3H7COOC4H9 — бутилбутират, tкип = 166,4 °C;
- C3H7COOC5H11 — н-амилбутират (н-пентилбутират) и C3H7COOCH2CH2CH(CH3)2 — изоамилбутират (изопентилбутират) имеют запах груш, а также служат растворителями в лаках для ногтей.
Эфиры изовалериановой кислоты:
- (CH3)2CHCH2COOCH2CH2CH(CH3)2 — изоамилизовалерат (изопентилизовалерат) имеет запах яблока.
Применение в медицине[править | править код]
В конце XIX — начале XX века, когда органический синтез делал свои первые шаги, множество сложных эфиров было синтезировано и испытано фармакологами. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Сложные эфиры неорганических кислот[править | править код]
В сложных эфирах неорганических (минеральных) кислот углеводородный радикал (например, алкил) замещает один или несколько атомов водорода неорганической оксокислоты, таким образом эфиры неорганических кислот могут быть как средними, так и кислыми.
По строению эфиры напоминают соли кислот. Так, эфирами фосфорной, азотной, серной и др. кислот являются органические фосфаты, нитраты, сульфаты[en] и др. соответственно.
Ниже приведены примеры эфиров неорганических кислот:
В таблице, в общих молекулярных формулах эфиров символом =О обозначена оксогруппа.
Литература[править | править код]
- Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Примечания[править | править код]
Источник
Образование сложных эфиров
Спирты взаимодействуют с органическими и неорганическими гидроксилсодержащимиHO–NO2, (HO)2SO2, (HO)3P=O и т.п. кислотами, образуя сложные эфиры. Этот процесс называется реакцией этерификации (от др.греч. αἰθήρ — эфир и лат. facio — делаю).
В реакции с органической кислотой спирт выступает как нуклеофил,Нуклеофил (любящий ядро) — реагент, имеющий неподеленную пару электронов на внешнем электронном уровне и способный предоставить эту пару для образования новой химической связи. отдавая неподелённую электронную пару атома кислорода на связь с электронодефицитным атомом углерода Сδ+ в молекуле кислоты.

Катализатор – сильная кислота (например, конц. H2SO4).
Механизм реакции
Аналогично происходит нуклеофильная атака молекулами спирта электронодефицитных атомов (N, S, P) в молекулах неорганических кислот .
.
Реакционная способность спиртов при этерификации убывает с увеличением числа и размеров углеводородных радикалов. Первичные спирты активнее вторичных. Третичные и многие вторичные спирты в условиях кислотного катализа вступают в реакции элиминирования (отщепления H2O) с образованием алкенов.
Взаимодействие кислот и спиртов протекает обратимоДля смещения равновесия реакции в сторону образования эфира используют водоотнимающие средства и/или отгоняют образующийся эфир (т.кип. эфира ниже, чем у исходных спирта и кислоты из-за отсутствия ассоциирующих водородных связей). (обратный процесс – гидролиз сложных эфиров).
При использовании вместо кислот их более реакционноспособных производных – галогенангидридовГалогенангидриды – производные кислот, в которых гидроксильные группы заменены атомами галогена. или ангидридовАнгидриды органических кислот RCOOH – продукты (RCO)2O, образующие-ся при отщеплении одной молекулы воды от двух молекул кислоты.
Ангидриды неорганических кислот – кислотные оксиды, которые, присоединив воду, превращаются в кислоту. – реакция образования сложных эфиров практически необратима (пример ).
).
Некоторые сложные эфиры, в особенности сложные эфиры третичных спиртов, получают действие хлорангидридов или ангидридов на алкоголяты.
Название сложного эфира строится по названию углеводородного радикала в молекуле спирта (метил, этил и т.д.) с добавлением названия анионного остатка кислоты (ацетат, нитрат, сульфат, фосфат, карбонат и т.п.).

Часто сложные эфиры называют как спиртовые производные кислот, используя тривиальные названия последних. Например:
CH3O–СOCH3 – метиловый эфир уксусной кислоты (метилацетат),
C2H5O–NO2 – этиловый эфир азотной кислоты (этилнитрат) и т.п.
- Сложные эфиры органических кислот подробнее представлены в разделе “Карбоновые кислоты”.
- Среди сложных эфиров неорганических кислот важное значение имеют нитраты, сульфаты, фосфаты и карбонаты.
Нитраты получают действием на спирты азотной кислотой или нитрующей смесьюНитрующая смесь — смесь концентрированных азотной и серной кислот, при взаимодействии которых образуется активная нитрующая частица NO2+ (катион нитрония):
2H2SO4 + HNO3 → NO2+ + H3O+ + 2HSO4–..

Эфиры азотной кислоты являются взрывчатыми веществами (BB). На этом основано их использование во взрывотехнике, в производстве компонентов твёрдого ракетного топлива и бездымного пороха. Препараты из группы органических нитратов применяются в медицине как сосудорасширяющие средства при ишемической болезни сердца и стенокардии.
Наибольшее значение в производстве ВВ имеют нитраты многоатомных спиртов – глицерина, целлюлозы, пентаэритрита и т.п.
- Глицерин, в зависимости от условий проведения реакции и соотношения реагентов, может вступать в реакцию с азотной кислотой одной, двумя или тремя ОН-группами и образовывать моно-, ди- и тринитраты.
- Нитраты целлюлозы и пентаэритрита
Целлюлоза (клетчатка) – полимер β-глюкозы
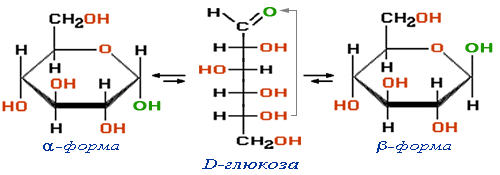
Спиртовые группы ОН выделены красным цветом
(зелёным отмечен полуацетальный гидроксил)., в каждом звене которого содержится 3 ОН-группы, при действии нитрующей смесью (HNO3+H2SO4) образует нитроцеллюлозу:
В зависимости от условий проведения реакции и соотношения реагентов могут быть получены мононитрат, динитрат или тринитрат целлюлозы.
Нитроцеллюлоза — крупнотоннажный продукт в производстве бездымного пороха, ранее применялась для получения целлулоида и нитроэмалей.Пентаэритрит (четырёхатомный спирт) при действии 5-ти кратным избытком 93-99% азотной кислоты, свободной от оксидов азота, образует тетранитрат пентаэритрита (пентаэритриттетранитрат, ТЭН).

Пентаэритриттетранитрат (ТЭН) используется в качестве инициирующего (детонирующие шнуры, детонаторы) и бризантного (в кумулятивных снарядах) взрывчатого вещества

Тривиальное название “нитроглицерин” даёт неверное представление о строении этого вещества, так как приставка “нитро” используется в названиях нитросоединений R-NO2 (например, CH3NO2 — нитрометан, C6H5NO2 — нитробензол).
Для устранения опасности самопроизвольного взрыва тринитрат глицерина наносится на твёрдый мелкопористый инертный носитель. Таким способом получают динамит. Создателем и основателем производства этого взрывчатого вещества был знаменитый шведский инженер-химик А.Нобель.
Сульфаты. Серная кислота
, являясь двухосновной, образует со спиртами сложные эфиры двух типов: кислыеКислые эфиры, сохраняющие кислотные функции (группу О-Н), называют также соответствующими кислотами. – алкилсульфаты (алкилсерные кислоты) и средние – диалкилсульфаты.

Алкилсульфаты малостабильны и существуют в виде равновесной смеси:
Равновесие смещается вправо путём отгонки диалкилсульфата.
Сульфаты образуют прежде всего первичные спирты. Для вторичных и третичных спиртов более характерны реакции дегидратации с образованием алкенов.
Для получения сульфатов вместо серной кислоты обычно используют более активные её производные: SO3 (серный ангидрид), SO2Cl2 (хлорангидрид серной кислоты, сульфурилхлорид), HSO3Cl (монохлорангидрид серной кислоты, хлорсульфоновая кислота).


Алкилсульфаты применяются в органическом синтезе как алкилирующие агенты (для введения алкильной группы).
Практическое значение имеют соли высших алкилгидросульфатов (алкилсерных кислот) в качестве поверхностно-активных веществ (ПАВ) различного назначения: моющие средства, эмульгаторы при полимеризации, смачиватели в производстве целлюлозы, мягчители шелка, антистатики полимеров и т.п. Один из наиболее известных представителей ПАВ — лаурилсульфат натрия
(додецилДодецил -С12Н25 — радикал алкана додекан С12Н26 (от греч.числительного додека — 12). В названии радикала заменяется глухая согласная “к” на “ц”. сульфат натрия) CH3(CH2)11OSO3Na, который входит в состав большинства моющих средств, шампуней, зубных паст и др. Это соль лаурилсерной кислоты, образованной взаимодействием лаурилового спирта (додеканола-1) и хлорсульфоновой кислоты (монохлорангидрида серной кислоты):
С12Н25ОН + HSO3Cl → C12H25OSO2OH + HCl
Природные органические сульфаты входят в группу биополимеров соединительных тканей животных. К ним относятся сульфаты полисахаридовПолисахариды — высокомолекулярные углеводы, полимеры моносахаридов (например, полисахарид целлюлоза состоит из звеньев моносахарида глюкозы).: хиндроитинсульфаты (например, хиндроитин-6-сульфат ), гепаритинсульфат (структурный элемент стенок кровеносных сосудов),
), гепаритинсульфат (структурный элемент стенок кровеносных сосудов),
гепарин (антикоагулянт крови, содержится в печени, лёгких, стенках сосудов).
(антикоагулянт крови, содержится в печени, лёгких, стенках сосудов).
Фосфаты — сложные эфиры трёхосновной фосфорной кислоты H3PO4 трёх видов: кислые RОРО(OН)2, (RО)2РО(OН) и полные (RО)3РО.

Cинтез фосфатов основан на реакции хлорангидрида фосфорной кислоты POCl3 со спиртами или фенолами:
3ROH + POCl3 (RO)3PO + 3HCl
Атомы Cl в POCl3 можно последовательно замещать на различные группы RO. Образующиеся первоначально хлорфосфаты при гидролизе превращаются в кислые фосфаты.

Многоатомные спирты способны вступать в реакцию поликонденсации и образовывать сложные полиэфиры фосфорной кислоты (фосфорорганические полимеры):

Применение. Органические фосфаты широко используются в качестве добавок для модификации пластмасс: пластификаторы, антипирены (для повышения огнестойкости) и др.; применяются как экстрагенты радиоактивных элементов из отработанного ядерного горючего и редко-земельных элементов из минерального сырья, флотореагенты, биологически безвредные ингибиторы коррозии металлов, лекарственные средства, пестициды и др. Некоторые фосфаты токсичны, а такие из них как зарин , табун и зоман относятся к нервно-паралитическим ядам. Фосфорорганические полиэфиры применяются как полимеры, обладающие высокой огнестойкостью, хорошей адгезией к металлам, стеклу и др. материалам.
, табун и зоман относятся к нервно-паралитическим ядам. Фосфорорганические полиэфиры применяются как полимеры, обладающие высокой огнестойкостью, хорошей адгезией к металлам, стеклу и др. материалам.
Роль в природе. Исключительно важное значение имеют фосфаты углеводов (сахаров), являющихся многоатомными спиртами. Фосфаты сахаров содержатся во всех растительных и животных организмах. Они участвуют в биохимических процессах фотосинтеза и обмена веществ. Универсальным источником энергии для реакций, протекающих в живых системах, служит аденозинтрифосфат (АТФ)
АТФ — аккумулятор и переносчик химической энергии в живых клетках..
Фосфаты рибозы и дезоксирибозы входят в состав нуклеотидов
входят в состав нуклеотидов
Нуклеотиды — мономерные звенья и промежуточные продукты
биосинтеза нуклеиновых кислот (ДНК, РНК) и нуклеотидкоферментов., которые при участии ферментов путём поликонденсации образуют полинуклеотиды (нуклеиновые кислоты
ДНК и РНКДНК — дезоксирибонуклеиновая кислота,
РНК — рибонуклеиновая кислота.). При этом взаимодействуют спиртовая ОН-группа одного нуклеотида с фосфатной группой другого. В результате образуется сахарофосфатная цепь макромолекул ДНК и РНК, состоящая из чередующихся остатков фосфорной кислоты и углевода (рибозы в РНК и дезоксирибозы в ДНК). Таким образом, все макромолекулы нуклеиновых кислот имеют единый сахарофосфатный остов,
а уникальность структур и функций этих биополимеров определяется набором и последовательностью
азотистых оснований
Азотистые основания — N-содержащие гетероциклические соединения: аденин, гуанин, цитозин, входящие в состав ДНК и РНК; тимин содержится только в ДНК, а урацил — только в РНК (подробнее см. Часть IV, “Гетероцикличес-кие соединения”). — боковых заместителей в главной цепи
(схема).
Схематически структуру макромолекул нуклеиновых кислот можно представить формулой:
— Азотистые основания: аденин, гуанин, тимин, цитозин, урацил, связанные с главной цепью как заместители.
О-сахар-О — остаток рибозы в РНК или дезоксирибозы в ДНК.

В живых клетках при рН≈7 фосфатные группы ионизированы.
Карбонаты — сложные эфиры угольной кислоты — образуются при взаимодействии фосгена COCl2 (полного хлорангидрида угольной кислоты) со спиртами или фенолами при повышенных температурах.
2ROH + COCl2 → RO–CO–OR + 2HCl
Практическое значение имеет производство поликарбонатовПоликарбонаты — сложные полиэфиры угольной кислоты и двухатомных фенолов или спиртов с общей формулой (-O-R-O-CO-)n., получаемых
при поликонденсации бисфенола АСистематическое название бисфенола А:
2,2-бис(4-гидроксифенил)пропан.
Часто употребляется техническое название – дифенилолпропан. (дианаДиан – название бисфенола А, данное в честь русского химика Александра Дианина, впервые получившего это соединение (1891 г.).) и фосгена:

Поликарбонат отличается высокой светопроницаемостью, ударопрочностью и термостойкостью. Благодаря сочетанию этих свойств, данный полимерный материал нашел широкое применение в строительстве и других отраслях народного хозяйства (изготовление линз, компакт-дисков, фар, очков, светотехнических изделий и др.). Важным фактором является экономичность и технологичность производства поликарбоната на основе диана, получаемого из доступных исходных веществ — фенола и ацетона — продуктов кумольного метода (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., Немцов М.С., 1949 г.).
Источник
