Какие системы проявляют буферные свойства
Огромную роль для нормального функционирования человеческого организма играет кислотно-основное равновесие. Циркулирующая в организме кровь представляет собой смесь живых клеток, которые находятся в жидкой среде обитания. Первой чертой охраны, что контролирует уровень pH в крови, выступает буферная система. Это физиологический механизм, который обеспечивает сохранение параметров кислотно-основного баланса, препятствуя перепадам pH. Что он собой представляет и какие имеет разновидности, узнаем ниже.
Описание
Буферная система – это уникальный механизм. В организме человека существует их несколько, и все они состоят из плазмы и клеток крови. Буферы представляют собою основания (белки и неорганические соединения), которые связывают или отдают Н+ и ОН-, уничтожая сдвиг pH в течение тридцати секунд. Способность буфера поддерживать кислотно-основный баланс зависит от количества элементов, из которых он слагается.
Виды буферов крови
Кровь, которая постоянно движется, представляет собой живые клетки, которые существуют в жидкой среде. pH в норме составляет 7,37-7,44. Связка же ионов происходит определенным буфером, классификация буферных систем приведена ниже. Сам же он состоит из плазмы и кровяных клеток и может быть фосфатным, белковым, бикарбонатным или гемоглобиновым. Все эти системы имеют достаточно простой механизм действия. Их деятельность нацелена на урегулирование уровня ионов в крови.
Особенности буфера гемоглобинового
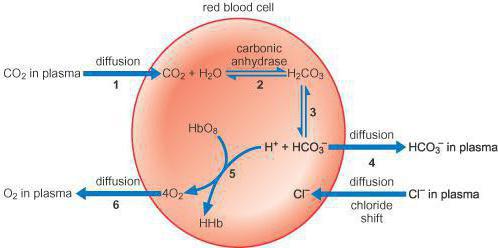
Гемоглобиновая буферная система является самой мощной из всех, она представляет собой щелочь в капиллярах тканей и кислоту в таком внутреннем органе, как легкие. На ее долю приходится около семидесяти пяти процентов всей буферной емкости. Этот механизм участвует во множестве процессах, что происходят в крови человека, и имеет в своем составе глобин. При переходе гемоглобинового буфера в другую форму (оксигемоглобин), наблюдается изменение этой формы, изменяются и кислотные свойства действующего вещества.
Качество восстановленного гемоглобина меньшее, чем у угольной кислоты, но становится намного лучше, когда он окисляется. Когда приобретается кислотность pH, гемоглобин соединяет ионы водорода, получается так, что он уже восстановленный. Когда происходит очищение углекислого газа в легких, pH получается щелочным. В это время гемоглобин, который окислился, выступает донором протонов, при помощи чего происходит уравновешивание кислотно-основного баланса. Так, буфер, что состоит из оксигемоглобина и его калиевой соли, способствует выделению из организма углекислоты.
Эта буферная система выполняет немаловажную роль в дыхательном процессе, так как совершает транспортную функцию по переносу к тканям и внутренним органам кислорода и удалению из них углекислоты. Кислотно-основное равновесие внутри эритроцитов при этом придерживается на постоянном уровне, следовательно, в крови также.
Таким образом, когда кровь насыщается кислородом, гемоглобин превращается в сильную кислоту, а когда кислород он отдает, то превращается в достаточно слабую органическую кислоту. Системы оксигемоглобина и гемоглобина – взаимопревращающиеся, они существуют как одно целое.

Особенности бикарбонатного буфера
Бикарбонатная буферная система выступает также мощной, но и самой управляемой в организме. На ее долю приходится около десяти процентов всей буферной емкости. Она имеет универсальные свойства, которые обеспечивают ее двухстороннюю эффективность. В состав этого буфера входит сопряженная кислотно-щелочная пара, что состоит из таких молекул, как угольная кислота (источник протона) и бикарбонат аниона (акцептор протона).
Так, бикарбонатная буферная система способствует протеканию систематического процесса, где в кровь попадает мощная кислота. Этот механизм связывает кислоту с бикарбонатом анионов, образуя кислоту угольную и ее соль. При попадании щелочи в кровь буфер связывается с угольной кислотой, образуя бикарбонатную соль. Так как гидрокарбоната натрия в крови человека больше, чем угольной кислоты, данная буферная емкость будет иметь высокую кислотность. Другими словами, гидрокарбонатная буферная система (бикарбонатная)очень хорошо проводит компенсацию веществ, которые повышают кислотность крови. К ним относится и молочная кислота, концентрация которой увеличивается при интенсивных физических нагрузках, а данный буфер очень быстро реагирует на изменения кислотно-основного баланса в крови.
Особенности фосфатного буфера
Фосфатная буферная система человека занимает близко двух процентов всей буферной емкости, что связано с содержанием в крови фосфатов. Этот механизм поддерживает показатель pH в моче и жидкости, что находится внутри клеток. Буфер состоит из неорганических фосфатов: одноосновного (выполняет роль кислоты) и двухосновного (выполняет роль щелочи). При нормальном показателе pH соотношение кислоты и основания равняется 1:4. При увеличении количества ионов водорода фосфатная буферная система связывается с ними, образуя кислоту. Этот механизм больше кислотный, чем щелочной, поэтому он отлично нейтрализует поступающие в кровь человека кислые метаболиты, например, молочную кислоту.
Особенности белкового буфера
Белковый буфер играет не такую особую роль в стабилизации кислотно-щелочного баланса, по сравнению с другими системами. На его долю приходится около семи процентов всей буферной емкости. Белки состоят из молекул, которые объединяются в кислотно-щелочные соединения. В кислой среде они выступают щелочами, которые связывают кислоты, в щелочной среде все происходит наоборот.
Это приводит к тому, что образуется белковая буферная система, которая достаточно эффективна при значении pH от 7,2 до 7,4. Большая доля белков представлена альбуминами и глобулинами. Так как белковый заряд нулевой, то при нормальном показателе pH он находится в виде щелочи и соли. Эта буферная емкость зависит от количества белков, их структуры и свободных протонов. Данный буфер может нейтрализовать и кислые, и щелочные продукты. Но емкость она имеет больше кислотную, чем щелочную.
Особенности эритроцитов
В норме эритроциты имеют постоянный показатель pH – 7,25. Здесь оказывают действие гидрокарбонатный и фосфатный буферы. Но по мощности они отличаются от тех, что находятся в крови. В эритроцитах белковый буфер играет особую роль в обеспечении органов и тканей кислородом, а также удалению из них углекислоты. Кроме этого, он поддерживает постоянное значение внутри эритроцитов pH. Белковый буфер в эритроцитах тесно связан с гидрокарбонатной системой, так как соотношение кислоты и соли здесь меньшее, чем в крови.
Пример буферной системы
Растворы сильных кислот и щелочей, которые обладаю слабыми реакциями, имеют непостоянный показатель pH. Но смесь кислоты уксусной с ее солью сохраняет имеет стабильное значение. Даже если к ним добавить кислоту или щелочь, кислотно-основное равновесие не изменится. В качестве примера можно рассмотреть ацетатный буфер, который состоит из кислоты СН3СООН и ее соли СН3СОО. Если добавить сильную кислоту, то основание соли свяжет ионы Н+ и превратится в кислоту уксусную. Снижение уровня анионов соли уравновешивается увеличением молекул кислоты. В результате этого наблюдается незначительное изменение в соотношении кислоты и ее соли, поэтому pH изменяется совсем незаметно.
Механизм действия буферных систем
При поступлении в кровь кислых или щелочных продуктов буфер обеспечивает постоянное значение pH до тех пор, пока поступившие продукты не выведутся или не используются в процессах метаболизма. В крови человека представлены четыре буфера, каждый из которых состоит из двух частей: кислоты и ее соли, а также сильной щелочи.
Эффект буфера обуславливается тем, что он связывает и нейтрализует ионы, которые поступают соответствующим ему составом. Поскольку в природе организм больше всего сталкивается с недоокисленными продуктами обмена, свойства буфер имеет антикислотные больше, чем антищелочные.
Каждая буферная система имеет свой принцип работы. При снижении уровня pH ниже отметки 7,0 начинается их активная деятельность. Они начинают связывать излишки свободных ионов водорода, образуя комплексы, которые перемещают кислород. Он, в свою очередь, перемещается к системе пищеварения, легким, коже, почкам и так далее. Такая транспортировка кислых и щелочных продуктов способствует их разгрузке и выведению.
В организме человека только четыре буферные системы играют важные роли в сохранении кислотно-основного равновесия, но существуют и другие буферы, например, ацетатная буферная система, которая имеет слабую кислоту (донор) и ее соль (акцептор). Способность этих механизмов противостоять изменениям pH при попадании кислоты или соли в кровь является ограниченной. Они поддерживают кислотно-щелочное равновесие только в том случае, когда сильная кислота или щелочь поступают в определенном количестве. Если оно будет превышено, pH резко изменится, буферная система прекратит свое действие.
Эффективность буферов
Буферы крови и эритроцитов имеют различную эффективность. У последних она выше, так как здесь присутствует гемоглобиновый буфер. Уменьшение количества ионов происходит по направлению от клетки до межклеточной среды, а затем до крови. Это говорит о том, что самая большая буферная емкость у крови, а меньшую имеет внутриклеточная среда.
При метаболизме в клетках появляются кислоты, которые проходят в межклеточную жидкость. Это происходит тем легче, чем их больше появляется в клетках, поскольку переизбыток ионов водорода увеличивает проницаемость мембраны клетки. Нам уже известна классификация буферных систем. В эритроцитах они имеют более эффективные свойства, так как здесь еще играют роль коллагеновые волокна, которые реагируют набуханием на накопление кислоты, они ее поглощают и освобождают от ионов водорода эритроциты. Такая его способность обуславливается свойством абсорбции.
Взаимодействие буферов в организме
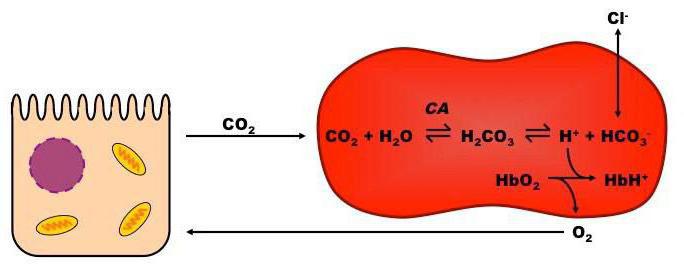
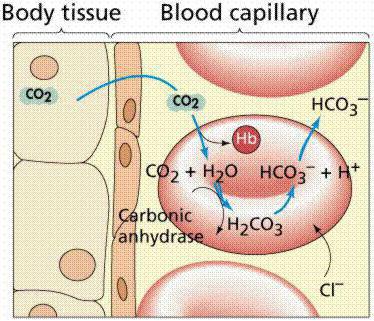
Все механизмы, которые находятся в организме, взаимосвязаны между собой. Буферы крови состоят из нескольких систем, вклад которых в поддержание кислотно-щелочного баланса различный. При попадании крови в легкие она получает кислород путем его связывания в эритроцитах гемоглобином, образуя оксигемоглобин (кислоту), что поддерживает уровень pH. При содействии карбоангидразы происходит параллельное очищение крови легких от углекислоты, которая в эритроцитах представлена в виде слабой двухосновной угольной кислотой и карбаминогемоглобином, а в крови – углекислотой и водой.
При уменьшении в эритроцитах количества слабой двухосновной угольной кислоты происходит проникновение ее из крови в эритроцит, и очищение крови от углекислоты. Таким образом, из клеток в кровь постоянно проходит слабая двухосновная угольная кислота, а из крови в эритроциты для соблюдения нейтральности поступают неактивные анионы хлорида. В результате этого в красных клетках крови среда более кислотная, чем в плазме. Все системы буферов обосновываются отношением донор-акцептор протона (4:20), что связано с особенностями метаболизма организма человека, который образует большее число кислотных продуктов, чем щелочных. Очень важным здесь является показатель кислотных буферных емкостей.

Обменные процессы в тканях
Кислотно-основной баланс поддерживается буферами и метаболическими превращениями в тканях организма. Этому помогают биохимические и физико-химические процессы. Они способствуют потере кислотно-щелочных свойств продуктов обмена веществ, их связыванию, образованию новых соединений, которые быстро выводятся из организма. Например, большое количество молочной кислоты выводится в гликоген, органические кислоты нейтрализуются солями натрия. Сильные кислоты и щелочи растворяются в липидах, а органические кислоты подвергаются окислению, образуя угольную кислоту.
Таким образом, буферная система – это первый помощник при нормализации кислотно-щелочного баланса в организме человека. Стабильность pH нужна для нормальной работы биологических молекул и структур, органов и тканей. При нормальных условиях буферные процессы поддерживают равновесие между появлением и удалением ионов водорода и углекислого газа, что способствует обеспечению в крови постоянного уровня pH.
Если происходит сбой в работе буферных систем, то у человека появляются такие патологии, как алкалоз или ацидоз. Все буферные системы взаимосвязаны и направлены на поддержание стабильного кислотно-основного равновесия. В организме человека постоянно образуется большое число кислых продуктов, которое эквивалентно тридцати литрам сильной кислоты.
Постоянство реакций внутри организма обеспечивают мощные буферы: фосфатный, белковый, гемоглобиновый и бикарбонатный. Существуют и другие буферные системы, но эти являются основными и самыми нужными для живого организма. Без их помощи у человека начнут развиваться различные патологии, которые могут привести к коме или летальному исходу.
Источник
Буферные системы – это системы, способные сохранять постоянное значение рН при разбавлении и при добавлении определенных количеств сильных кислот и оснований.
Буферные системы могут быть образованы:
1. слабой кислотой и ее солью (СН3СООН + СН3СООNa; С6Н5СООН + С6Н5СООNa; НСООН + НСООNa;)
2. слабым основанием и его солью (NН4ОН (NН3.Н2О) + NН4С1)
3. кислой и средней солью слабой кислоты (NаНСО3 + Nа2СО3; Nа2НРО4 + Nа3РО4)
4. одно- и двухзамещенной солью слабой кислоты (Nа2НРО4 + NаН2РО4)
Растворы, содержащие буферные смеси, способные вследствие этого противостоять изменению рН, называются буферными растворами.
Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. По мере увеличения концентрации буферного раствора возрастает его способность сопротивляться изменению рН при добавлении кислот или щелочей.
Буферная емкость – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу (понизить при добавлении кислоты и повысить при добавлении щелочи)
В | = | ν(1/Z*кислоты) | или | В | = | ν(1/Z*основания) |
ΔpH×V | ΔpH×V |
где V – объем буферного раствора, л.;
ν(1/Z*Х) – количество эквивалента кислоты или щелочи, моль;
ν(1/ Z*Х) = C(1/ Z*Х)×V(Х);
c(1/ Z*Х) – молярная концентрация эквивалента кислоты (щелочи), моль/л;
V(Х) – объем раствора кислоты (щелочи), л;
∆рН – изменение рН после добавления кислоты (щелочи).
Величина буферной емкости зависит от концентрации компонентов буферной смеси и их отношения между этими концентрациями. С увеличением концентрации компонентов буферной смеси буферная емкость увеличивается. При разбавлении буферной смеси буферная емкость уменьшается.
Буферная емкость максимальна при одинаковых концентрациях соли и кислоты или соли и основания в буферной смеси. Если молярные концентрации эквивалента кислоты и соли равны, то рН буферной смеси будет равен рК к-ты.
Следовательно, для приготовления буферной системы с наибольшей буферной емкостью надо выбирать кислоту с наиболее близкой к заданному значению рН величиной рКк-ты (рН ≈ рКк-ты).
Для смесей, образованных слабым основанием и его солью, рН = 14 – рКосн., т.е. рКосн. ≈ 14 – рН.
Свойства буферных растворов
1. рН буферного раствора зависит от отношения концентраций компонентов буферных систем, а также свойств буферной пары и растворителя.
2. Различные буферные растворы обладают определенной буферной емкостью и сохраняют постоянство рН только до прибавления определенного количества кислоты или щелочи.
3. Буферная емкость тем больше, чем выше концентрация компонентов буферного раствора. Максимальная буферная емкость наблюдается у растворов, которые содержат равные концентрации компонентов буферной пары.
Во внеклеточной и внутриклеточной жидкости существуют четыре основные буферные системы:
– бикарбонатная;
– белковая;
– гемоглобиновая;
– фосфатная.
Главными буферами внеклеточной жидкости является бикарбонатный и гемоглобиновый, в то время как белки и фосфаты — это основные внутриклеточные буферы.
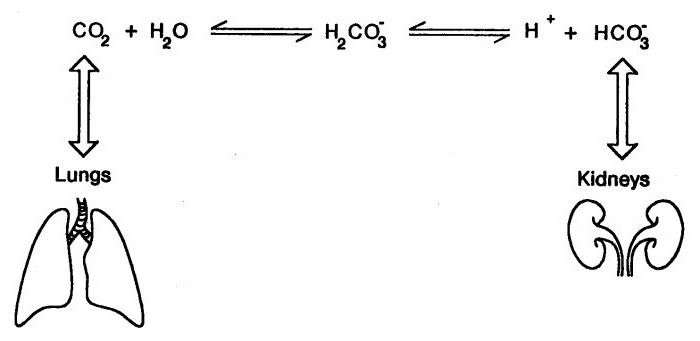
Бикарбонатный буфер является основным и наиболее лабильным внеклеточным буфером. Он состоит из угольной кислоты и бикарбоната (гидрокарбоната) натрия; константой, характеризующей буфер соотношение концентраций кислоты и ее кислой соли.
Внеклеточная буферная система угольной кислоты и гидрокарбоната натрия нейтрализует примерно 40% всех высвобождаемых ионов водорода.
Эта буферная система уникальна тем, что Н2СО3 может диссоциировать на Н2О воду и СО2. В то время как другие буферы быстро становятся неэффективными в результате связывания водородных ионов и анионов слабой кислоты, бикарбонатные системы поддерживают работоспособность в связи с удалением Н2СО3в виде СО2. Лимитирующим параметром эффективности бикарбонатной системы является, по сути дела, начальная концентрация бикарбоната
Гемоглобиновый буфер играет важную роль в регуляции концентрации Н+. Его буферная емкость определяется наличием полярных групп в аминокислотных остатках гемоглобина. Гемоглобин является более важным буфером по сравнению с другими белками, что определяется тремя причинами:
– относительно высокой молярной концентрацией гемоглобина;
– относительно высокой концентрацией в гемоглобине гистидина, рК которого (~7) близко к значению pH крови;
– ролью гемоглобина в транспорте газов крови.
Белковый буфер. Белки, отличные от гемоглобина, представляют собой относительно слабый буфер во внеклеточной жидкости, но в связи с высокой концентрацией белков внутри клеток эта буферная система важна в нейтрализации внутриклеточных сдвигов pH.
Фосфатная буферная пара (НРО2-4 и Н2РО-4) во внеклеточной жидкости представлена в низких концентрациях, но является важной буферной системой мочи.
Буферные системы организма
– Буферы ограничивают изменения pH, вызываемые внесением сильной кислоты или основания.
– Основные буферы внеклеточной жидкости — бикарбонатный и гемоглобиновый.
– Основные буферы внутриклеточной жидкости — белковый и фосфатный.
ПЛОТНОСТЬ ВОДЫ В ИНТЕРВАЛЕ -10÷100 °С
t, °С | ρ·10-3, кг/м3 | t, °С | ρ·10-3, кг/м3 | t, °С | ρ·10-3, кг/м3 | t, °С | ρ·10-3, кг/м3 | t, °С | ρ·10-3, кг/м3 |
-10 | 0,99815 | 17 | 0,99880 | 24 | 0,99732 | 35 | 0,99406 | 70 | 0,97781 |
-5 | 0,99930 | 18 | 0,99862 | 25 | 0,99707 | 40 | 0,99224 | 75 | 0,97489 |
0,99987 | 19 | 0,99843 | 26 | 0,99681 | 45 | 0,99025 | 80 | 0,97183 | |
4 | 1,00000 | 20 | 0,99823 | 27 | 0,99654 | 50 | 0,98807 | 85 | 0,96865 |
5 | 0,99999 | 21 | 0,99802 | 28 | 0,99626 | 55 | 0,98573 | 90 | 0,96534 |
10 | 0,99973 | 22 | 0,99780 | 29 | 0,99597 | 60 | 0,98324 | 95 | 0,96192 |
15 | 0,99913 | 23 | 0,99756 | 30 | 0,99567 | 65 | 0,98059 | 100 | 0,95838 |
16 | 0,99897 |
* Источник: Краткий справочник физико-химических величин. Издание десятое, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой – СПб.: «Иван Федоров», 2003 г. С. 15
Источник
Необходимым условием функционирования любого организма является поддержание динамического постоянства его внутренних сред, т.е. гомеостаза. В ходе различных биохимических реакций в организме постоянно образуются или расходуются Н+ или ОН-, поэтому значение рН внутренних сред должно непрерывно изменяться, но в результате согласованного действия различных систем организма (лёгких, печени, почек, органов пищеварения и др.) рН биологических жидкостей сохраняется постоянным.
Биологическая жидкость рН
Кровь 7,4 ± 0,5
Слюна 6,36 – 6,85
Моча 4,8 – 7,5
Желудочный сок 0,9 – 1,1
Слёзы 7,4
Грудное молоко 6,6 – 6,9
Особую роль в поддержании рН играют буферные растворы, которые состоят из одной или нескольких буферных систем.
Буферная система – это система, способная поддерживать постоянное значение рН при разбавлении её водой и при добавлении в неё определённых небольших количеств сильных кислот и оснований.
По составу буферные системы делят на 3 типа:
1) кислотные
2) основные
3) амфолитные
Кислотные буферные системы – это системы, состоящие из слабой кислоты и соли этой же кислоты, анион которой выполняет роль сопряжённого с ней основания. Примером может служить ацетатный буфер:
СН3СООН + CH3COONa
слабая кислота её соль- сильный электролит
CH3COONa → СН3СОО – + Na+
анион
СНЗСООН
кислота сопряженная кислотно-основная пара
СН3СОО –
основание
Основная буферная система состоит из слабого основания и соли этого основания, катион которого выполняет роль сопряжённой с ним кислоты. Примером является аммиачный (аммонийный) буфер:
NH4OH + NH4C1
слабое основание его соль – сильный электролит
NH4Cl → NH4+ + Cl-
катион
NH4OH
основание сопряженная кислотно-основная пара
NH4+
кислота
Амфолитная буферная система – это система, образованная амфотерным соединением, т.е. соединением, для которого характерны свойства и кислоты и основания одновременно. Примером может служить водный раствор белка, биополимера, мономерами которого являются аминокислоты.
Белковую структуру можно представить в виде схемы:
(СОО¯)n
Функция основания
R
(NH3+)m
Функция кислоты
R –углеводородный остаток белковой молекулы.
От чего зависит рН буферной системы, разберём на примере ацетатного буфера.
К дисс.кислоты
СН3СООН ↔ СН3СОО¯ + Н+ (1)
Слабый электролит
CH3COONа → СН3СОО¯ + Na+ (2)
Сильный электролит
В присутствии сильного электролита CH3COONa, диссоциирующего на ионы полностью, равновесие диссоциации слабого электролита СН3СООН подавляется (по правилу Ле-Шателье), поэтому [СНзСОО¯] = Ссоли , а [СНзСООН] = Скислоты .
[СН3СОО¯]*[Н+]
Кдисс= ———————-=> [Н+]
[СН3СООН]
Кдисс кисл* [СН3СООН] Кдисс.кисл * С кисл
[Н+] = ——————————-= ———————-
[СН3СОО¯] С соли
Прологарифмируем с отрицательным знаком:
С кисл
– lg [Н+] = – lg Кдисс кисл – lg ————
С соли
С соли
рH = рКкислоты+ lg ———–
С кисл
Полученное уравнение носит название уравнения Гендерсона -Хассельбаха для расчета рН кислотных буферных систем.
Для основных буферных систем:
С соли
рH = 14 – ( рКоснования +lg ——– )
С осн
Факторы, определяющие рН буферных систем, следуют из анализа уравнения Гендерсона-Хассельбаха:
1) природа слабой кислоты или слабого основания, которые определяют рК кислоты или рК основания;
2) соотношение концентраций компонентов буферной системы.
На практике вместо молярных концентраций компонентов часто используют число их эквивалентов:
Vсоли * Ncоли
рН = рКкисл + lg —————–
Vкисл* Nкисл
V – объём компонента буфера ; N – его нормальная концентрация
Vсоли * Ncоли
рОН = рКосн + lg —————–; рН= 14 – рОН
Vосн* Nосн
Источник
