Какие реакции являются окислительно восстановительными свойствами

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 декабря 2017;
проверки требуют 32 правки.
Окисли́тельно-восстанови́тельные реа́кции (ОВР), также редокс (сокр. англ. redox, от reduction-oxidation — восстановление-окисление) — встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором) .
Историческая справка[править | править код]
Издавна учёные полагали, что окисление — потеря флогистона (особого невидимого горючего вещества, термин которого ввел Иоганн Бехер), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения, к началу XIX века химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Описание[править | править код]
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление[править | править код]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окисле́нии у веществ в результате отдачи электронов увеличивается степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель (сам процесс называется окислением):
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Восстановление[править | править код]
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель (сам процесс называют восстановлением):
окислитель + e− ↔ сопряжённый восстановитель.
Окислительно-восстановительная пара[править | править код]
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций[править | править код]
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных
веществ, например:
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
Примеры[править | править код]
Окислительно-восстановительная реакция между водородом и фтором
Разделяется на две полу-реакции:
1) Окисление:
2) Восстановление:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны, являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два метода уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
Примечания[править | править код]
- ↑ В этом, как и во многих других случаях водород рассматривают как помещённый в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. То есть валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется в виду в том числе и валентности.
- ↑ ОВР методом полуреакций (недоступная ссылка). Химия и химическая технология в жизни (10.07.2013). Дата обращения 19 января 2015. Архивировано 19 января 2015 года.
Литература[править | править код]
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углублённый курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
См. также[править | править код]
- Кислотно-основные реакции
Источник
Все химические реакции можно разделить на два типа:
1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
Реакции второго типа называются окислительно-восстановительными.
Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg0 = Mg+2 + 2ē (или: Mg0 — 2ē = Mg+2) (4.1.4)
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
O2 + 4ē = 2O-2 (4.1.5)
В реакции 4.1.3 атомы хлора, которые в молекулах HCl имеют степень окисления —1 , отдают по одному электрону и превращаются в нейтральные атомы хлора, которые соединяются попарно и образуют молекулы хлора Сl2:
Cl-1 = Cl0 + 1ē; Cl0 + Cl0 = Cl2
или суммарно:
2Cl-1 = Cl2 + 2ē (4.1.6)
Атом марганца, который в исходном веществе (KМnО4) имеет степень окисления +7, присоединяет 5 электронов и превращается в атом марганца со степенью окисления +2 (такую степень окисления он имеет в молекуле продукта реакции MnCl2):
Mn+7 + 5ē = Mn+2 (4.1.7)
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электронов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса электронов. Таким образом, любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления алгебраическая величи на степени окисления элемента повышается.
В рассмотренных примерах процессы 4.1.4 и 4.1.6 являются процессами окисления.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления алгебраическая величина степени окисления понижается.
Процессы 4.1.5 и 4.1.7 являются примерами процессов восстановления.
Частицы (атомы, молекулы, ионы), которые отдают электроны, называются восстановителями.
В реакциях 4.1.2 и 4.1.3 восстановителями являются соответственно Mg и НCl.
Частицы, которые присоединяют электроны, называются окислителями.
В реакциях 4.1.2 и 4.1.3 окислителями являются соответственно O2 и KМnО4.
Следовательно, в общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
Восстановитель + Окислитель = Продукты реакции
Восстановитель участвует в процессе окисления, т. е. окисляется. А окислитель участвует в процессе восстановления, т. е. восстанавливается.
Важнейшие окислители и восстановители
Какие же вещества могут быть окислителями и какие восстановителями? Это зависит от величины степеней окисления элементов, которые входят в состав данных веществ. Как известно, некоторые элементы имеют постоянные степени окисления во всех или в большинстве сложных веществ. Для таких элементов изменение степеней окисления нехарактерно. Поэтому свойства веществ обычно не зависят от присутствия этих элементов. Элементы с переменной степенью окисления, как правило, легко ее изменяют, т. е. могут участвовать в процессах отдачи или присоединения электронов. Поэтому свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя.
Например, свойства перманганата калия KМnО4 определяются степенью окисления марганца (калий и кислород — элементы с постоянной степенью окисления). Марганец в KМnО4 имеет высшую степень окисления +7, поэтому KМnО4 может быть только окислителем.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя.
Например, свойства аммиака NH3 определяются степенью окисления азота (для водорода степень окисления +1 является практически постоянной). Азот в NH3 имеет низшую степень окисления —3, поэтому NH3 может быть только восстановителем.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. может участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем, и восстановителем. Это зависит от второго участника реакции.
Например, свойства сульфита натрия Na2SО3 определяются степенью окисления серы, которая имеет промежуточную степень окисления +4. Поэтому Na2SО3 проявляет окислительно-восстановительную двойственность. В реакции с перманганатом калия:
сульфит натрия окисляется до сульфата натрия, т. е. выступает в роли восстановителя. Это обусловлено тем, что KМnО4 может быть только окислителем (см. выше). А в реакции с сероводородом:
сульфит натрия восстанавливается до свободной серы, т. е. выступает в роли окислителя, так как H2S может быть только восстановителем (сера в H2S находится в низшей степени окисления).
Важнейшими окислителями являются:
а) простые вещества-неметаллы с наибольшими значениями электроотрицательности — фтор F2, кислород О2;
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия KМnО4, хроматы и дихроматы (например, дихромат калия K2СrО7), азотная кислота HNO3 и ее соли — нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) РbО2, хлорная кислота HClO4 и ее соли — перхлорат и др.
Важнейшими восстановителями являются:
а) все простые вещества-металлы. Наиболее активными восстановителями являются щелочные и щелочноземельные металлы, магний Mg, алюминий Аl, цинк Zn;
б) сложные вещества, молекулы которых содержат элементы в низшей степени окисления — метан силан SiH4, аммиак NH3, фосфин PН3, нитриды и фосфиды металлов (например, Na3N, Са3Р2), сероводород Н2S и сульфиды металлов, гaлогеноводороды HI, НВr НСl и галогениды металлов, гидриды металлов (например, NaH, СаН2) и др.
Среди веществ, содержащих элементы в промежуточных степенях окисления, есть вещества, для которых более характерными являются или окислительные, или восстановительные свойства. Обычно являются окислителями галогены Сl2 и Br2, хлорноватистая кислота НClО и ее соли — гипохлориты, хлораты (KСlO3 и др.), оксид марганца (IV) МnO2, соли трехвалентного железа (FeCl3 и др.). Как правило, в роли восстановителей выступают водород Н2, углерод С, оксид углерода (II) СО, сульфиты металлов (Na2SO3 и др.), соли двухвалентного железа (FeSO4 и др.).
Типы окислительно-восстановительных реакций
Различают 3 типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ. Примерами данного типа реакций являются
2) Внутримолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества. Например:
К этому типу ОВР относятся многие реакции термического разложения веществ.
З) Реакции самоокисления-самовосстановления, называемые также реакциями диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента. Например:

Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:![]()
а) Определим степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции:
в) Составим уравнения процессов окисления и восстановления:
Обратите внимание, что в левой части уравнения процесса окисления взято два атома брома, так как продуктом окисления является двухатомная молекула брома Br2.
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и присоединенных электронов будут равны. Так как наименьшим общим кратным чисел «5» и «2» является «10», то уравнение процесса восстановления нужно умножить на «2», а уравнение процесса окисления — на «5»:
Два атома Мn+7 присоединяют 10 электронов, а 10 атомов Br-1 отдают 10 электронов, т. е. выполняется основное правило метода электронного баланса.
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие в процессах окисления и восстановления:![]()
е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.![]()
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и в правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно (в составленном уравнении 40 атомов кислорода и в левой, и в правой частях).
Рассмотрим некоторые более сложные примеры составления уравнений ОВР.
Составим уравнение реакции, которая протекает по следующей схеме:![]()
Определим степени окисления всех элементов и подчеркнем символы элементов, которые изменяют свои степени окисления: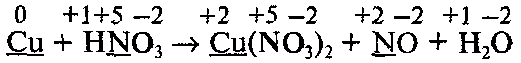
Составим уравнения процессов окисления и восстановления и найдем множители, на которые нужно умножить эти уравнения:

Обратите внимание, что не все атомы азота, которые входят в состав HNО3, изменяют свою степень окисления: часть атомов азота без изменения степени окисления переходит в молекулы Cu(NO3)2 Поэтому найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Сu и N, кроме формулы HNO3:![]()
Коэффициент перед формулой HNO3 равен общему числу атомов азота в правой части уравнения, т. е. равен 8 (из них 6 атомов, которые не изменяют степень окисления):![]()
В последнюю очередь уравниваем числа атомов водорода и кислорода:![]()
В некоторых ОВР более двух элементов изменяют свои степени окисления. В качестве примера рассмотрим следующую реакцию:
Два элемента — фосфор и сера — в ходе этой реакции окисляются, один элемент — азот — восстанавливается:

Общее число электронов, которые участвуют в процессах окисления, равно 22; в процессе восстановления участвует 1 электрон. Поэтому общий множитель для двух уравнений процессов окисления равен 1, а множитель для уравнения процесса восстановления равен 22. Запишем эти множители в качестве коэффициентов перед формулами соответствующих веществ:![]()
В заключение уравняем числа атомов водорода и кислорода:![]()
Источник
