Какие различия в свойствах веществ используют
«Вещества и их свойства. Чистые вещества и смеси»
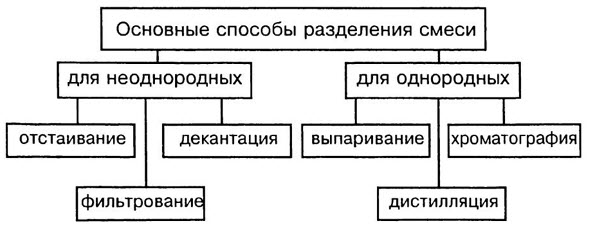
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
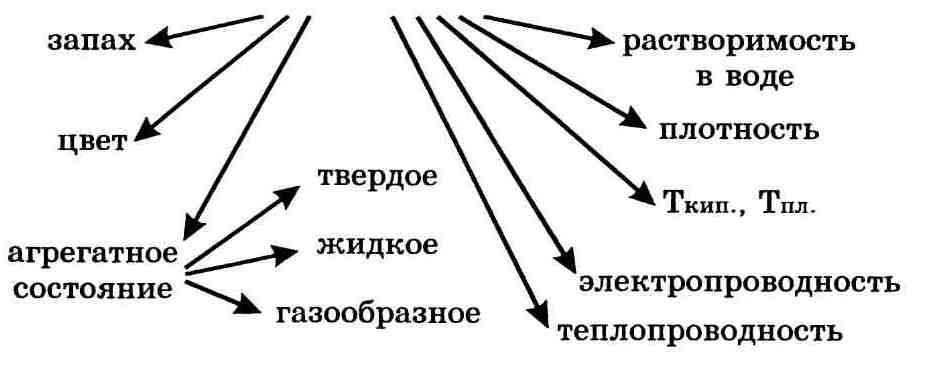
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
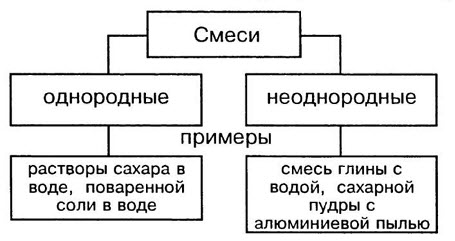
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.

Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Следующая тема: «Физические и химические явления».
Источник
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Это интересно: Химические свойства кислорода
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Источник
 Рис. 1. Вид капли молока под микроскопом
Рис. 1. Вид капли молока под микроскопомПредмет и метод химии. Каждый отдельный вид материи, обладающий при определенных условиях постоянными физическими свойствами как, например, вода, железо, сера, известь, кислород и т. д., в химии называют веществом.
Встречающиеся в природе вещества бесконечно разнообразны. Сравнивая, например песок, воду, мел, серу, можно сразу же убедиться, что это совершенно различные вещества, даже внешне не похожие друг на друга.
Каждое вещество характеризуется определенными свойствами. Возьмем, например, кусок серы. Исследуя его, прежде всего отмечаем, что это вещество светло-желтого цвета, хрупкое, имеет кристаллическое строение, нерастворимо в воде. Далее, определяя удельный вес серы, находим его равным 2,07.
Подвергая серу нагреванию, устанавливаем, что она плавится при 112,8°, и т. д. Все эти характерные особенности серы являются ее физическими свойствами.
На какие вещества
Величины, количественно выражающие физические свойства вещества, — удельный вес, температуру плавления, растворимость и др., имеющие при определенных условиях постоянные значения, называются физическими константами (от латинского слова constans — постоянный).
Для установления свойств вещества необходимо иметь его возможно более чистым, так как даже незначительные примеси могутизменить числовые значения констант изучаемого вещества. Только чистое вещество, обладает определенными, постоянными свойствами.
Вещества в чистом виде в природе встречаются очень редко. В большинстве случаев природные вещества представляют собой смеси, состоящие иногда из очень большого числа различных веществ. Так, например, природная вода всегда содержит небольшое количество минеральных солей. Когда одно из веществ содержится в смеси в преобладающем количестве, то вся смесь носит его название. При этом иногда указывается, какие примеси и в каком количестве содержатся в основном веществе. Если количество примесей настолько ничтожно, что они не могут служить помехой при исследовании или применении данного вещества, то такое вещество называют «химически чистым».
Абсолютно чистые вещества не известны. Условно говорят о «химически чистой» соляной кислоте или о «химически чистой» азотной кислоте, понимая под этим раствор, в котором не содержится ничего, кроме кислоты и воды. Вотличие от «химически чистых» кислот «технические» кислоты содержат, кроме воды, различные примеси.
Чистое вещество всегда однородно, смеси же могут быть однородными или неоднородными.
Однородными условно называют смеси двух или нескольких веществ, в которых ни непосредственно, ни при помощи микроскопа нельзя обнаружить частиц этих веществ вследствие ничтожно малой их величины. Такими смесями являются смеси газов, многие жидкости, некоторые сплавы и др.
Примерами неоднородных смесей могут служить различные горные породы, почва, мутная вода, пыльный воздух и т. д.
Не всегда неоднородность смеси сразу заметна, в некоторых случаях ее можно обнаружить только при помощи микроскопа. Например, кровь с первого взгляда представляется совершенно однородной красной жидкостью, но при рассматривании ее в микроскоп видно, что она состоит из бесцветной жидкости, в которой плавают красные небелые тельца.
Молоко тоже является неоднородной смесью, так как содержит капельки жира, взвешенные в бесцветной жидкости (рис. 1).
Повседневно мы можем наблюдать, что вещества подвергаются различным изменениям: вода, пролитая на пол, «высыхает», превращаясь в невидимый пар; железный предмет во влажном воздухе покрывается ржавчиной; дрова в печи сгорают, оставляя лишь небольшую кучку пепла; опавшие листья деревьев постепенно истлевают, превращаясь в темную массу перегноя, и т.д.
Когда свинцовая пуля, вылетевшая из ствола винтовки, ударяется о камень, она нагревается так сильно, что свинец плавится, превращаясь в жидкость. Здесь механическое движенце пули переходит в тепловое движение частиц свинца, но этот переход не сопровождается химическим изменением свинца — твердый и жидкий свинец представляют собой одно и то же вещество, только находящееся в различных агрегатных состояниях. Никакого нового вещества при этом превращении не образуется.
Иначе обстоит дело, когда свинец в результате продолжительного нагревания превращается в окись свинца (глет). В этом случае вместо свинца получается совершенно новое вещество с другими свойствами, качественно отличное от свинца. Точно так же при ржавлении железа, горении дров, гниении листьев образуются новые вещества, не похожие на первоначальные.
Явления, сопровождающиеся коренными изменениями вещества, при которых из одних веществ образу ются другие, новые вещества, называются химическими. Изучением таких явлений занимается химия. Следовательно, химия есть наука о превращениях веществ. Она изучает состав и строение веществ, зависимость свойств вещества от его состава и строения, условия и пути превращения одних веществ в другие.
Химические изменения всегда сопровождаются изменениями физическими. Поэтому химия теснейшим образом связана с физикой. Очень тесно связана химия и с биологией, поскольку всякий жизненный процесс сопровождается непрерывными химическими превращениями веществ в организме, непрерывным обменом веществ между организмом и окружающей его средой. Однако, хотя химические явления и связаны с физическими, так же как биологические связаны с химическими и физическими, химия не может быть сведена к физике, а биология к физике и химии, так как каждая форма движения материи имеет свои особенности.
Bхимии, как и в других науках, изучение всякого явления начинается прежде всего с его наблюдения и описания. Но наука не ограничивается одним только описанием наблюдаемых явлений; ее важнейшей задачей является их объяснение. Впоисках объяснений явлений мы стараемся глубже проникнуть в их сущность, выяснить причины, вызывающие их, установить условия, при которых явления могут происходить. Для этого приходится искусственно воспроизводить различные явления в наиболее удобных для их изучения условиях и обстановке. Такое искусственное воспроизведение явления называется опытом. Чаще всего опыт производится для проверки справедливости мыслей или предположений, возникающих при изучении явления.
Предположения, выдвигаемые для объяснения данного явления, устанавливающие его связь с другими, ранее изученными явлениями, объединяющие несколько явлений одной общей идеей, называются гипотезами.Если следствия, логически вытекающие из сделанного предположения, подтверждаются опытом, если гипотеза не только объясняет данное явление, но и позволяет делать обобщающие выводы, позволяет предугадывать новые явления, то гипотеза становится теорией.Если же опыт не подтверждает выдвинутую гипотезу, то она отбрасывается.
Теория, являясь широким обобщением опыта, значительно облегчает изучение явлений, позволяет понять их глубже и правильней. В то же время она дает направление и указания для постановки новых опытов, имея, таким образом, не только познавательное, но и методологическое значение. Теория позволяет вести исследования не вслепую, а планомерно, руководствуясь определенной точкой зрения, опираясь на уже установленные закономерности.
Особенно важными теоретическими обобщениями в химии, обеспечившими успехи этой науки, являются: атомно-молекулярное учение, теория химического строения, периодический закон и периодическая система химических элементов.
Вы читаете, статья на тему Вещества и их изменения
Источник
