Какие простые и сложные вещества содержаться в воздухе

Упражнение: 1
![]() Филео (греч.) означает «люблю», фобос – «боюсь». Дайте объяснение терминов «хемофилия» и «хемофобия», отражающих резко противоположное отношение групп людей к химии. Кто из них прав? Обоснуйте свою точку зрения.
Филео (греч.) означает «люблю», фобос – «боюсь». Дайте объяснение терминов «хемофилия» и «хемофобия», отражающих резко противоположное отношение групп людей к химии. Кто из них прав? Обоснуйте свою точку зрения.
![]() «Хемофилия» – интерес, склонность к химии. Также люди увлеченные наукой химией, интересующиеся ею, считающие, что современный мир невозможен без разработок новых химических веществ, и относящиеся положительно к производству химических веществ нужных в промышленности, сельском хозяйстве, космической индустрии, пищевой промышленности, в быту и т.д.
«Хемофилия» – интерес, склонность к химии. Также люди увлеченные наукой химией, интересующиеся ею, считающие, что современный мир невозможен без разработок новых химических веществ, и относящиеся положительно к производству химических веществ нужных в промышленности, сельском хозяйстве, космической индустрии, пищевой промышленности, в быту и т.д.
«Хемофобия» – неприятие химии и всего химического, противопоставление «химического» и «натурального». (Например, при выращивании растений в пищу.) Также люди, отрицательно относящиеся, к химии приводят, в пример загрязнение окружающей среды почвы, воды, воздуха. Это ведет к повышению заболеваемости людей и животных, живущих рядом с химическими производствами.
Правы и «хемофилы» и «хемофобы» – без химии невозможно существование современного мира, но создание безотходных, не отравляющих окружающую природу производств, создание производств по вторичной переработке различных пластиковых и иных отходов абсолютно необходимо. Химия – это только наука, а пользу или вред она приносит людям зависит от самих людей.
Упражнение: 5
![]() Сравните понятие «простое вещество» и «сложное вещество». Найдите сходство и различие.
Сравните понятие «простое вещество» и «сложное вещество». Найдите сходство и различие.
![]() Общее у простых и сложных веществ, то, что они состоят из молекул и атомов.
Общее у простых и сложных веществ, то, что они состоят из молекул и атомов.
Разное: простые состоят из атомов одного химического элемента, а сложные – из атомов разных химических элементов.
Упражнение: 6
![]() Определите, какие из веществ, модели молекул которых изображены на рисунке 6, относят: а) к простым веществам; б) к сложным веществам.
Определите, какие из веществ, модели молекул которых изображены на рисунке 6, относят: а) к простым веществам; б) к сложным веществам.
![]() Простые вещества: кислород, сера, гелий, озон.
Простые вещества: кислород, сера, гелий, озон.
Сложные вещества: этиловый спирт, метан, углекислый газ, угарный газ.
Упражнение: 8
![]() Укажите, где о кислороде говорится как о химическом элементе, а где – как о простом веществе:
Укажите, где о кислороде говорится как о химическом элементе, а где – как о простом веществе:
в) в воздухе содержится 20% кислорода (по объему);
г) кислород входит в состав углекислого газа.
![]() О химическом элементе:
О химическом элементе:
б) молекулы воды состоят из двух атомов водорода и одного атома кислорода;
г) кислород входит в состав углекислого газа.
О простом веществе:
а) кислород мало растворим в воде;
в) в воздухе содержится 20% кислорода (по объему).
Упражнение: 10
![]() Рассмотрите связь между свойствами вещества и его применением на примере: а) стекла; б) полиэтилена; в) сахара; г) железа.
Рассмотрите связь между свойствами вещества и его применением на примере: а) стекла; б) полиэтилена; в) сахара; г) железа.
![]() Стекло: твёрдое, прозрачное вещество, при плавлении способно принимать различную форму и сохранять её, не ядовито. На этих свойствах основано применение стекла в производстве оконных стекол, посуды, в оптических приборах.
Стекло: твёрдое, прозрачное вещество, при плавлении способно принимать различную форму и сохранять её, не ядовито. На этих свойствах основано применение стекла в производстве оконных стекол, посуды, в оптических приборах.
Полиэтилен: легкое, пластичное вещество, не ядовито, способно вытягиваться в тонкие пленки, при плавлении способно принимать различную форму и сохранять её. На этих свойствах основано применение полиэтилена в производстве одноразовой посуды, упаковочного материала, в производстве труб.
Сахар: белое твердое вещество хорошо растворимо в воде не ядовито, без запаха, имеет сладкий вкус. Его используют в пищу, также применяют в пищевой промышленности и медицине.
Железо: серебристо-белый блестящий металл, Тпл.= 15390С, пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется, тепло- и электропроводный. Железо способно намагничиваться и размагничиваться, его применяют в качестве сердечников электромагнитов в различных электрических машинах и аппаратах.
Железо – это основа современной техники и сельскохозяйственного машиностроения, транспорта, средств связи всей современной цивилизации. От швейной иглы до космической техники.
Упражнение: 2
![]() Обязательный атрибут бесконечного множества шпионских и прочих детективных произведений – цианистый калий, точнее цианид калия, который обладает свойством парализовывать нервную систему, приводя тем самым жертву к мгновенной смерти. Приведите примеры свойств других веществ, которые используются в литературных произведениях.
Обязательный атрибут бесконечного множества шпионских и прочих детективных произведений – цианистый калий, точнее цианид калия, который обладает свойством парализовывать нервную систему, приводя тем самым жертву к мгновенной смерти. Приведите примеры свойств других веществ, которые используются в литературных произведениях.
![]()
В произведении Артура Конан Дойла «Собака Баскервилей» – упоминается о фосфоре (светящемся веществе).
Упражнение: 3
![]() Из приведенного перечня выпишите отдельно названия веществ и названия тел: медь, монета, стекло, стакан, ваза, керамика, проволока, алюминий. Воспользуйтесь подсказкой: к названию тела – существительному – можно подобрать относительное прилагательное, образованное от названия вещества, например: железо и гвоздь – железный гвоздь.
Из приведенного перечня выпишите отдельно названия веществ и названия тел: медь, монета, стекло, стакан, ваза, керамика, проволока, алюминий. Воспользуйтесь подсказкой: к названию тела – существительному – можно подобрать относительное прилагательное, образованное от названия вещества, например: железо и гвоздь – железный гвоздь.
![]() Вещества: медь, стекло, керамика, алюминий.
Вещества: медь, стекло, керамика, алюминий.
Тела: монета, стакан, ваза, проволока.
Упражнение: 4
![]() Выпишите качественные прилагательные: легкий, круглый, длинный, тяжелый, пахучий, растворимый, увесистый, вогнутый, мягкий, жидкий, прозрачный – которые могут быть отнесены:
Выпишите качественные прилагательные: легкий, круглый, длинный, тяжелый, пахучий, растворимый, увесистый, вогнутый, мягкий, жидкий, прозрачный – которые могут быть отнесены:
а) к веществам; б) к телам; в) и к телам, и к веществам.
![]() Вещества: твердый, растворимый, жидкий, тяжелый, прозрачный, пахучий.
Вещества: твердый, растворимый, жидкий, тяжелый, прозрачный, пахучий.
Тела: тяжелый, увесистый, вогнутый, мягкий, твердый, пахучий, прозрачный, жидкий.
Вещества и тела: твердый, жидкий, прозрачный, пахучий.
Упражнение: 7
![]() Какое понятие более широкое: химический элемент или простое вещество? Дайте доказательный ответ.
Какое понятие более широкое: химический элемент или простое вещество? Дайте доказательный ответ.
![]()
Понятие химический элемент более широкое, чем простое вещество. Например, когда говорят о том, что в состав воды входит водород, то имеют ввиду химический элемент, а когда говорят о том, что водород – экологически чистый вид топлива, то имеют в виду простое вещество.
Упражнение: 9
![]() Укажите, где о водороде говорится как о простом веществе, а где – как о химическом элементе:
Укажите, где о водороде говорится как о простом веществе, а где – как о химическом элементе:
а) водород входит в состав большинства органических соединений;
б) водород – самый легкий газ;
в) водородом заполняют воздушные шары;
г) молекула метана содержит четыре атома водорода.
![]() О химическом элементе:
О химическом элементе:
а) водород входит в состав большинства органических соединений;
г) молекула метана содержит четыре атома водорода.
О простом веществе:
б) водород – самый легкий газ;
в) водородом заполняют воздушные шары;
Источник
Задача 1. «Чистые вещества и смеси»
- Закончите фразы:
- (а) Состав индивидуального вещества в отличие от состава смеси __________ и может быть выражен химическ__ __________;
- (б) __________ в отличие от __________ кипит при постоянной __________.
- Какая из двух жидкостей – ацетон и молоко – представляет собой индивидуальное вещество, а какая – смесь?
- Вам надо доказать, что выбранное Вами вещество (одно из двух в п. 2) – смесь. Кратко опишите Ваши действия.
Решение
- (а) Состав индивидуального вещества в отличие от состава смеси постоянен и может быть выражен химической формулой; (б) индивидуальное вещество в отличие от смеси веществ кипит при постоянной температуре.
- Ацетон – индивидуальное вещество, молоко – смесь.
- Поместим капли обеих жидкостей в микроскоп. Молоко под микроскопом будет неоднородно. Это – смесь. Ацетон под микроскопом будет однородным.
Другое возможное решение: ацетон кипит при постоянной температуре. Из молока при кипячении испаряется вода, на поверхности молока образуется плёнка – пенка. Принимаются также другие разумные доказательства.
Система оценивания:
| 1) По 2 балла за каждую фразу | 4 балла |
| 2) За правильный ответ | 2 балла |
| 3) За мотивировку | 4 балла |
| Всего – 10 баллов |
Задача 2. «Распространённое вещество»
«Это сложное вещество широко распространено в природе. Встречается по всему земному шару. Не имеет запаха. При атмосферном давлении вещество может находиться только в газообразном и твёрдом состояниях. Многие учёные считают, что это вещество оказывает влияние на повышение температуры нашей планеты. Применяется в различных производствах, в том числе и пищевой промышленности. Используется при тушении пожаров. Однако в химической лаборатории им нельзя тушить горящие металлы, например магний. Напитки, приготовленные с этим веществом, очень любят дети. Но постоянное потребление таких напитков может вызвать раздражение стенок желудка».
- Определите вещество на основе его описания.
- Какие названия этого вещества Вам известны?
- Приведите известные Вам примеры применения и назовите источники образования этого вещества.
Решение и критерии оценивания
- Названо вещество – углекислый газ (оксид углерода (IV)) (4 балла). Возможный ответ – вода – считать неправильным. Вода не раздражает желудок.
- Сухой лёд, углекислота, угольный ангидрид (по 1 баллу за каждый ответ).
- Углекислый газ применяется в производстве газированных напитков, сахарном производстве, при тушении пожаров как хладагент и пр. Образуется при дыхании животных организмов, брожении, гниении органических остатков, в производстве негашёной извести, сжигании органических веществ (торфа, древесины, природного газа, керосина, бензина и т. д.) (По одному баллу за пример, но не более 3-х баллов). Всего – 10 баллов.
Задача 3. «Атомные доли»
Состав химических соединений часто характеризуют с помощью атомных долей. Так, молекула углекислого газа CO2 состоит из одного атома C и двух атомов O, всего в молекуле три атома. Тогда атомная доля C равна 1/3, атомная доля O – 2/3.
Приведите по одному примеру веществ, в которых атомные доли составляющих их элементов равны:
- 1/2 и 1/2;
- 2/5 и 3/5;
- 1/3, 1/3 и 1/3;
- 1/6, 1/6 и 2/3;
- 1.
Решение
- Два элемента, число атомов в молекуле (формульной единице) одинаково: HCl, HgO, CO.
- Два элемента, атомов одного из них в молекуле (формульной единице) – 2, другого – 3: Al2O3, Fe2O3.
- Три элемента, всех атомов поровну: KOH, NaOH.
- Три элемента: атомов двух из них в молекуле (формульной единице) поровну, а третьего элемента в 4 раза больше: KMnO4, CuSO4.
- Любое простое вещество.
По 2 балла за каждый пункт.
Всего – 10 баллов.
Задача 4. «Вдох-выдох»
В процессе дыхания человек потребляет кислород и выдыхает углекислый газ. Содержание этих газов во вдыхаемом и выдыхаемом воздухе приведено в таблице.
| Воздух | O2 (% по объёму) | CO2 (% по объёму) |
| Вдыхаемый | 21 % | 0,03 % |
| Выдыхаемый | 16,5 % | 4,5 % |
Объём вдоха-выдоха – 0,5 л, частота нормального дыхания – 15 вдохов в мин.
- Сколько литров кислорода потребляет человек за час и сколько выделяет углекислого газа?
- В классе объёмом 100 м3 находятся 20 человек. Окна и двери закрыты. Каким будет объёмное содержание CO2 в воздухе после урока длительностью 45 минут? (Совершенно безопасное содержание – до 0,1 %).
Решение и критерии оценивания
| 1. За час человек делает 900 вдохов и через лёгкие проходит 450 л воздуха. | 1 балл |
| Потребляется не весь вдыхаемый кислород, а только 21 % – 16,5 % = 4,5 % от объёма воздуха, т. е. примерно 20 л. | 2 балла |
| Углекислого газа выделяется столько же, сколько израсходовано кислорода, 20 л. | 2 балла |
| 2. За 45 минут (3/4 часа) 1 человек выделяет 15 л CO2. | 1 балл |
| 20 человек выделяют 300 л CO2. | 1 балл |
| Изначально в воздухе содержалось 0,03% от 100 м3, 30 л CO2, | 1 балл |
| после урока стало 330 л. Содержание CO2: 330 л / (100 000 л) · 100% = 0.33 % | 2 балла |
Это содержание превышает безопасный порог, поэтому класс необходимо проветривать.
Примечание. Расчёт во втором вопросе использует ответ на первый вопрос. Если в первом вопросе получено неправильное число, но потом с ним выполнены верные действия во втором пункте, за этот пункт ставится максимальный балл, несмотря на неверный ответ.
Всего – 10 баллов.
Задача 5. «Соединения урана»
Где больше урана – в 1,2 г хлорида урана(IV) или 1,0 г оксида урана(VI)?
- Запишите формулы этих соединений.
- Ответ обоснуйте и подтвердите расчётом.
- Запишите уравнения реакций получения этих веществ из урана.
Решение
- UCl4, UO3.
- UCl4 ω(U) = 62,6 %, значит в 1,2 г этого вещества содержится 0,75 г урана UO3 ω(U) = 83,2 %, значит в 1,0 г этого вещества содержится 0,83 г урана. Больше урана содержится в 1,0 г оксида урана(VI).
- U+ 2Cl2 = UCl4; 2U + 3O2 = 2UO3
Система оценивания:
| 1. По 1 баллу за формулу | 2 балла |
| 2. По 2 балла за каждый расчёт и по 1 баллу за верный ответ с обоснованием | 6 баллов |
| 3. По 1 баллу за уравнение реакции | 2 балла |
Всего – 10 баллов.
Задача 6. «Пять порошков»
В пяти пронумерованных стаканах выданы порошки следующих веществ: медь, оксид меди(II), древесный уголь, красный фосфор и сера. Цвет веществ, находящихся в стаканах, указан на рисунке 6.1.
Рисунок 6.1
Ученики исследовали свойства выданных порошкообразных веществ, результаты своих наблюдений представили в таблице.
| Номер стакана | «Поведение» порошка при помещении его в стакан с водой | Изменения, наблюдаемые при нагревании исследуемого порошка на воздухе |
| 1 | плавает на поверхности воды | начинает тлеть |
| 2 | тонет в воде | не изменяется |
| 3 | плавает на поверхности воды | плавится, горит голубоватым пламенем, при горении образуется бесцветный газ с резким запахом |
| 4 | тонет в воде | горит ярким белым пламенем, при горении образуется густой дым белого цвета |
| 5 | тонет в воде | постепенно чернеет |
- Определите, в каком стакане находится каждое из веществ, выданных для исследования. Ответ обоснуйте.
- Напишите уравнения реакций, которые протекают с участием выданных веществ при их нагревании на воздухе.
- Известно, что плотность веществ, находящихся в стаканах № 1 и № 3, больше плотности воды, т. е. эти вещества должны тонуть в воде. Однако порошки этих веществ плавают на поверхности воды. Предложите возможное объяснение этому факту.
Решение и критерии оценивания
1) В стакане
№ 1 находится порошок угля. Чёрный цвет, тлеет на воздухе при нагревании.
№ 2 – оксид меди (II); имеет чёрный цвет, при нагревании не изменяется.
№ 3 – сера; жёлтый цвет, характерное горение с образованием сернистого газа.
№ 4 – красный фосфор; тёмно-красный цвет, характерное горение с образованием оксида фосфора(V).
№ 5 – медь; красный цвет; появление чёрной окраски при нагревании за счёт образования оксида меди(II).
По 0,5 балла за каждое верное определение и ещё по 0,5 балла за разумное обоснование. Всего — 5 баллов
2) Уравнения реакций, которые протекают с участием выданных веществ при их нагревании на воздухе:
- C + O2 = CO2
- S + O2 = SO2
- 4P + 5O2 = 2P2O5
- 2Cu + O2 = 2CuO
По 1 баллу за каждое уравнение. Всего – 4 балла
3) В стаканах № 1 и № 3 находятся соответственно порошки древесного угля и серы. Частички древесного угля пронизаны капиллярами, заполненными воздухом, таким образом, их средняя плотность оказывается меньше 1 г/мл.
К тому же поверхность угля, как и поверхность серы, не смачивается водой, т. е. является гидрофобной. Мелкие частички этих веществ удерживаются на поверхности воды силой поверхностного натяжения.
1 балл Всего – 10 баллов
В итоговую оценку из 6-и задач засчитываются 5 решений, за которые участник
набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не
учитывается.
Источник
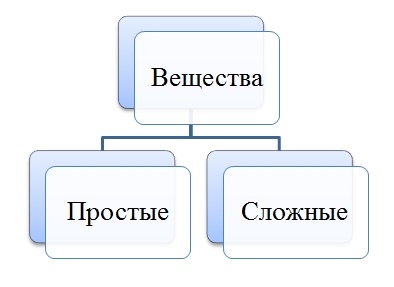
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С – алмаз, графит, карбин, фуллерен.
- O – кислород, озон.
- S – ромбическая, моноклинная, пластическая.
- P – белый, красный, чёрный.
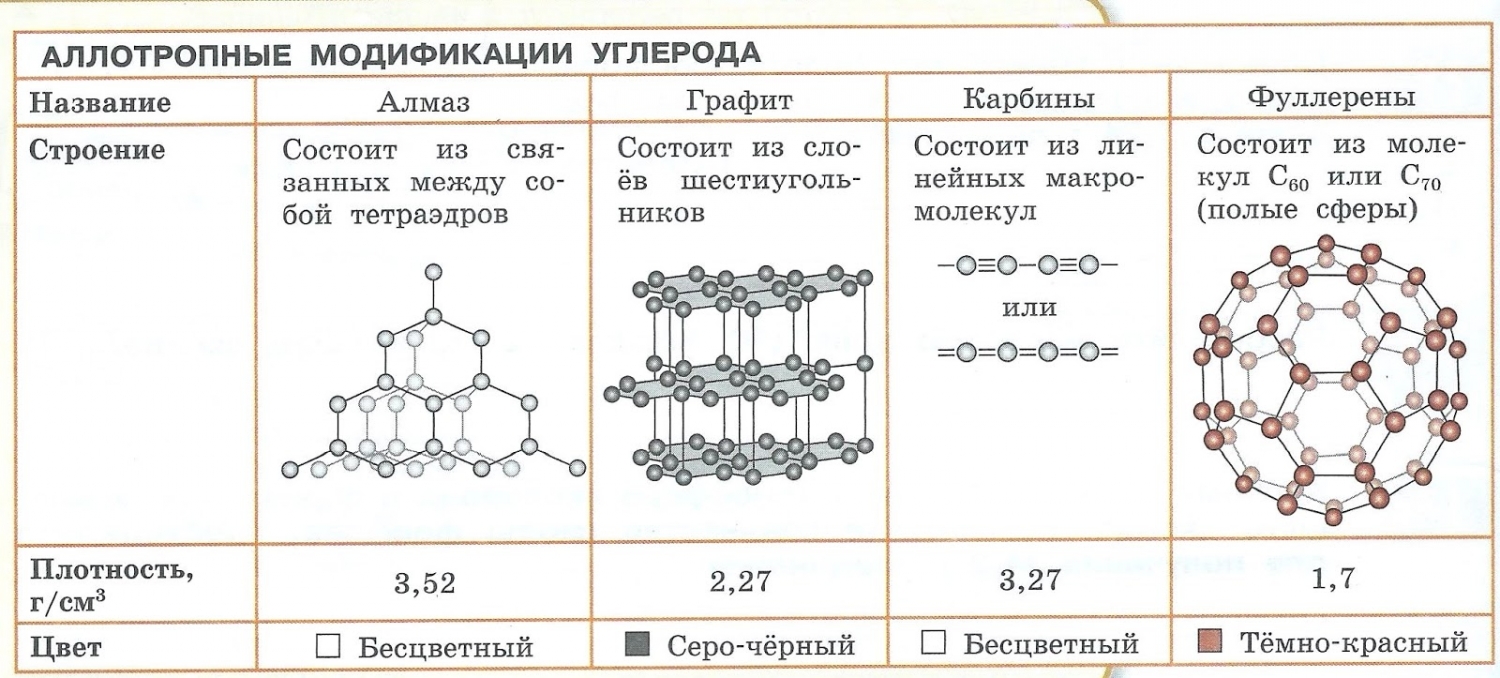
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
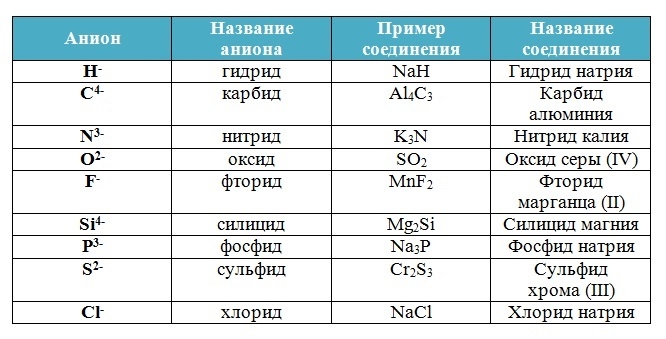
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
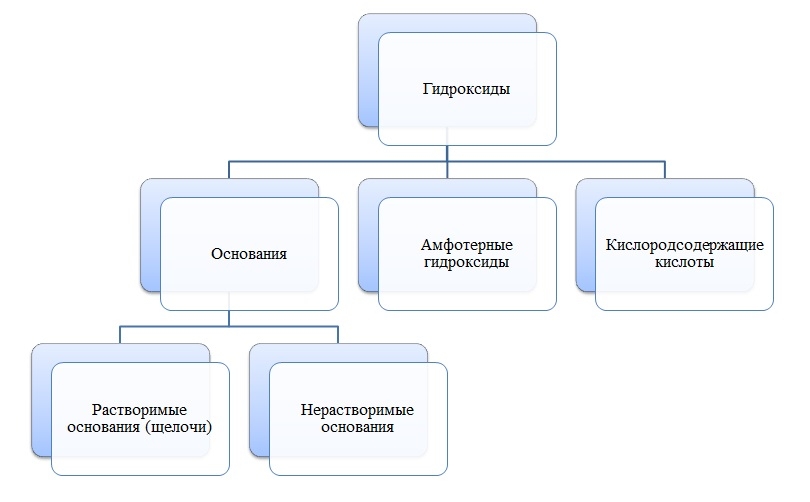
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me – металл
- Ac – кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Источник
