Какие простые и какие сложные вещества содержаться в воздухе
Задача 1. «Чистые вещества и смеси»
- Закончите фразы:
- (а) Состав индивидуального вещества в отличие от состава смеси __________ и может быть выражен химическ__ __________;
- (б) __________ в отличие от __________ кипит при постоянной __________.
- Какая из двух жидкостей – ацетон и молоко – представляет собой индивидуальное вещество, а какая – смесь?
- Вам надо доказать, что выбранное Вами вещество (одно из двух в п. 2) – смесь. Кратко опишите Ваши действия.
Решение
- (а) Состав индивидуального вещества в отличие от состава смеси постоянен и может быть выражен химической формулой; (б) индивидуальное вещество в отличие от смеси веществ кипит при постоянной температуре.
- Ацетон – индивидуальное вещество, молоко – смесь.
- Поместим капли обеих жидкостей в микроскоп. Молоко под микроскопом будет неоднородно. Это – смесь. Ацетон под микроскопом будет однородным.
Другое возможное решение: ацетон кипит при постоянной температуре. Из молока при кипячении испаряется вода, на поверхности молока образуется плёнка – пенка. Принимаются также другие разумные доказательства.
Система оценивания:
| 1) По 2 балла за каждую фразу | 4 балла |
| 2) За правильный ответ | 2 балла |
| 3) За мотивировку | 4 балла |
| Всего – 10 баллов |
Задача 2. «Распространённое вещество»
«Это сложное вещество широко распространено в природе. Встречается по всему земному шару. Не имеет запаха. При атмосферном давлении вещество может находиться только в газообразном и твёрдом состояниях. Многие учёные считают, что это вещество оказывает влияние на повышение температуры нашей планеты. Применяется в различных производствах, в том числе и пищевой промышленности. Используется при тушении пожаров. Однако в химической лаборатории им нельзя тушить горящие металлы, например магний. Напитки, приготовленные с этим веществом, очень любят дети. Но постоянное потребление таких напитков может вызвать раздражение стенок желудка».
- Определите вещество на основе его описания.
- Какие названия этого вещества Вам известны?
- Приведите известные Вам примеры применения и назовите источники образования этого вещества.
Решение и критерии оценивания
- Названо вещество – углекислый газ (оксид углерода (IV)) (4 балла). Возможный ответ – вода – считать неправильным. Вода не раздражает желудок.
- Сухой лёд, углекислота, угольный ангидрид (по 1 баллу за каждый ответ).
- Углекислый газ применяется в производстве газированных напитков, сахарном производстве, при тушении пожаров как хладагент и пр. Образуется при дыхании животных организмов, брожении, гниении органических остатков, в производстве негашёной извести, сжигании органических веществ (торфа, древесины, природного газа, керосина, бензина и т. д.) (По одному баллу за пример, но не более 3-х баллов). Всего – 10 баллов.
Задача 3. «Атомные доли»
Состав химических соединений часто характеризуют с помощью атомных долей. Так, молекула углекислого газа CO2 состоит из одного атома C и двух атомов O, всего в молекуле три атома. Тогда атомная доля C равна 1/3, атомная доля O – 2/3.
Приведите по одному примеру веществ, в которых атомные доли составляющих их элементов равны:
- 1/2 и 1/2;
- 2/5 и 3/5;
- 1/3, 1/3 и 1/3;
- 1/6, 1/6 и 2/3;
- 1.
Решение
- Два элемента, число атомов в молекуле (формульной единице) одинаково: HCl, HgO, CO.
- Два элемента, атомов одного из них в молекуле (формульной единице) – 2, другого – 3: Al2O3, Fe2O3.
- Три элемента, всех атомов поровну: KOH, NaOH.
- Три элемента: атомов двух из них в молекуле (формульной единице) поровну, а третьего элемента в 4 раза больше: KMnO4, CuSO4.
- Любое простое вещество.
По 2 балла за каждый пункт.
Всего – 10 баллов.
Задача 4. «Вдох-выдох»
В процессе дыхания человек потребляет кислород и выдыхает углекислый газ. Содержание этих газов во вдыхаемом и выдыхаемом воздухе приведено в таблице.
| Воздух | O2 (% по объёму) | CO2 (% по объёму) |
| Вдыхаемый | 21 % | 0,03 % |
| Выдыхаемый | 16,5 % | 4,5 % |
Объём вдоха-выдоха – 0,5 л, частота нормального дыхания – 15 вдохов в мин.
- Сколько литров кислорода потребляет человек за час и сколько выделяет углекислого газа?
- В классе объёмом 100 м3 находятся 20 человек. Окна и двери закрыты. Каким будет объёмное содержание CO2 в воздухе после урока длительностью 45 минут? (Совершенно безопасное содержание – до 0,1 %).
Решение и критерии оценивания
| 1. За час человек делает 900 вдохов и через лёгкие проходит 450 л воздуха. | 1 балл |
| Потребляется не весь вдыхаемый кислород, а только 21 % – 16,5 % = 4,5 % от объёма воздуха, т. е. примерно 20 л. | 2 балла |
| Углекислого газа выделяется столько же, сколько израсходовано кислорода, 20 л. | 2 балла |
| 2. За 45 минут (3/4 часа) 1 человек выделяет 15 л CO2. | 1 балл |
| 20 человек выделяют 300 л CO2. | 1 балл |
| Изначально в воздухе содержалось 0,03% от 100 м3, 30 л CO2, | 1 балл |
| после урока стало 330 л. Содержание CO2: 330 л / (100 000 л) · 100% = 0.33 % | 2 балла |
Это содержание превышает безопасный порог, поэтому класс необходимо проветривать.
Примечание. Расчёт во втором вопросе использует ответ на первый вопрос. Если в первом вопросе получено неправильное число, но потом с ним выполнены верные действия во втором пункте, за этот пункт ставится максимальный балл, несмотря на неверный ответ.
Всего – 10 баллов.
Задача 5. «Соединения урана»
Где больше урана – в 1,2 г хлорида урана(IV) или 1,0 г оксида урана(VI)?
- Запишите формулы этих соединений.
- Ответ обоснуйте и подтвердите расчётом.
- Запишите уравнения реакций получения этих веществ из урана.
Решение
- UCl4, UO3.
- UCl4 ω(U) = 62,6 %, значит в 1,2 г этого вещества содержится 0,75 г урана UO3 ω(U) = 83,2 %, значит в 1,0 г этого вещества содержится 0,83 г урана. Больше урана содержится в 1,0 г оксида урана(VI).
- U+ 2Cl2 = UCl4; 2U + 3O2 = 2UO3
Система оценивания:
| 1. По 1 баллу за формулу | 2 балла |
| 2. По 2 балла за каждый расчёт и по 1 баллу за верный ответ с обоснованием | 6 баллов |
| 3. По 1 баллу за уравнение реакции | 2 балла |
Всего – 10 баллов.
Задача 6. «Пять порошков»
В пяти пронумерованных стаканах выданы порошки следующих веществ: медь, оксид меди(II), древесный уголь, красный фосфор и сера. Цвет веществ, находящихся в стаканах, указан на рисунке 6.1.
Рисунок 6.1
Ученики исследовали свойства выданных порошкообразных веществ, результаты своих наблюдений представили в таблице.
| Номер стакана | «Поведение» порошка при помещении его в стакан с водой | Изменения, наблюдаемые при нагревании исследуемого порошка на воздухе |
| 1 | плавает на поверхности воды | начинает тлеть |
| 2 | тонет в воде | не изменяется |
| 3 | плавает на поверхности воды | плавится, горит голубоватым пламенем, при горении образуется бесцветный газ с резким запахом |
| 4 | тонет в воде | горит ярким белым пламенем, при горении образуется густой дым белого цвета |
| 5 | тонет в воде | постепенно чернеет |
- Определите, в каком стакане находится каждое из веществ, выданных для исследования. Ответ обоснуйте.
- Напишите уравнения реакций, которые протекают с участием выданных веществ при их нагревании на воздухе.
- Известно, что плотность веществ, находящихся в стаканах № 1 и № 3, больше плотности воды, т. е. эти вещества должны тонуть в воде. Однако порошки этих веществ плавают на поверхности воды. Предложите возможное объяснение этому факту.
Решение и критерии оценивания
1) В стакане
№ 1 находится порошок угля. Чёрный цвет, тлеет на воздухе при нагревании.
№ 2 – оксид меди (II); имеет чёрный цвет, при нагревании не изменяется.
№ 3 – сера; жёлтый цвет, характерное горение с образованием сернистого газа.
№ 4 – красный фосфор; тёмно-красный цвет, характерное горение с образованием оксида фосфора(V).
№ 5 – медь; красный цвет; появление чёрной окраски при нагревании за счёт образования оксида меди(II).
По 0,5 балла за каждое верное определение и ещё по 0,5 балла за разумное обоснование. Всего — 5 баллов
2) Уравнения реакций, которые протекают с участием выданных веществ при их нагревании на воздухе:
- C + O2 = CO2
- S + O2 = SO2
- 4P + 5O2 = 2P2O5
- 2Cu + O2 = 2CuO
По 1 баллу за каждое уравнение. Всего – 4 балла
3) В стаканах № 1 и № 3 находятся соответственно порошки древесного угля и серы. Частички древесного угля пронизаны капиллярами, заполненными воздухом, таким образом, их средняя плотность оказывается меньше 1 г/мл.
К тому же поверхность угля, как и поверхность серы, не смачивается водой, т. е. является гидрофобной. Мелкие частички этих веществ удерживаются на поверхности воды силой поверхностного натяжения.
1 балл Всего – 10 баллов
В итоговую оценку из 6-и задач засчитываются 5 решений, за которые участник
набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не
учитывается.
Источник
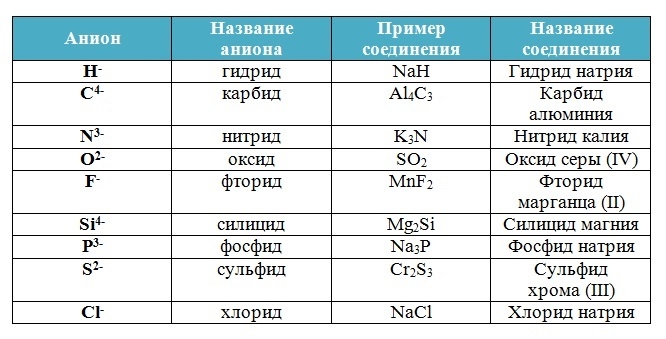
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С – алмаз, графит, карбин, фуллерен.
- O – кислород, озон.
- S – ромбическая, моноклинная, пластическая.
- P – белый, красный, чёрный.
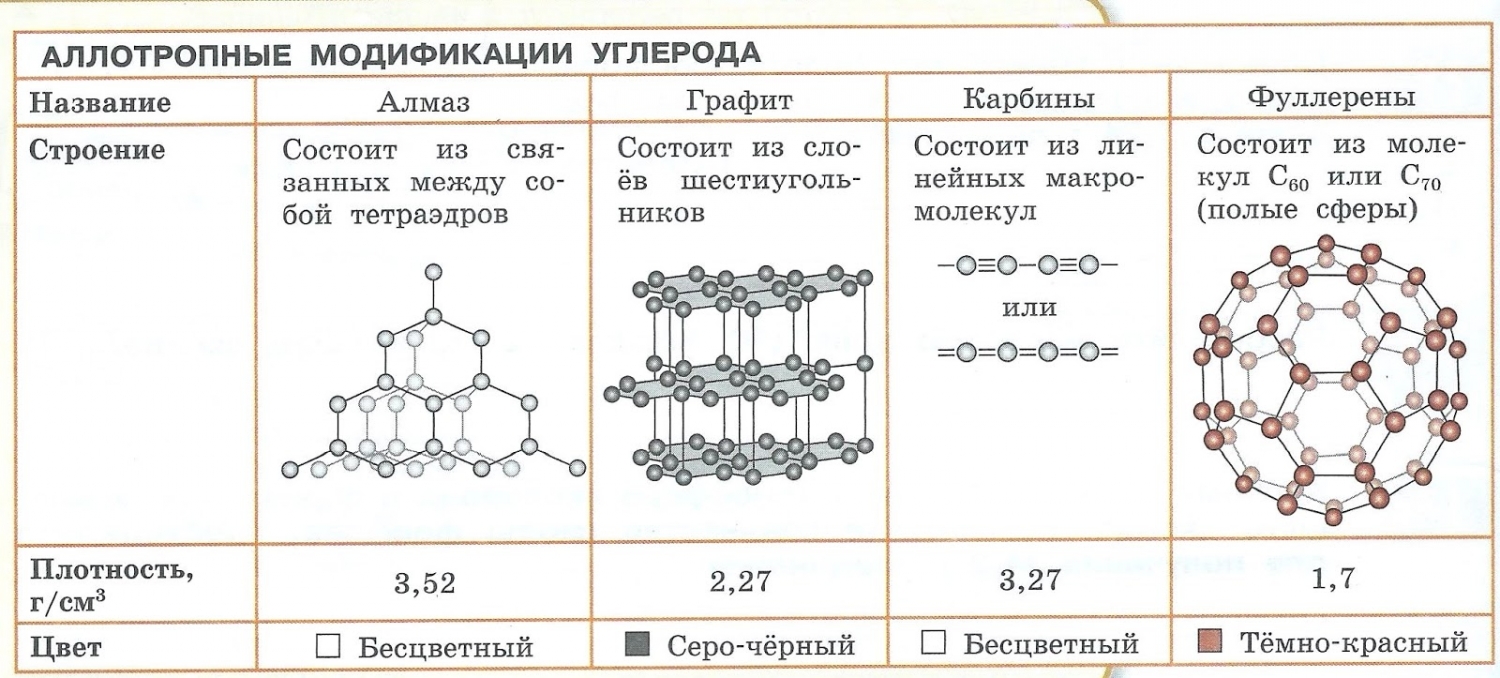
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):

Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
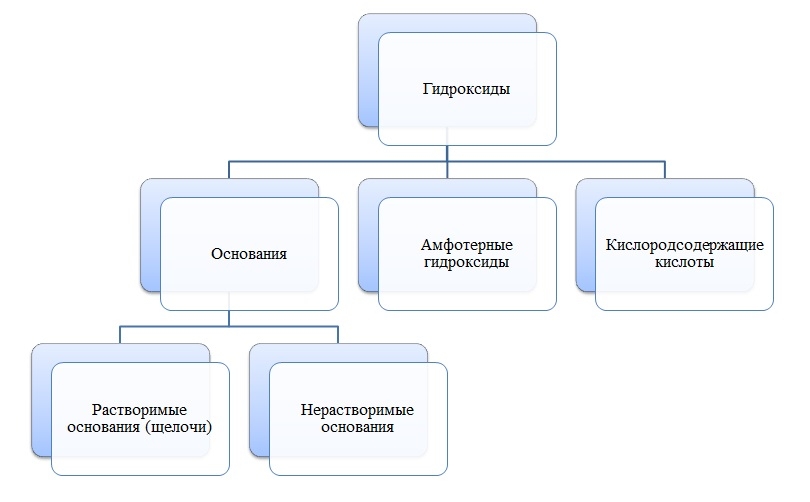
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me – металл
- Ac – кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Источник
Предметом изучения химии являются вещества.
1.1. Внимательно рассмотрите предложенные рисунки. Укажите номер рисунка, на котором изображен объект, содержащий индивидуальное химическое вещество.
Рис. 1 Рис. 2 Рис. 3
Индивидуальное химическое вещество содержится в объекте, изображённом на рисунке:____________________________
1.2. Какие вещества содержатся в объектах, изображённых на остальных рисунках?
Приведите по ОДНОМУ примеру.
Для каждого вещества укажите его химическое название и формулу.
Рис.1:________________________(название) __________________(формула).
Рис.2:________________________(название) __________________(формула).
Рис.3:________________________(название) __________________(формула).
Превращение одних веществ в другие называется химической реакцией.
2.1. Из представленных ниже рисунков выберите тот, на котором изображено протекание химической реакции.
Рис. 1 Рис. 2 Рис. 3
Протекание химической реакции изображено на рисунке:
Объясните сделанный вами выбор: _______________________________________________________________
_________________________________________________________________________________________________________________________________
2.2. Укажите один ЛЮБОЙ признак протекания этой химической реакции:
__________________________________________________________________
В таблице приведены названия и химические формулы некоторых газообразных веществ.
№ | Название вещества | Формула | Молярная масса |
1 | Водород | Н2 | |
2 | Азот | N2 | |
3 | Углекислый газ | CO2 |
3.1. Используя предложенные вам справочные материалы, вычислите молярные массы каждого из газов и запишите полученные данные в таблицу.
3.2. Какой из приведённых в таблице газов тяжелее воздуха? (Средняя молярная масса воздуха равна 29 г/моль.). Укажите номер вещества.
Ответ:___________________
Объясните свой выбор: __________________________________________________________________
_________________________________________________________________________________________________________________________________
Даны два химических элемента А и В. Известно, что в атоме элемента А содержится 19 протонов, а в атоме элемента В – 7 электронов.
4.1. Используя Периодическую систему химических элементов Д.И. Менделеева, определите химические элементы А и В.
4.2. Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен каждый элемент.
4.3. Установите, металлом или неметаллом являются простые вещества, образованные этими химическими элементами.
4.4. Составьте формулы высших оксидов, которые образуют элементы А и В.
Ответы запишите в таблицу:
Элемент | Название химического элемента | НОМЕР | Металл или неметалл | Формула высшего оксида | |
периода | группы | ||||
А | |||||
В | |||||
Восьмиклассница Мария выпила после обеда один стакан (200 мл) апельсинового сока.
5.1. Используя данные приведённой ниже таблицы, определите, какое количество витамина С получил при этом организм девушки. Ответ подтвердите расчётом.
Решение:_________________________________________________________________________________________________________________________
__________________________________________________________________
Ответ: __________________________.
5.2. Какую долю суточной физиологической нормы составляет потреблённое Машей количество витамина А? Ответ подтвердите расчётом.
Решение:__________________________________________________________
________________________________________________________________________________________________________________________________
Ответ: __________________________.
Имеется следующий перечень химических веществ: натрий, йод, кальций, оксид углерода (IV), карбонат кальция, азотная кислота, йодид натрия. Используя этот перечень, выполните задания 6.1 – 6.5.
6.1. Напишите химические формулы каждого из указанных веществ:
Натрий – _________. Йод – ____________ Йодид натрия – ____________
Кальций – ___________ Азотная кислота – __________________________
Карбонат кальция – ___________Оксид углерода(IV) – _______________
6.2. Какое из веществ, упоминаемых в перечне, соответствует следующему описанию:
«Серовато-черные с металлическим блеском пластинки или кристаллы с характерным запахом; летуч, при нагревании возгоняется, образуя фиолетовые пары»?
Ответ: __________________________.
6.3. Из данного перечня выберите ЛЮБОЕ СЛОЖНОЕ вещество. Запишите его химическую формулу и укажите, к какому классу неорганических соединений оно относится:
Вещество –________________. Класс соединений – ________________.
6.4. Из приведённого перечня веществ выберите ЛЮБОЕ соединение, состоящее из атомов ТРЁХ элементов. Вычислите массовую долю кислорода в этом соединении.
Вещество – __________________________.
Решение:_______________________________________________________________________________________________________________________
__________________________________________________________________.
Ответ: __________________________.
6.5. Вычислите массу 0,5 моль углекислого газа.
Решение:__________________________________________________________
__________________________________________________________________
Ответ: __________________________.
Ниже даны словесные описания двух химических превращений с участием веществ, перечень которых был приведён в задании 6:
(1)натрий + йод → йодид натрия;
(2)карбонат кальция + азотная кислота → нитрат кальция + оксид углерода (IV) + вода.
7.1. Составьте уравнения указанных реакций, используя химические формулы веществ из п. 6.1:
(1) __________________________________________________________________
(2) __________________________________________________________________
7.2. В зависимости от числа и состава веществ, вступающих в химическую реакцию и образующихся в результате неё, различают реакции соединения, разложения, замещения и обмена. Выберите ЛЮБУЮ реакцию (1) или (2) и укажите её тип.
Реакция:_____________________________________________________
Тип – _______________________.
Объясните свой ответ: ____________________________________________________________
_______________________________________________________________________________________________________________________________
7.3. Из приборов, изображённых на рисунках, выберите тот, с помощью которого можно получить газообразный углекислый газ по уравнению(2).
Рис. 1 Рис. 2
Углекислый газ можно получить с помощью прибора, изображённого на рисунке: _____________
Каким методом – вытеснения воды или вытеснения воздуха – получают углекислый газ в этом приборе?
Ответ: методом вытеснения __________________________.
Почему прибор, изображённый на другом рисунке, не может быть использован для получения углекислого газа?
Объяснение:_______________________________________________________
__________________________________________________________________
__________________________________________________________________
Установите соответствие между названием химического вещества и областью его применения. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
Запишите в таблицу выбранные цифры под соответствующими буквами.
ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
А) вода Б) хлор В) азотная кислота Г) алюминий | 1) сельское хозяйство 2) производство удобрений 3) производство полимеров 4) самолетостроение 5) в качестве топлива |
Из приведённого списка выберите верные суждения о правилах поведения в химической лаборатории и обращения с химическими веществами. В ответе запишите цифры, под которыми они указаны. (В задании может быть несколько верных суждений.)
1. В лаборатории наличие кислоты в растворе определяют на вкус.
2. При работе с препаратами бытовой химии, содержащими щёлочь, необходимо использовать резиновые перчатки.
3.При попадании раствора кислоты на кожу, её следует промыть водой и обработать раствором питьевой соды.
4.. Легковоспламеняющиеся жидкости, например ацетон, разрешается хранить только в холодильнике.
Ответ: __________________________.
Источник
