Какие продукты содержат галогены

Галогены – это класс родственных элементов, которые включают йод, бром, фтор и хлор. С их соединениями, то есть с йодидом, бромидом, фторидом и хлористыми солями мы сталкиваемся в пищевых продуктах, лекарственных препаратах и окружающей среды.О йоде многие знают с детства, им обрабатывали сбитые коленки в детстве.
Позже мы узнали о том, что этот галоген необходим для синтеза гормонов щитовидной железы. Прочитать об этом можно в статье «Правда и мифы о йоде»
Да, йод необходим организму, его дефицит опасен для организма также как и его избыток.
Но почему, то мало говорят и пишут о токсичности галогенов. Более того, их добавляют в продукты питания, воду, средства по уходу за телом и с их помощью отравляют людей.
О токсическом действии галогенов.
1. Что надо знать о токсическом действии галогенов.
1) Йод и хлориды полезны в небольших количествах, другие являются токсичными.
2) Галогены могут связываться с рецепторами йода, блокировать действие йодида и гормонов щитовидной железы, и вызывать многие тяжелые заболевания.
3) Токсичные галогены очень медленно выделяются из организма, и не известны пути их детоксикации из печени.
4) Выведение токсичных галогенов может быть увеличено следующими способами:
- Высокими дозами йода,
- Высокими дозами витамина С,
- Нерафинированной морской соли (которая заменяет бромид хлоридом),
- Ванны с английской солью,
- Потоотделение в сухой инфракрасной сауне.
2. Токсичность бромида/брома.
1)Бром является ядом и в пище не должен применяться.
2)Бром может связываться с рецепторами йода и блокировать их функцию.
3) Однако, этот галоген заменяет йодид во многих продуктах, лекарственных препаратах и в окружающей среде, несмотря на то, что это пестицид.
4) Он заменил йод при обработке белой муки и уменьшил потребление йода человеком на 726 мкг/день.
5) Симптомы интоксикации брома.
Эти симптомы включают:
- Ощущение скуки,
- Апатию,
- Депрессию,
- Раздражительность, головную боль,
- Гипотиреоз.
6) Признаки тяжелой интоксикации бромом.
Они характеризуются:
- Бредом,
- Шизофренией,
- Галлюцинациями.
7) Некоторые лекарства содержат бром.
- атровент ингалятор,
- назальный спрей атровент.
Есть и другие препараты. Будьте с ними осторожнее, до покупки препарата прочитайте его состав, инструкции есть в Интернете.
«8)» Продукты питания, содержащие бром.
- Все хлебобулочные изделия из белой муки содержат бром, так как мука им обрабатывается.
- некоторые энергетические напитки содержат его.
- некоторые бассейны могут его содержать.
- он содержится в некоторых пестицидах и может попасть в воду.
3. Токсичность фторида/фтора.
Фтор известен как токсин и может привести к летальному исходу.
Но уже более 50 лет его добавляют в питьевую воду, чтобы не было кариеса у людей.
Это было сделано в законодательном порядке без всяких научных исследований.
Позднее было показано, что нет никакой разницы в заболевании зубов с фтором или без него.
Сразу после того, как в Америке стали фторировать водопроводную воду, многие страны также перешли на фторирование воду.
После того, как ученые установили, что фтор не сохраняет зубы от кариеса, многие страны перестали фторировать питьевую воду.
1) Чем вреден фтор?
Сейчас широко известно вредное действие фтора на организм человека:
- он вызывает флюороз (изменение цвета зубов),
- вызывает перелом бедер,
- способствует появлению рака костей,
- снижает интеллект,
- токсичен для почек,
- является причиной зоба у собак.
- фтор является более токсичным, когда в организме есть дефицит йодида.
2) Фтор может содержаться в лекарствах.
Поэтому внимательно изучайте состав препарата до его покупки.
3) Фтор может содержаться в средствах гигиены.
Наиболее часто он содержится в зубной пасте, даже в детской.
Вам может быть полезна статья «Сделайте самую лучшую зубную пасту, рецепты»
4. Токсичность хлорида/ хлора.
1) Хлорид является важным элементом во внеклеточной жидкости, он необходим в виде соляной кислоты в желудке для пищеварения.
2) Но в больших количествах он токсичен и с его побочными продуктами он может вызвать:
- врожденные дефекты,
- рак,
- репродуктивные расстройства,
- мертворождения,
- нарушения иммунной системы.
3) Избыток натрия хлорида (соли) конкурирует с йодидом и может вызвать гипотиреоз.
4) Источники хлорида.
Это могут быть:
- продукты (соль, питьевая вода, сукралоза или спленда, то есть хлорированный сахар).
- газообразный хлор в паре посудомоечной машины, горячей ванне, бассейны.
5. Перхлорат.
Перхлорат – это один атом хлора, окруженный 4 атомами кислорода. Является токсином.
Его наличие в организме может привести к:
1)гипотиреозу,
2) раку щитовидной железы,
3) зобу,
4) мастопатии,
5) нарушению менструального цикла,
6) дисфункции иммунной системы,
7) плохому развитию плода,
«8)» умственной отсталости новорожденных.
Дополнительно о перхлорате вы можете прочитать в статье «Йод, щитовидная железа, перхлорат и здоровье»
Будьте здоровы! И пишите комментарии.
10 голосов
Средняя оценка: 5 из 5
Источник
Здравствуйте, уважаемые читатели. Тема правильного питания сегодня интересна всем, кто хочет оставаться бодрым и здоровым долгие годы. Мы следим за калорийностью рациона, рассчитываем количество углеводов, белков, жиров, витаминов. Однако забываем, что для полноценной жизнедеятельности организму нужны микроэлементы, например фтор. Давайте разберемся, где же искать этот экзотический компонент, и какие фторсодержащие продукты питания предпочтительнее.
Для чего нашему организму нужны ионы F
Поскольку фтор это газообразное вещество группы галогенов, в наш организм он попадает в виде соединений различных металлов (кальция, натрия, олова). Далее он ионизируется и переносится кровью к органам и тканям.

Потребность человека во фторе невелика, всего лишь 0,5-4 миллиграмма за сутки. Учитывая, что литр питьевой воды содержит 3-12 мг фторидов, можно сказать, что специально насыщать рацион продуктами с содержанием фтора нет никакой необходимости, при условии соблюдения основных принципов правильного питания.

Хотя фтор принято относить к группе условно жизненно необходимых микроэлементов, совсем обойтись без него у организма не получится. Сам по себе F необходим на этапе формирования зубной эмали и костей. От его содержания зависит состояние ногтевой пластины и волос, а также скорость регенерации поврежденных тканей.
Читайте также:
В каких продуктах содержится много аминокислот: самые нужные и незаменимые для человека

Ионы фтора катализируют кроветворение, помогают организму избавляться от радионуклидов и тяжелых металлов. Помимо этого, галоген ускоряет процесс усвоения Ca или железа из продуктов питания.
Прекрасная совместимость фтора и кальция позволяет им работать в тандеме, всячески укрепляя кости и зубную эмаль. Поэтому микроэлемент особенно важен для женщин. Как известно, во время вынашивания малыша мама нуждается в регулярном поступлении кальция, необходимого для формирования скелета ребенка.
Читайте также:
Чем полезны и вредны семена подсолнуха для здоровья — какая норма употребления в день

При его нехватке организм позаимствует микроэлемент из костной ткани, что немедленно скажется на состоянии волос и ногтей будущей мамочки. Дамам старшего возраста важно употреблять максимально допустимое количество продуктов, содержащих фториды, чтобы исключить развитие остеопороза.
Еще одно полезное свойство галогена F – его способность снижать агрессивность кислой среды в полости рта и уничтожать бактерии, вызывающие кариес. Кстати, этим успешно пользуются производители зубной пасты.
Как скажется на организме избыток микроэлемента
Последнее время появилось множество статей и публикаций на тему вреда фтора. Дескать, этот химический элемент для человеческого организма небезопасен. Надо сказать, что галоген действительно ядовит, но только в своем естественном, газообразном состоянии.

Более того, из продуктов мы получаем его в микродозах, накопить критическую концентрацию вещества организм не успевает, поскольку F быстро утилизируется через мочевыделительную систему. Но покупать продукцию обогащенную фтором специально действительно не стоит. Мало того, что цены на такой товар выше на 20-30%, риск передозировки при их потреблении заметно увеличивается.
Возможно вас еще заинтересует:
В каких продуктах питания содержится омега-3 больше всего

Теперь немного о том, как можно узнать, что вашему организму многовато фтора. Поскольку ионы галогена следуют, прежде всего, в костную ткань, его избыток проявит себя белыми пятнами на зубной эмали. Но если этот признак легко обнаружить визуально, другие последствия, вроде носовых кровотечений, скачков давления, кожного зуда или головных болей, нередко списывают на другие факторы.

Постоянное превышение необходимой суточной нормы фторидов ведет к снижению иммунитета, усложнению течения хронических недугов, развитию аллергии и даже возникновению опухолей. Нужно учесть, что соединения фтора несовместимы с магнием, его полноценному усвоению они препятствуют.
Где содержится микроэлемент
Различное количество фтора содержат практически все категории продуктов питания. Но нужно признать, что в большом количестве микроэлемент не содержится нигде. Как правило, его присутствие в продуктах ограничивается десятыми и сотыми миллиграмма.

Читайте также:
Чем полезны персики для организма мужчин и женщин и есть ли противопоказания?
Относительно велико его содержание в морской рыбе. Особенно богата фторидами скумбрия, содержащая 35% микроэлемента от суточной нормы потребления.

В каких еще продуктах содержится фтор, можно узнать из таблицы. Расчеты приводятся исходя из максимальной нормы суточного потребления.
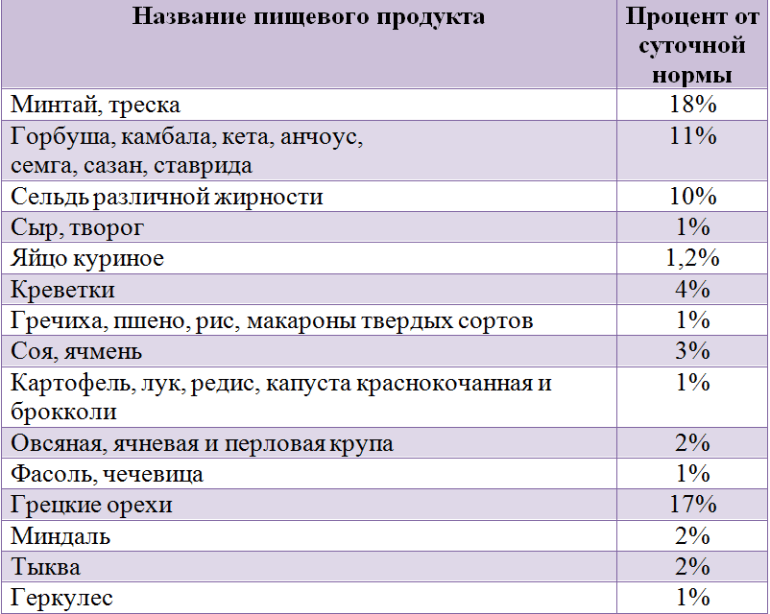
Фториды можно получить не только из рыбы, молочных продуктах или круп. Некоторое их количество имеется в говядине или телятине, печени. Если говорить о морепродуктах, то микроэлемент можно обнаружить в морской капусте (ламинарии). Соединения фтора присутствуют в яблоках, винограде, финиках, шпинате, свекольной ботве, подсолнечных и тыквенных семенах.

Вам наверняка любопытно будет узнать, что помимо перечисленных продуктов, микроэлемент в значительном количестве присутствует в чайном листе. Можно сказать, что растение фаворит по содержанию фтористых соединений. При этом во время заваривания лист отдает воде примерно 50-70% вещества.
Читайте также:
В чем содержится витамин с в большом количестве — таблица со списком продуктов

Именно поэтому считается, что чай полезен для зубов. Особенно это касается зеленых сортов, которые почти не содержат красящий пигмент, а значит не вызовут пожелтения эмали. На пользу пойдут горячие напитки, приготовленные с добавлением мяты. В ее листочках и стеблях тоже присутствует фтор.
Прощаясь с вами, уважаемые читатели, хочу пожелать хорошего здоровья. Напоминаю, что интересная информация появляется регулярно, поэтому непременно подпишитесь на блог, чтобы не пропустить новинки. Поделитесь ссылкой на статью с друзьями по социальным сетям.
Источник
 В природных соединениях галогены содержатся (за редким исключением) в виде отрицательно заряженных ионов, поэтому почти все способы получения свободных галогенов сводятся к окислению их ионов. Это осуществляется или при помощи различных окислителей, или путем воздействия электрического тока.
В природных соединениях галогены содержатся (за редким исключением) в виде отрицательно заряженных ионов, поэтому почти все способы получения свободных галогенов сводятся к окислению их ионов. Это осуществляется или при помощи различных окислителей, или путем воздействия электрического тока.
Получение галогенов
Как известно, процесс электролиза сопровождается переходом электронов с катода на положительно заряженные ионы и с отрицательно заряженных ионов на анод. Следовательно, у катода происходит процесс восстановления, у анода — процесс окисления. Таким образом, окисление или восстановление может быть осуществлено не только путем воздействия одного вещества на другое, но и при помощи электрического тока.
Электрический ток — наиболее мощное средство для окисления и восстановления.
Фтор, вследствие огромного сродства к электрону, может быть выделен из своих соединений исключительно электролитическим путем. Впервые он был получен в 1886 г. путем разложения электрическим током безводного жидкого фтористого водорода HF, к которому было прибавлено около 20% фтористого калия KF. Разложение производилось в приборе, выполненном из меди, на которую фтор не действует (после того, как медь покроется слоем фтористой меди). Электроды были сделаны из платины.
Метод, использованный для выделения элементарного фтора, осуществляется в настоящее время и при промышленном получении этого вещества. Разложению электрическим током подвергают расплав состава KF • 2HF (темп. пл. 70° С). Электролиз ведут в стальных ваннах, пользуясь угольными электродами.
Хлор получают в настоящее время в больших количествах путем электролиза водных растворов хлористых солей натрия или калия. Хлор выделяется у анода, а у катода образуется соответственно едкий натр или едкое кали. О получении хлора электролизом водного раствора хлористого натра .
В лабораториях хлор получают действием различных окислителей на соляную кислоту. Напомним, например, известный из школьного курса лабораторный способ получения хлора действием двуокиси марганца на соляную, кислоту:
![]()
В ионной форме эта реакция выразится уравнением:
![]()
из которого видно, что здесь происходит окисление ионов Сl’ в атомы хлора (образующие затем молекулы Сl2) и восстановление четырехвалентного марганца, входящего в состав МnO2, в двухвалентный (ионы Мn••). При помощи этой реакции хлор был впервые получен Шееле в 1774 г.
Аналогичным путем можно получить хлор из соляной кислоты, действуя на нее вместо МnO2 другими окислителями (например, РbO2, КClO3, КМnO4).
Кислород не взаимодействует при обычных условиях с НСl в сколько-нибудь заметной степени Но если пропускать смесь НСl и О2 через трубку, нагретую до 400° и содержащую кусочки пемзы, на которых распределена в качестве катализатора хлорная медь СuСl2, то происходив окисление хлористого водорода (ионов Сl—) кислородом:
4HCl + O2 ⇄2Cl2 + 2H2O
причем выход хлора достигает 80%. Этой реакцией раньше часто пользовались для получения хлора.
Бром и иод могут быть получены аналогично хлору окислением НВr и HJ различными окислителями. В промышленном масштабе их обычно получают из бромистых или йодистых солей металлов, действуя на растворы последних хлором. Таким образом, получение брома и иода тоже основано на окислении их ионов, только в качестве окислителя применяется хлор. Например:
2Br’ + Cl2 =2Сl’ + Br2 2J’ + Сl2 = 2Сl’ + J2
В СНГ бром добывают из воды Сакского озера (в Крыму), содержащей довольно большое количество бромистых солей, и из «рапы» (насыщенного раствора) залива Кара-Богаз-Гол. Освоено также получение брома из буровых вод.
Главным источником получения иода в СНГ служат воды буровых скважин. Для извлечения из этих вод иода к концу первой пятилетки были выстроены два больших завода в Сураханах и в Нефге-Чале, производительность которых вполне обеспечивает потребность нашей страны в иоде.
Применение галогенов
Галогены, особенно хлор, широко применяются в химической промышленности.
Фтор используется в настоящее время для получения некоторых очень ценных фторпроизводных углеводородов, обладающих уникальными свойствами, как, например, смазочные вещества, выдерживающие высокую температуру, пластмасса, устойчивая по отношению к химическим реагентам (тефлон), жидкости для холодильных машин (фреоны) и др.
Хлор служит для приготовления многочисленных неорганических и органических соединений. Он применяется в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов, хлористой серы и др. Большое количество хлора, как в свободном состоянии, так и в виде белильных солей, используется для отбелки тканей и целлюлозы, идущей на изготовление бумаги. Хлор применяется также для стерилизации питьевой воды и обеззараживания сточных вод. В цветной металлургии его используют для получения некоторых металлов путем хлорирования их руд.
Особенно большое значение приобрели за последнее время различные хлорорганические продукты. Хлорсодержащие органические растворители — дихлорэтан, четыреххлористый углерод и др. — широко применяются для экстракции жиров и обезжиривания металлов. Хлорорганические препараты — ДДТ, гексахлоран и др. — служат эффективным средством борьбы с вредителями сельскохозяйственных культур. На основе хлорорганических продуктов изготовляются различные пластические массы, синтетические волокна, высококачественные каучуки, заменители кожи. С развитием техники область применения хлорорганических продуктов все время расширяется; это ведет к непрерывному увеличению производства хлора.
Широкое использование хлора в различных отраслях народного хозяйства, а также масштабы его производства и потребления позволяют отнести хлор, наряду с серной кислотой, аммиаком и содой, к числу важнейших продуктов, выпускаемых химической промышленностью.
Бром необходим для выработки различных лекарственных веществ, некоторых красителей, а также бромистого серебра, потребляемого в больших количествах фотографической промышленностью.
Иод широко применяется в медицине в виде так называемой йодной тинктуры (10%-ный раствор иода в спирте), превосходного антисептического и кровеостанавливающего средства. Кроме того, иод входит в состав ряда фармацевтических препаратов.
109 110 111
Вы читаете, статья на тему Получение и применение галогенов
Источник
Элементы, которые относятся к 17-й группе периодической системы, применяются во многих отраслях народного хозяйства, а вещества, содержащие их соединения, широко используются в быту. Вряд ли можно представить жизнь без этих химических элементов. Хотя все они являются токсичными, без микроскопических количеств галогенов в воде и продуктах невозможно нормальное существование организмов. Рассмотрим, что такое галогены, и каково их значение в химии и биологии.
Что такое галогены
 Пожалуй, многих не раз интересовал вопрос, что такое галогены в химии. Это элементы, относящиеся к XVII группе таблицы Менделеева. Раньше их причисляли к главной подгруппе VII группы. К галогенам относят фтор, хлор, бром, йод, астат.
Пожалуй, многих не раз интересовал вопрос, что такое галогены в химии. Это элементы, относящиеся к XVII группе таблицы Менделеева. Раньше их причисляли к главной подгруппе VII группы. К галогенам относят фтор, хлор, бром, йод, астат.
Некоторые химики причисляют к ним искусственно синтезированное вещество теннесин с номером 117. Это пример галогена, который обладает радиоактивностью.
Вещества этой группы причисляют к неметаллам. Они считаются сильнейшими окислителями, причем это химическое свойство галогенов изменяется по мере уменьшения порядкового номера. Наиболее активным окислителем является фтор, который способен взаимодействовать даже с кислородом с образованием фторида. Способны проявлять свойства восстановителя со степенью окисления +7 (высшая). Недаром раньше таблица Менделеева помещала галогены в 7 группу.
В процессе химического взаимодействия с металлами образуют соли (отсюда и название). На внешней оболочке содержится 7 электронов. Атомы присоединяют недостающий электрон и таким образом заполняют ее. Следовательно, степень их окисления равна -1. Однако хлор, бром, йод, астат могут иметь степени окисления 1, 3, 5, 7 со знаком плюс (являясь восстановителем).
В этом кроется ответ на вопрос, с чем взаимодействует галоген. Особенности строения этих веществ таковы, что они реагируют практически со всеми элементами.
Интересно! Название «фтор» происходит от греческого «разрушение». Это сильнейший окислитель, который взаимодействует почти с любыми веществами. Атомы фтора не реагируют с неоном, гелием и аргоном и некоторыми фторидами.
Характеристика веществ
Узнаем, что такое галогены в химии. Характеристика списка галогенов следующая:
- строение внешнего слоя электронов — nS2nP5,
- по мере роста номера в таблице радиус атома становится больше, электроотрицательность падает, свойства неметалла снижаются,
- являются выраженными окислителями, причем эта способность элементов снижается по мере увеличения массы атома (единственное, с чем не реагирует галоген, — это благородные газы),
- все молекулы содержат 2 атома,
- сила кислот увеличивается по мере роста относительной массы атома.
Периодическая таблица показывает, что чем выше находится элемент, тем сильнее его окислительные способности.
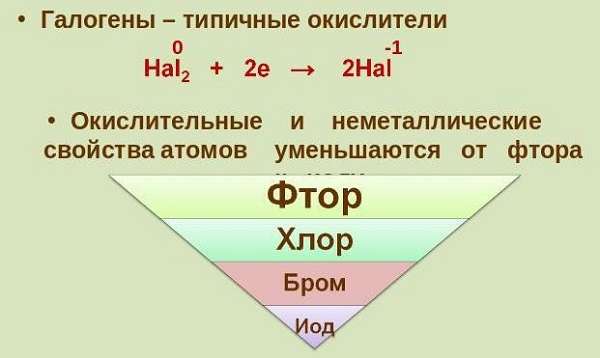 Окислительные свойства атомов
Окислительные свойства атомов
Фтор
При нормальных условиях является бледно-желтым газом. Можно получить путем электролиза КНF2. Реагирует с водой с образованием фтороводорода и кислорода. Реакция водорода и фтора происходит очень активно. Взаимодействует с металлами и неметаллами.
Хлористоводородная кислота является слабой, фтороводород обратимо диссоциирует в воде с выходом ионов Н+ и F-.
Фтороводородная кислота способна растворить стекло:
SiO2 + 4НF → SiF4 + 2Н2О.
Хлор
Является газом зеленоватого цвета с удушающим запахом. Примеры реакций, с помощью которых можно его получить:
- МnO2 + 4НCl → МnСl2 + Сl2+ 2Н2O,
- 2КМnO4 + 16НCl → 2МnСl2 + 5Сl2 + 2КСl + 8Н2O.
Узнаем, каковы химические свойства хлора:
- Взаимодействие с металлами: 2К + Сl2 → 2КСl.
- Реакция с неметаллами: 2Р + 3Сl2 → 2РСlЗ.
- Реакции с щелочами: Сl2 + Сa(ОH)2 → CaОCl2 + H2O.
- Вытеснение йода: Cl2 + 2→ 2 + I2.
Список распространенных кислот:
- хлорноватистая кислота HClO (степень окисления хлора +1),
- хлористая кислота HClO2 (степень окисления +3),
- хлорноватая кислота HClO3 (степень окисления +5),
- хлорная кислота HClO4 (степень окисления +7).
Это интересно! Для чего делают и что это такое гидролиз солей
Бром
Бром представляет собой тяжелую темную жидкость с плохим запахом. Многих интересует, с чем он реагирует. Этот элемент вступает в реакцию с:
- металлами: 2Nа + Вr2 → 2NаВr,
- неметаллами: Н2 + Вr2 → 2НВr,
- водой: Н2 + H2O → НВr + НВrO,
- восстановителями: Вr2 + Н2S → S + 2НВr.
Бромистый водород хорошо реагирует с солями, основаниями, окисями металлов.
 Галогены
Галогены
Йод
Йод — кристаллическое вещество темного фиолетового оттенка. Растворяется в спирте, четыреххлористом углероде. Молекулы взаимодействуют с:
- металлами: К + I → KI,
- водородом: H2 + I2 → 2HI,
- основаниями: 3I2 + 6КOH → 5КI + КIO3 + 3H2O.
Йодистоводородная кислота является сильнейшим восстановителем. При реакции солей с ляписом образуется нерастворимое йодистое серебро. Йодная кислота является очень сильным окислителем (степень окисления йода +7).
Что касается астата, его можно получить только искусственным путем. Восстанавливается с помощью диоксида серы, осаждается сероводородом. Реагирует с йодом и бромом. Растворяется слабой соляной и азотной кислотой.
Физические и химические свойства элемента теннесин изучены мало ввиду малой продолжительности существования его изотопов. Предполагается, что тяжелые радиоактивные элементы могут обладать восстановительной активностью.
Полезное видео: урок химии галогены
Биологическая роль
Биологическое значение галогенов велико: без них не могут происходить важнейшие жизненные процессы.
Фтор встречается в составе костной и зубной ткани. Значительная часть его находится в эмали зубов, отчего она является крепкой. Поступает в организм с жидкостью. Дефицит этого элемента способствует развитию кариеса, а избыток — флюороз.
Встречается в курином желтке, овсе, молоке, перьях, шерсти, костях. Максимум фтора накапливается в листьях. Повышение количества фтора в воздухе способно вызвать тяжелое отравление.
Без такого элемента как хлор невозможна деятельность организмов. Поступает в виде хлористого натрия (кухонной соли). Наличие его в плазме крови способствует сохранению электролитного равновесия. Без хлора невозможно образование хлористоводородной кислоты сока желудка. Практически все продукты содержат это вещество. В жизни применяются многие химические вещества, содержащие хлор. Газ обладает удушающим действием, в больших концентрациях смертельно опасен для живых организмов.
Это интересно! Основные факторы влияющие на скорость химической реакции
Бром оказывает влияние на процессы возбудимости нервной системы. В сравнительно значительном количестве находится в морской воде. Каждый год из воды морей в воздух поступает до 4 миллионов тонн брома. В больших количествах элемент проявляет раздражающее действие.
Без йода невозможна выработка гормонов щитовидки. Играет важнейшую роль в организме, влияя на процессы слаженной деятельности нервной системы. Под контролем этого вещества находятся:
- работа мышц,
- сердцебиение,
- аппетит,
- процессы пищеварения,
- работа мозга.
Проникает в организм с многими продуктами, особенно дарами моря. Особенно много этого микроэлемента в морской капусте. Значительное количество элемента поступает в организм с морским воздухом.
Биологическая роль астата изучена недостаточно.
Токсичность
Фтор, йод, бром, хлор в чистом виде и высокой концентрации ядовиты. Контакт газа с кожей в течение 2 секунд приводит к сильному ожогу. Даже в малых концентрациях фтор раздражает слизистые оболочки.
При попадании хлора в легкие происходит ожог, в результате чего у человека развивается удушье. Причем концентрация элемента в воздухе, при которой начинается поражение легочной ткани, лишь немногим больше порога ощущения неприятного хлорного запаха.
Обратите внимание! Фосген — соединение углерода, кислорода и хлора обладает чрезвычайно сильным удушающим действием, вызывающим необратимый отек легких и неизбежный летальный исход. Противоядия против фосгена не существует.
Пары брома очень ядовиты. Смертельная доза при пероральном приеме составляет 14 мг на килограмм веса. При попадании на кожу вещество вызывает очень болезненные ожоги.
Вдыхание паров йода приводит к сильному удушью. При попадании его внутрь развиваются сильные ожоги пищевода и желудка.
Попадание в организм астата вызывает удушье и сильное радиоактивное облучение.
Использование
Значение любого галогена в жизни человека огромно.
Без фтора невозможно представить себе зубную пасту. Практически все ее виды содержат соединения этого элемента. Основной потребитель фтора — ядерная промышленность. Не меньше фтора потребляет и электротехника. В жизни все чаще применяются фторсодержащие пластмассы — тефлоны.
Хлор используют для отбеливания бумаги, ткани. Без него невозможен синтез пластмасс, каучука, почти всех видов красителей, клеев и растворителей. Большинство хлорсодержащих соединений ядовиты, поэтому их применяют для борьбы с сельскохозяйственными вредителями. До недавнего времени хлор использовали для хлорирования воды. К сожалению, история знает случаи применения хлора в качестве отравляющих веществ.
Это интересно! Уроки химии: катионы и анионы – что это такое
Без брома сложно представить развитие фотографии. Фотобумага содержит слой бромида серебра, которое под воздействием света разлагается. В ходе этой реакции серебро выпадает в осадок.
Йод широко применяется в медицине в качестве обеззараживающего средства в виде настойки на спирту. Входит в состав большого количества лекарственных препаратов. Используется и при получении фотоматериалов высокой светочувствительности.
Изотоп астата применяется в медицине для проведения специальных исследований для определения рака. Существуют способы применения галогенов в медицине для лечения рака.
Полезное видео: биологическое значение и применение галогенов
Вывод
Знание, какие элементы относят к галогенам, очень важно. Они находят применение практически во всех сферах человеческой деятельности. Без них невозможно функционирование любого живого организма. В то же время обладают чрезвычайно высокой химической активностью, могут вызвать тяжелые отравления даже при небольших концентрациях, так что работать с такими веществами нужно очень осторожно.
Источник
