Какие продукты реакций образуются если смесь равных количеств йодметана
Сохраните:
Ответы и задания для 6,7,8,9,10,11 класса 43-го турнира Ломоносова по химии 2020-2021 учебный год, официальная дата проведения турнира в онлайне: 04.10.2020 (4 октября 2020 год).
P.S свои ответы пишите в комментариях ниже, тем самым поможете другим ребятам, а они вам.
Ссылка для скачивания заданий для 6-11 класса: скачать задания
43 турнир М.В. Ломоносова по химии задания и ответы 6-11 класс 2020:
1)Рассчитайте молекулярную массу вещества, имеющего формулу Ca(HCO3)2. Атомные массы считайте целыми числами.
Ответ: 162
2)Рассчитайте, сколько протонов содержится в ядрах всех атомов, входящих в состав молекулы серной кислоты (H2SO4).
Ответ: 50
3)Школьник нашел моток проволоки из белого металла. Он предположил, что это оловянная проволока, тем более ему как раз требовалось олово для пайки. Но как убедиться в этом? К счастью недавно он как раз изучал в школе закон Архимеда, поэтому сразу сообразил, что нужно делать. Он взвесил проволоку и получил величину 841,3 г. Затем он полностью погрузил проволоку в воду и снова взвесил ее, на этот раз весы показали 726,3 г. Школьник произвел необходимые расчеты и убедился, что проволока действительно изготовлена из олова.
Определите по этим данным плотность олова. Приведите свой расчет.
Ответ: 7,3 г/см
Если бы проволока такой же массы (841,3 г) была изготовлена из алюминия, плотность которого 2,7 г см3, то сколько бы она весила в воде?
Ответ: 530,3
4)Водород взаимодействует с парами йода образуя газообразный иодоводород HI. В реакцию в замкнутом сосуде ввели некоторые количества H2 и I2. Через некоторое время состав смеси (в % по молям) стал таким: 30% HI, 10% H2 и 60% I2.
Определите мольное соотношение водорода и йода в первоначальной смеси.
Для реакции взяли такую же смесь водорода и паров йода, как в вопросе 1. Через некоторое время в смеси обнаружено 0,4 моль HI. Определите количества (в моль) водорода и йода, которые в этот момент остаются в сосуде, если известно, что количество водорода уменьшилось в ходе реакции на 50%.
5)Вещества А, Б, В и Г вступают в следующие реакции (многоточие означает, что в реакции образуются и другие продукты): А+K2CO3 + H2O = 2Б Б+HCl =А+….. А+2Mg =В+….. В+O2 =А А+В= 2Г. Определите вещества А, Б, В и Г, если известно, что они все содержат один и тот же элемент, причем его содержание в веществе А составляет 27,27%.
Ответ: A – CO2, Б – KHCO3, В – C, Г – CO
6)В лаборатории имеется пять колб с водными растворами различных веществ. Они подписаны: №1 хлорид аммония, №2 — соляная кислота, №3 — гидроксид калия, №4 — хлорид алюминия, №5 — карбонат натрия. Однако все этикетки перепутаны таким образом, что ни один из растворов не подписан правильно.
При сливании раствора №1 с раствором №4 выделяется газ, который окрашивает влажную индикаторную бумажку в синий цвет. При сливании растворов №2 и №3 выпадает осадок. А при сливании раствора №2 с раствором №5 никаких изменений не происходит.
- Укажите правильные надписи для колб №№ 1–5. Приведите необходимые рассуждения.
- Напишите уравнения реакций, упомянутых в условии.
- Какие еще реакции можно провести между указанными веществами? Напишите их уравнения.
Ответ: №1 карбонат натрия, №2 гидроксид калия, №3 хлорид аллюминия, №4 хлорид аммония, №5 соляная кислота. 2_NH4Cl + Na2CO3 = H2O + CO2 + 2_NaCl + 2_NH3 AlCl3+ 3_KOH = Al(OH)3 + 3_KCl KOH+ HCl= H2O+ KCl
7)Смесь, состоящую из металла А и не которого оксида Б, прокалили и получили смесь продуктов В и Г. При растворении смеси В и Г в избытке соляной кислоты была получена соль Д и выделился горючий газ Е с плотностью по водороду 16. К раствору, содержащему соль Д массой 4,75 г, добавили избыток раствора гидроксида натрия, выпавший при этом осадок отделили, высушили и прокалили, при этом было получено 2,0 г продукта Ж.
- Определите вещества А–Ж.
- Приведите необходимые расчеты
Ответ: А – магний Б – оксид кремния (IV) В – силицид магния Г – оксид магния Д – хлорид магния Е – силан Ж – оксид магния.
Mg+SiO2=Mg2Si+MgOMgO+2HCl=MgCl2+H2OMg2Si+4HCl=SiH4+2MgCl2MgCl2+2NaOH=Mg(OH)2+2NaClMg(OH)2=MgO+H2O
8)Смесь пропана и пропена пропустили в темноте через сосуд, содержащий раствор брома в четыреххлористом углероде. После пропускания газовой смеси масса сосуда увеличилась на 1,26 г. Газ, который не поглотился раствором брома, собрали и сожгли в кислороде. Продукты сгорания последовательно пропустили через трубки, содержащие избыток безводного оксида фосфора(V) и избыток сухого гидроксида калия. Масса первой трубки увеличилась на 2,52 г, а масса второй — на 5,28 г.
- Определите количество пропана в исходной смеси (в моль).
- Определите количество пропена в исходной смеси (в моль).
- Приведите необходимые расчеты.
9)Органическое вещество Х имеет следующий элементный состав: 61,31% C; 5,11% H; 23,36% O; и 10,22% N и молекулярную массу менее 180. Вещество Х можно получить из бензола в четыре стадии. Ниже приведены реагенты и условия, которые требуются на каждой стадии, но в произвольном порядке, не соответствующем реальной последовательности реакций.
- HNO3, H2SO4
- Zn, HCl
- C2H4, H3PO4
- KMnO4, H2SO4 (водный раствор)
В реакции, приведенной под номером 1, образуется два изомерных продукта, в реальных синтезах требуется их разделение. В качестве решения вы можете выбрать любой из изомеров.
- Определите вещество Х
- Расставьте стадии его получения в правильном порядке
- Определите промежуточные вещества, которые получаются на каждой стадии (запишите их названия).
04.10.2020 XLIII Турнир Ломоносова задания и ответы по всем предметам:
04.10.2020 XLIII Турнир Ломоносова задания и ответы
Источник
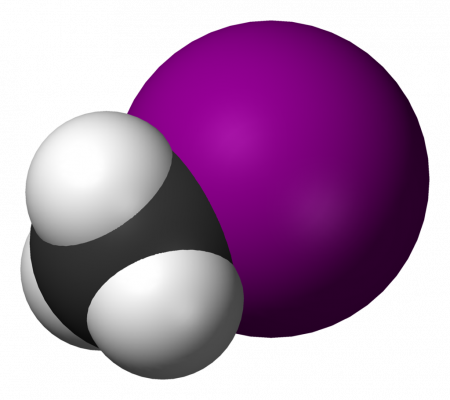
| Йодметан | |||
|---|---|---|---|
| |||
| Систематическое наименование | Йодметан | ||
| Традиционные названия | метилйодид | ||
| Хим. формула | CH3I | ||
| Рац. формула | CH3I | ||
| Состояние | жидкость | ||
| Молярная масса | 141,94 г/моль | ||
| Плотность | 2,2789 г/см³ | ||
| Энергия ионизации | 9,54 ± 0,01 эВ | ||
| Температура | |||
| • плавления | -66,45 °C | ||
| • кипения | 42,43 °C | ||
| • вспышки | -28 °C | ||
| Давление пара | 50 атм | ||
| Растворимость | |||
| • в воде | 1,4 г/100 мл | ||
| Показатель преломления | 1,5304 | ||
| Дипольный момент | 1,59 Д | ||
| Рег. номер CAS | 74-88-4 | ||
| PubChem | 6328 | ||
| Рег. номер EINECS | 200-819-5 | ||
| SMILES | CI | ||
| InChI | 1S/CH3I/c1-2/h1H3 INQOMBQAUSQDDS-UHFFFAOYSA-N | ||
| RTECS | PA9450000 | ||
| ChEBI | 39282 | ||
| Номер ООН | 2644 | ||
| ChemSpider | 6088 | ||
| Токсичность | токсичен, канцероген | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Йодметан (Йодистый метил, метилйодид, MeI) — органическое соединение с формулой CH3I, продукт замещения йодом одного из атомов водорода в молекуле метана. Тяжёлая летучая жидкость. Часто используется в органическом синтезе для метилирования. В природе выделяется в небольшом количестве рисом.
Свойства
Тяжёлая подвижная жидкость, желтеющая при стоянии, особенно на свету из-за выделения I2. Для предотвращения этого иодметан хранят в тёмной посуде над медной проволокой, поглощающей йод.
Получение
Получают по экзотермической реакции между метанолом и трийодидом фосфора, который получается in situ из красного фосфора:
3 CH3OH + PI3 → 3 CH3I + H3PO3илиCH3OH + H3PO4 + KI → CH3I + KH2PO4 + H2O (3-4 ч. t под ОХ рефлюкс, перемешивание)
Также получают реакцией йодида калия с диметилсульфатом в присутствии карбоната кальция:
(CH3)2SO4 + KI → K2SO4 + 2 CH3I
Для очистки CH3I может быть обработан Na2S2O3 для удаления йода. Очистку также можно осуществить обработкой раствором соды с последующей сушкой над плавленным хлористым кальцием и перегонкой.
Также его можно получить реакцией йодида калия с метилтозилатом:
KI + CH3OSO2C6H4CH3 → CH3I + KOSO2C6H4CH3
Применение
Йодметан является отличным реагентом для реакций замещения SN2. Он стерически открыт для атак нуклеофилам, к тому же йод является хорошей уходящей группой. 
В представленных реакциях основные карбонаты K2CO3 или Li2CO3 удаляют кислые протоны, в результате чего образуются карбоксильный и фенольный карбанион, который выступает в роли нуклеофила в SN2 реакции. Йодиды являются более «мягкими» реагентами в нуклеофильных реакциях в силу более слабой связи с внешними электронами и более лёгкой поляризуемости йодида. В силу этого он предпочитает более «мягкие» нуклеофилы. Так, при алкилировании тиоционата происходит алкилирование по сере, а не по азоту с образованием CH3SCN, а не CH3NCS. Это также наблюдается при алкилировании 1,3-дикарбонильных соединений, метилирование енолятов этих соединений практически полностью идёт по углеродному атому, хотя заряд сосредоточен больше на атомах кислорода.
Йодметан легко образует метилмагнийиодид. Он широко распространён на практике из-за лёгкости получения и часто используется в учебных лабораториях. В процессе Monsanto йодметан образуется in situ из метанола и йодоводорода. CH3I затем реагирует с окисью углерода в присутствии родиевых комплексов с образованием ацетилиодида, прекурсора уксусной кислоты после гидролиза. Большое количество уксусной кислоты получается таким способом.
Безопасность
Ярко выраженный канцероген. ЛД50 при ингаляции для крыс 76 мг/кг. В печени метилйодид быстро превращается в S-метилглутатион. Вдыхание большого количества паров йодметана вызывает поражение лёгких, печени, почек и центральной нервной системы, что приводит к тошноте, головокружению, кашлю и рвоте. Длительный контакт с кожей вызывает ожоги. Большие дозы при ингаляции вызывают отёк лёгких.
Пределы взрываемости воздушных смесей 8.5—66 %.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2017;
проверки требуют 9 правок.
| Иодметан | |
|---|---|
| Систематическое наименование | иодметан |
| Традиционные названия | метилйодид; йодметан, метилиод, монойодметан |
| Хим. формула | CH3I |
| Рац. формула | CH3I |
| Состояние | жидкость |
| Молярная масса | 141,94 г/моль |
| Плотность | 2,2789 г/см³ |
| Энергия ионизации | 9,54 ± 0,01 эВ[1] |
| Температура | |
| • плавления | -66,45 °C |
| • кипения | 42,43 °C |
| • вспышки | -28 °C |
| Давление пара | 50 атм |
| Растворимость | |
| • в воде | 1,4 г/100 мл |
| Показатель преломления | 1,5304 |
| Дипольный момент | 1,59 Д |
| Рег. номер CAS | 74-88-4 |
| PubChem | 6328 |
| Рег. номер EINECS | 200-819-5 |
| SMILES | CI |
| InChI | InChI=1S/CH3I/c1-2/h1H3 INQOMBQAUSQDDS-UHFFFAOYSA-N |
| RTECS | PA9450000 |
| ChEBI | 39282 |
| Номер ООН | 2644 |
| ChemSpider | 6088 |
| Предельная концентрация | 1 мг/м³ |
| ЛД50 | 76 мг/кг |
| Токсичность | токсичен, канцероген |
| NFPA 704 | 1 3 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Иодмета́н (ио́дистый мети́л, метилиоди́д, монойодметáн, MeI) — органическое соединение с формулой CH3I, продукт замещения иодом одного из атомов водорода в молекуле метана. Представляет собой тяжёлую летучую жидкость. В высоких концентрациях – ядовит. Часто используется в органическом синтезе для метилирования. В природе выделяется в небольшом количестве рисом.
Свойства[править | править код]
Тяжёлая подвижная жидкость, желтеющая при стоянии, особенно на свету из-за выделения I2. Для предотвращения этого иодметан хранят в тёмной посуде над медной проволокой, поглощающей иод.
Получение[править | править код]
Получают по экзотермической реакции между метанолом и трииодидом фосфора, который получается in situ из красного фосфора:
3 CH3OH + PI3 → 3 CH3I + H3PO3
или
CH3OH + H3PO4 + KI → CH3I + KH2PO4 + H2O (3-4 ч. t под ОХ рефлюкс, перемешивание)
Также получают реакцией иодида калия с диметилсульфатом в присутствии карбоната кальция[2]:
(CH3)2SO4 + KI → K2SO4 + 2 CH3I
Для очистки CH3I может быть обработан Na2S2O3 для удаления иода.
Очистку также можно осуществить обработкой раствором соды с последующей сушкой над плавленным хлористым кальцием и перегонкой[3].
Также его можно получить реакцией иодида калия с метилтозилатом:
KI + CH3OSO2C6H4CH3 → CH3I + KOSO2C6H4CH3
Применение[править | править код]
Иодметан является отличным реагентом для реакций замещения SN2. Он стерически открыт для атак нуклеофилам, к тому же иод является хорошей уходящей группой.
В представленных реакциях основные карбонаты K2CO3 или Li2CO3 удаляют кислые протоны, в результате чего образуются карбоксильный и фенольный карбанион, который выступает в роли нуклеофила в SN2 реакции.
Иодиды являются более «мягкими» реагентами в нуклеофильных реакциях в силу более слабой связи с внешними электронами и более лёгкой поляризуемости иодида. В силу этого он предпочитает более «мягкие» нуклеофилы. Так, при алкилировании тиоционата происходит алкилирование по сере, но никак не по азоту с образованием CH3SCN, но никак не CH3NCS. Это также наблюдается при алкилировании 1,3-дикарбонильных соединений, метилирование енолятов этих соединений практически полностью идёт по углеродному атому, хотя заряд сосредоточен больше на атомах кислорода.
Иодметан легко образует метилмагнийиодид. Он широко распространён на практике из-за лёгкости получения и часто используется в учебных лабораториях.
В процессе Monsanto[4] иодметан образуется in situ из метанола и иодоводорода. CH3I затем реагирует с окисью углерода в присутствии родиевых комплексов с образованием ацетилиодида, прекурсора уксусной кислоты после гидролиза. Большое количество уксусной кислоты получается таким способом.
Токсикология и безопасность[править | править код]
Ярко выраженный канцероген. ЛД50 при ингаляции для крыс составляет 76 мг/кг. В печени метилиодид быстро превращается в S-метилглутатион.
Вдыхание большого количества паров иодметана вызывает поражение лёгких, печени, почек и центральной нервной системы, что приводит к тошноте, головокружению, кашлю и рвоте. Длительный контакт с кожей вызывает химические ожоги. Большие дозы при ингаляции вызывают отёк лёгких.
Пределы взрываемости воздушных смесей 8.5—66 %.
Предельно допустимая концентрация иодистого метила в воздухе рабочей зоны по ГОСТ 12.1.005-76 составляет 1 мг/м3.
В соответствии с ГОСТ 12.1.007-76 иодметан относится ко II классу опасности.
Примечания[править | править код]
См. также[править | править код]
- Метилирование
Источник
Утром меня разбудил телефонный звонок. Звонила моя ученица Лена Д. Со слезами в голосе она начала говорить, что ЕГЭ по химии точно завалит, потому как даже “такая простая и понятная 35 задача” может включать фишку на выход реакции, не считая кучи других “садистских приколов”. Лена скинула мне ВК условие злополучной 35-й задачи: “При гидратации 31,50 г этиленового углеводорода образовалось 23,76 г органического вещества. Выход продукта составил 60 %. Определите молекулярную формулу углеводорода и установите его структуру, если известно, что при его жёстком окислении перманганатом калия образуются кетон и кислота. Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ”
В своей практике я, действительно, столкнулась с парадоксом, когда очень толковые ребята, хорошо знающие химию, жутко боятся элементарных расчетов на степень превращения вещества и выход продукта реакции. Их начинает терзать сомнение: “А справлюсь ли я на ЕГЭ?!” Такие переживания могут зайти далеко и перерасти в никому не нужную депрессию. Думаю, вы тоже сталкивались с аналогичными проблемами. Что делать? Я предлагаю все трудности преодолевать вместе. Вначале мы повторим тему “Выход продукта реакции”, поучимся решать задачи, обязательно разберем 35-ю задачу, предложенную моей ученицей, а в конце статьи я расскажу вам секретное упражнение, которое нужно выполнять всякий раз, когда вы начинаете сомневаться в собственных силах и способностях. Упражнение так и называется “У меня все получится!”. Итак, поехали!
Выход продукта реакции (выход реакции) – это коэффициент, определяющий полноту протекания химической реакции. Он численно равен отношению количества (массы, объема) реально полученного продукта к его количеству (массе, объему), которое может быть получено по стехиометрическим расчетам (по уравнению реакции).
Решим задачи на выход продукта реакции, используя Четыре Заповеди. Каждое действие обводится зеленым овалом. Читайте внимательно и обязательно записывайте решение каждой задачи. После проработки статьи попробуйте самостоятельно решить все разобранные задачи.
Задача 1
При действии алюминия на оксид цинка массой 32,4 г получили 24 г цинка. Определите выход продукта реакции
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”
2) Вторая Заповедь. Написать уравнение реакции
Повторим теорию химии. Способ восстановления металлов алюминием – алюмотермия. Следует помнить: металлы, стоящие в ряду активности левее (более активные) восстанавливают металлы, стоящие правее, из расплавов оксидов или растворов солей
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→(H)→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции
В условии задачи представлены данные по одному из реагентов (оксиду цинка) и по одному из реально полученных продуктов (цинку). Составляем два досье, в каждом – масса, молярная масса, количество вещества (моль). Для цинка (продукт), масса и количество вещества – практические, т.к. продукт был получен реально.
Теоретическое значение продукта рассчитываем по уравнению реакции. Точка расчета – количество вещества реагента (оксида цинка). Расчеты выполняем на основании закона кратных отношений по схеме: точку расчета делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат. Выписывать отдельно пропорцию для расчетов не обязательно. Это – Легкие Расчеты по уравнениям реакций, которые не противоречат закону кратных отношений, но значительно упрощают решение задач по химии.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи “Определите выход продукта реакции”, – записываем соответствующую формулу и анализируем ее компоненты.
Подробно разберем решение обратной задачи: по известному выходу реакции определим неизвестное значение реагента или продукта.
Задача 2
Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2) Вторая Заповедь. Написать уравнение реакции.
Небольшой экскурс в теорию химии. Многие нерастворимые в воде гидроксиды разлагаются при нагревании. Продукты разложения – оксиды соответствующих металлов и вода.
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции
Составляем досье на реагент (гидроксид алюминия) – определяем его молярную массу и количество вещества (моль). По уравнению реакции рассчитываем теоретическое количество продукта (оксида алюминия). Расчеты выполняем на основании закона кратных отношений по схеме: точку расчета делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи “Определите массу оксида алюминия”, т.е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу. Анализируем компоненты формулы: молярную массу определяем по таблице Менделеева, количество вещества (практическое) рассчитываем по формуле выхода реакции.
Решим на закрепление еще несколько обратных задач с выходом реакции.
Задача 3
Карбонат натрия взаимодействует с соляной кислотой. Вычислите массу карбоната натрия для получения оксида углерода (IV) массой 56,1 г. Практический выход продукта 85%.
Задача 4
При действии оксида углерода (II) на оксид железа (III) получено железо массой 11,2 г. Найдите массу использованного оксида железа (III), если выход реакции составляет 80%.
Задача 5
При взаимодействии железа с хлором получено 10 г соли, что составляет 85% от теоретически возможного. Сколько граммов железа было взято для реакции с хлором?
В этой статье я не буду разбирать пошагово 35-ю задачу ЕГЭ, предложенную моей ученицей. На фото – подробное решение. Тот, кто уже решал аналогичные задачи, поймет без дополнительных объяснений. Для всех остальных – обязательно будем наслаждаться анализом этой задачи (и не только этой) в следующей статье. Обещаю ДРАЙВ!
Задача 35 ЕГЭ (восстановлена по памяти моей ученицы)
При гидратации 31,50 г этиленового углеводорода образовалось 23,76 г органического вещества. Выход продукта составил 60 %. Определите молекулярную формулу углеводорода и установите его структуру, если известно, что при его жёстком окислении перманганатом калия образуются кетон и кислота. Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ
Вернемся к проблеме, которую я затронула в начале статьи. Что делать, если резко упала самооценка, ты чувствуешь себя полным идиотом и боишься не справиться с трудными заданиями ЕГЭ? Все очень просто – выполни секретное упражнение “У меня все получится!” Я подсмотрела его на просторах Интернета (автора не знаю) и модифицировала это упражнение под себя и своих учеников:
1. Сядь в спокойной обстановке, закрой глаза, успокой дыхание. Сосредоточься на своей цели. Представь, что у тебя уже все получилось и ты достиг всего, к чему стремился.
2. Сожми ладони вместе перед собой и прижми их к груди. Обратись к Высшему Разуму (как ты его себе представляешь – Бог, Вселенная, Космос, Мир, Природа) с просьбой реализовать твою цель и мечты.
3. Побудь в таком состоянии несколько минут, затем встань, расправь плечи и стряхни с себя все плохое.
В конце статьи хочу привести цитату из стихотворения американского поэта Эдгара Геста, который был очень популярен 100 лет назад:
“И ты не верь тому, кто скажет: “Это слишком сложно!”
Не слушай тех, кто будет утверждать, что это невозможно,
Не бойся трудностей – скорей берись за дело,
Гони сомненья прочь – к мечте иди решительно и смело!”
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии https://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Источник


