Какие продукты реакции гидролиза могут образовываться
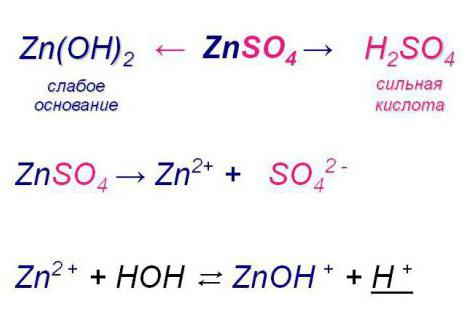
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.

Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
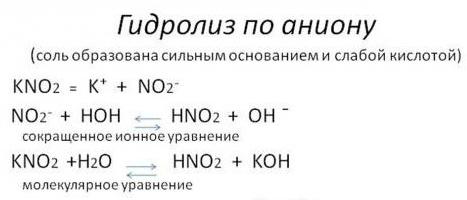
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:

Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О = (МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:

2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:

По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз.
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
Источник
Химия, как и большинство точных наук, требующих много внимания и твердых знаний, никогда не была любимой дисциплиной школьников. А зря, ведь с ее помощью можно понять множество процессов, происходящих вокруг и внутри человека. Взять, к примеру, реакцию гидролиза: на первый взгляд кажется, что она имеет значение только для ученых-химиков, но на самом деле без нее ни один организм не мог бы полноценно функционировать. Давайте узнаем об особенностях данного процесса, а также о его практическом значении для человечества.
Реакция гидролиза: что это такое?
Данным словосочетанием называется специфическая реакция обменного разложения между водой и растворяемым в ней веществом с образованием новых соединений. Гидролиз также можно назвать сольволизом в воде.

Данный химический термин образован от 2 греческих слов: «вода» и «разложение».
Продукты гидролиза
Рассматриваемая реакция может происходить при взаимодействии Н2О как с органическими, так и неорганическими веществами. Ее результат напрямую зависит от того, с чем контактировала вода, а также использовались ли при этом дополнительные вещества-катализаторы, изменялись ли температура и давление.
К примеру, реакция гидролиза соли способствует образованию кислот и щелочей. А если речь идет об органических веществах, получаются другие продукты. Водный сольволиз жиров способствует возникновению глицерина и высших жирных кислот. Если процесс происходит с белками, в результате образовывается различные аминокислоты. Углеводы (полисахариды) разлагаются на моносахариды.
В теле человека, неспособном полноценно усваивать белки и углеводы, реакция гидролиза «упрощает» их до веществ, которые организм в состоянии переварить. Так что сольволиз в воде играет важную роль в нормальном функционировании каждой биологической особи.
Гидролиз солей
Узнав, что такое реакция гидролиза, стоит ознакомиться с ее протеканием в веществах неорганического происхождения, а именно солях.
Особенностями данного процесса является то, что при взаимодействии этих соединений с водой ионы слабого электролита в составе соли отсоединяются от нее и образуют с Н2О новые вещества. Это может быль либо кислота, либо слабое основание, либо и то, и другое. Вследствие всего этого происходит смещение равновесия диссоциации воды.
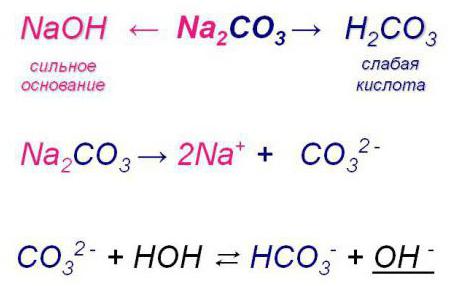
Обратимый и необратимый гидролиз
В приведенном выше примере в последнем уравнении гидролиза можно заметить вместо одной стрелки две, причем обе направлены в разные стороны. Что это значит? Данный знак сигнализирует о том, что реакция гидролиза имеет обратимый характер. На практике это означает, что, взаимодействуя с водой, взятое вещество одновременно не только разлагается на составляющие (которые позволяют возникать новым соединениям), но и образовывается вновь.

Однако не всякий гидролиз имеет обратимый характер, иначе бы он не имел смысла, так как новые вещества были бы нестабильны.
Существует ряд факторов, которые могут способствовать тому, чтобы подобная реакция стала необратимой:
- Температура. От того, повышается она или понижается, зависит то, в какую сторону смещается равновесие в происходящей реакции. Если она становится выше, происходит смещение к эндотермической реакции. Если же наоборот, температура понижается, преимущество оказывается на стороне экзотермической реакции.
- Давление. Это еще одна термодинамическая величина, активно влияющая на ионный гидролиз. Если оно повышается, химическое равновесие оказывается смещено в сторону реакции, которую сопровождает уменьшение общего количества газов. Если понижается, наоборот.
- Высокая или низкая концентрация веществ, участвующих в реакции, а также наличие дополнительных катализаторов.
Виды реакций гидролиза в солевых растворах
- По аниону (ион с отрицательным зарядом). Сольволиз в воде солей кислот слабых и сильных оснований. Такая реакция из-за свойств взаимодействующих веществ имеет обратимый характер.
- По катиону (ион с положительным зарядом). Гидролиз соли кислоты сильной и основания слабого. Она также обратима.
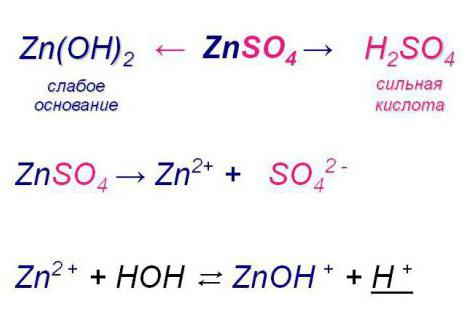
- Реакция соли слабой кислоты и слабого основания. Такой процесс можно считать практически необратимым, поскольку все новообразованные вещества покидают так называемую зону реакции, выпадая в осадок или превращаясь в газ.
- В случае если и основание, и соль кислоты – сильные, в таком растворе не происходит водный сольволиз.
Степень гидролиза
Изучая особенности гидролиза в солях, стоит обратить внимание на такое явление, как его степень. По этим словом подразумевается соотношение солей (которые уже вступили в реакцию разложения с Н2О) к общему количеству содержащегося данного вещества в растворе.
Чем слабее кислоты или основания, участвующее в гидролизе, тем выше его степень. Она измеряется в пределах 0-100 % и определяется по формуле, представленной ниже.
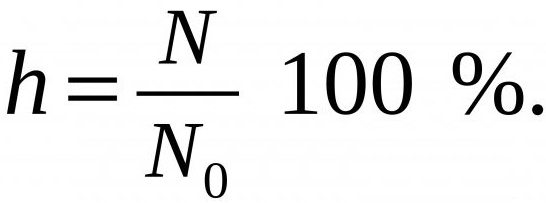
N – число молекул вещества, прошедших гидролиз, а N0 – общее их количество в растворе.
В большинстве случаев степень водного сольволиза в солях невелика. К примеру, в растворе ацетата натрия 1%-м она составляет всего 0,01 % (при температуре в 20 градусов).
Гидролиз в веществах органического происхождения
Изучаемый процесс может происходить и в органических химических соединениях.
Практически во всех живых организмах происходит гидролиз как часть энергетического обмена (катаболизма). С его помощью расщепляются белки, жиры и углеводы на легко усвояемые вещества. При этом часто сама вода редко оказывается в состоянии запустить процесс сольволиза, поэтому организмам приходится использовать различные ферменты в качестве катализаторов.
Если же речь идет о химической реакции с органическими веществами, направленной на получение новых веществ в условиях лаборатории или производства, то для ускорения и улучшения его в раствор добавляют сильные кислоты или щелочи.
Гидролиз в триглицеридах (триацилглицеринах)
Этим сложно произносимым термином именуются жирные кислоты, которые большинству из нас известны как жиры.
Они бывают как животного, так и растительного происхождения. Однако всем известно, что вода не способна растворять подобные вещества, как же происходит гидролиз жиров?
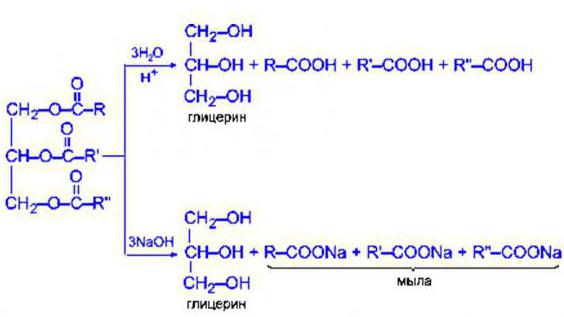
Рассматриваемая реакция именуется омылением жиров. Это водный сольволиз триацилглицеринов под влиянием ферментов в щелочной или кислотной среде. В зависимости от нее, выделяется щелочной гидролиз и кислотный.
В первом случае в результате реакции образуются соли высших жирных кислот (более известные всем как мыла). Таким образом, из NaOH получается обычное твердое мыло, а из КОН – жидкое. Так что щелочной гидролиз в триглицеридах – это процесс образования моющих средств. Стоит отметить, что его можно свободно проводить в жирах как растительного, так и животного происхождения.

Рассматриваемая реакция является причиной того, что мыло довольно плохо стирает в жесткой воде и вообще не мылится в соленой. Дело в том, что жесткой называется Н2О, в которой содержится в избытке ионов кальция и магния. А мыло, попав в воду, вновь подвергается гидролизу, распадаясь на ионы натрия и углеводородный остаток. В результате взаимодействия этих веществ в воде образуются нерастворимые соли, которые и выглядят как белые хлопья. Чтобы этого не произошло, в воду добавляется гидрокарбонат натрия NaHCO3, более известный как пищевая сода. Это вещество увеличивает щелочность раствора и тем самым помогает мылу выполнять свои функции. Кстати, чтобы избежать подобных неприятностей, в современной промышленности изготавливают синтетические моющие средства из других веществ, например из солей сложных эфиров высших спиртов и серной кислоты. В их молекулах содержится от двенадцати до четырнадцати углеродных атомов, благодаря чему они не теряют своих свойств в соленой или жесткой воде.
Если среда, в которой происходит реакция, кислая, такой процесс называется кислотным гидролизом триацилглицеринов. В данном случае под действием определенной кислоты вещества эволюционируют до глицерина и карбоновых кислот.
Гидролиз жиров имеет еще один вариант – это гидрогенизация триацилглицеринов. Данный процесс используется в некоторых видах очистки, например при удалении следов ацетилена из этилена или кислородных примесей из различных систем.
Гидролиз углеводов
Рассматриваемые вещества являются одними из наиболее важных составляющих пищи человека и животных. Однако сахароза, лактоза, мальтоза, крахмал и гликоген в чистом виде организм не способен усвоить. Поэтому, так же как и в случае с жирами, эти углеводы расщепляются на усвояемые элементы с помощью реакции гидролиза.
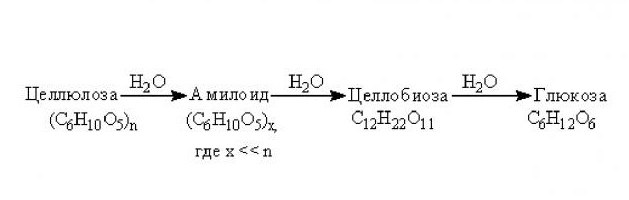
Также водный сольволиз углеродов активно применяется и в промышленности. Из крахмала, вследствие рассматриваемой реакции с Н2О, добывают глюкозу и патоку, которые входят в состав практически всех сладостей.

Еще один полисахарид, который активно используется в промышленности для изготовления многих полезных веществ и продуктов, – это целлюлоза. Из нее добывают технический глицерин, этиленгликоль, дрожжи кормовые, сорбит и хорошо известный всем этиловый спирт.
Гидролиз целлюлозы происходит при длительном воздействии высокой температуры и наличии минеральных кислот. Конечным продуктом этой реакции является, как и в случае с крахмалом, глюкоза. При этом стоит учитывать, что гидролиз целлюлозы проходит более сложно чем, у крахмала, поскольку этот полисахарид устойчивее к воздействию минеральных кислот. Однако поскольку целлюлоза является главной составляющей клеточных оболочек всех высших растений, сырье, ее содержащее, обходится дешевле, чем для крахмала. При этом целлюлозную глюкозу более используют для технических нужд, в то время как продукт гидролиза крахмала считается лучше пригодным для питания.
Гидролиз белков
Белки – это основной строительный материал для клеток всех живых организмов. Они состоят из многочисленных аминокислот и являются весьма важным продуктом для нормального функционирования организма. Однако являясь высокомолекулярными соединения, они могут плохо усваиваться. Чтобы упростить данную задачу, происходит их гидролиз.
Как и в случае с другими органическими веществами, данная реакция разрушает белки до низкомолекулярных продуктов, легко усваиваемых организмом.
Источник
