Какие продукты при электролизе водного раствора и расплава

Определение
Электролиз – это физико-химический окислительно-восстановительный процесс, протекающий в растворах или расплавах электролитов под действием электрического тока, заключающийся в выделении на электродах составных частей растворённых веществ или других веществ – продуктов вторичных реакций на электродах.
процесс на катоде K(-): катион принимает электроны и восстанавливается
процесс на аноде A(+): анион отдает электроны и окисляется
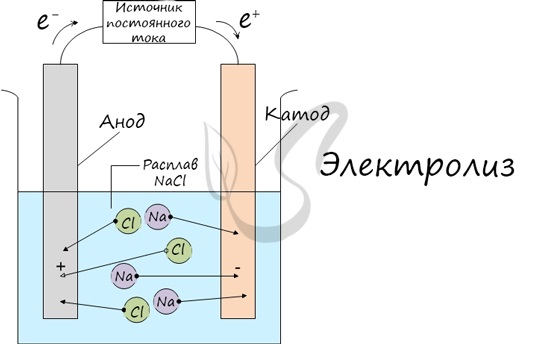
Рассмотрим процессы, протекающие при электролизе, на примере хлорида натрия. При сильном нагревании твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы натрия и хлора, освободившиеся из кристаллической решетки, и поэтому проводит электрический ток. Если в расплав опустить угольные электроды, присоединенные к источнику тока, ионы приобретают направленное движение: катионы $mathrm{Na^+}$ движутся к отрицательно заряженному электроду – катоду, анионы $mathrm{Cl^–}$ – к положительно заряженному электроду – аноду.
На катоде ионы $mathrm{Na^+}$ получают электроны и восстанавливаются до металла:
$ Na^+ + e^- rightarrow Na$ (восстановление),
а на аноде ионы $mathrm{Cl^–}$ отдают электроны и окисляются до свободного хлора:
$2Cl^– – 2e^- rightarrow Cl_2$ (окисление).
Таким образом, в результате процесса электролиза расплав хлорида натрия разлагается на простые вещества:
$K^-: hspace{0.5cm} 2Na^+ + 2e^- rightarrow 2Na$
$A^+: hspace{0.5cm} 2Cl^- – 2e^- rightarrow Cl_2$
Суммарное уравнение электролиза: $2Na^+ + 2Cl^- xrightarrow[]{textrm{эл.ток}} 2Na + Cl_2$
Электролиз отличается от обычных окислительно-восстановительных реакций. При электролизе полуреакции разделены в пространстве: восстановление происходит только на катоде, а окисление – на противоположном электроде – аноде.
Окислительное и восстановительное действие электрического тока намного сильнее действия обычных химических веществ. Только с помощью тока ученым удалось получить наиболее активные простые вещества – натрий, калий и фтор. Пионером в использовании электрического тока в химии был английский ученый Гемфри Дэви. Подвергая электролизу расплавы различных соединений, он открыл восемь неизвестных до него химических элементов.
Электролиз растворов электролитов
В водных растворах процессы электролиза осложняются присутствием воды, которая проявляет двойственную природу: она может проявлять свойства и окислителя, и восстановителя. На катоде вода может принимать электроны, и тогда атомы водорода в ней будут восстанавливаются до газообразного водорода:
$K^-: hspace{0.5cm} 2H_2O + 2e^- rightarrow H_2uparrow + 2OH^–$.
На аноде вода может отдавать электроны, при этом атомы кислорода будут окисляться до газообразного кислорода:
$A^+: hspace{0.5cm} 2H_2O – 4e^- rightarrow O_2 + 4H^+$.
Другими словами, при электролизе растворов электролитов (чаще всего солей) на катоде и аноде протекают конкурирующие процессы: катионы металла $Me^{+n}$ конкурируют с катионами водорода $H^+$, а анионы кислотных остатков $An^{n-}$ конкурируют с анионами гидроксильных групп $(OH)^-$. Рассмотрим подробнее процессы, протекающие на электродах.
ЗАКОНОМЕРНОСТИ ПРОЦЕССОВ НА КАТОДЕ
На отрицательно заряженном электроде – катоде, происходит восстановление катионов, которое не зависит от материала катода, из которого он сделан, но зависит от активности металла, т.е. от положения металла в электрохимическом ряду напряжения (ЭХР). (Сравниваем окислительную способность, то есть способность принимать электроны, ионов металлов и иона водорода)

| Li K Ca Na Mg Al | Mn Zn Fe Ni Sn Pb | Cu Hg Ag Pt Au |
|---|---|---|
$Me^+n bar{e} ne$ $2H_2O + 2bar{e} =H_2 + 2OH^-$ | $Me^{+n} + n bar{e} = Me^0$ $2 H_2O + 2bar{e} = H_2 + 2OH^-$ | $Me^{+n} + n bar{e} = Me^0$ |
На катоде всегда восстанавливаются молекулы воды | На катоде могут восстанавливаться и ионы металла, и воды в зависимости от плотности тока, Т и концентрации соли | На катоде всегда восстанавливаются ионы металлов |
Если соль образована активным металлом, стоящим в ряду напряжения до марганца, на катоде не восстанавливаются катионы металла, а происходит восстановление воды с выделением газообразного водорода.
Если металл, образующий соль средней активности (после алюминия, но до водорода), то на катоде возможны два конкурирующих процесса: и восстановление воды, и восстановление катионов металла. Преобладание того или иного процесса зависит от плотности тока, температуры и концентрации соли.
Легче всего принимаю электроны неактивные металлы (стоящие в ЭХР после Н), поэтому они легко восстанавливаются на катоде до простого вещества – металла.
Закономерности процессов на аноде
Процесс на положительно заряженном электроде – аноде зависит от материала анода и от природы аниона. При электролизе растворов электролитов на аноде происходит окисление анионов. Образующийся продукт зависит от восстановительной активности аниона кислотного остатка.
Ряд восстановительной активности анионов (уменьшается). По способности окисляться анионы располагаются в следующем порядке:
$J^- hspace{6pt} > hspace{6pt} Br^- hspace{6pt} > hspace{6pt} S^{2-} hspace{6pt} > hspace{6pt} Cl^- hspace{6pt} > hspace{6pt} OH^- hspace{6pt} > hspace{6pt} SO_4^{2-} hspace{6pt} > hspace{6pt} NO_3^- hspace{6pt} > hspace{6pt} F^-$
Анод может быть растворимым и нерастворимым (инертным).
Запомни!
1. Растворимый анод при электролизе, как правило, растворяется с образованием катионов металла анода.
2. На нерастворимом аноде, если кислотный остаток соли бескислородный (кроме фторидов!), происходит окисление аниона до простого вещества – неметалла.
3. Если в состав соли входит остаток кислородсодержащей кислоты, то на аноде происходит окисление воды и выделяется кислород.
| Анод | Кислотный остаток | |||
|---|---|---|---|---|
бескислородный $Cl^-, Br^-, I^-, S^{2-} $ | кислородсодержащий $NO_3^-, SO_4^{2-}, PO_4^{3-}, F^-$ | |||
на аноде окисляются ионы кислотного остатка | на аноде окисляются молекулы воды | |||
| нерастворимый | Окисление аниона (кроме фторидов): $Ac^{ m-} – mbar{e} = Ac^0$ | В щелочной среде: $4OH^- – 4bar{e} rightarrow 2H_2O + O_2$ В кислой, нейтральной среде: $2H_2O – 4bar{e} rightarrow 4H^+ + O_2$ | ||
| растворимый | Окисление металла анода: $Me^0- nbar{e}= Me^{+n}$ анод раствор | |||
Рассмотрим процесс электролиза растворов электролитов на конкретных примерах.
Пример 1
Электролиз раствора соли активного металла и бескислородной кислоты
$NaCl leftrightarrow Na^+ + Cl^−$
Рассмотрим полуреакции окисления и восстановления. Натрий – активный металл, он стоит в ряду напряжений левее водорода, поэтому на катоде восстанавливается вода и выделяется водород. Хлорид-ион не содержит атомов кислорода, поэтому на аноде он окисляется и выделяется хлор:
K”катод”(-): $2H_2O + 2bar{e} = H_2 uparrow+ 2OH^−hspace{0.2cm} | 1$
A”анод”(+): $2Cl^- − 1bar{e} cdot 2 = Cl_2 uparrow hspace{1.1cm} |1$
При сложении уравнений полуреакций получаем сокращенное ионное уравнение электролиза:
$mathrm{2Cl^– + 2H_2O rightarrow H_2 + Cl_2 + 2 OH^–}$.
Если добавить в левую и правую часть по два иона $mathrm{Na^+}$, которые в самом электролизе не участвуют, получим молекулярное уравнение электролиза раствора хлорида натрия:
$Sigma: hspace{0.5cm} 2NaCl (p-p) + 2H_2O xrightarrow[]{textrm{эл.ток}} H_2 uparrow + Cl_2 uparrow+2NaOH$
Мы видим, что при электролизе раствора такого широко доступного и дешевого вещества, как хлорид натрия, получилось сразу три ценных продукта: водород, хлор и щелочь. Именно поэтому электролиз широко используется в разных отраслях промышленности. С его помощью получают химически чистые металлы и удаляют растворимые примеси из воды.
Пример 2
Электролиз раствора соли активного металла и кислородсодержащей кислоты
$Na_2SO_4 (p-p)leftrightarrow 2Na^++SO_4^{2−}$
K(-): $2H_2O + 2bar{e} = H_2 uparrow+ 2OH^−hspace{0.3cm} | 2$
A(+): $2H_2O — 4bar{e} = O_2 uparrow+ 4H^+hspace{0.5cm} | 1$
Если первое уравнение умножить на 2 и сложить со вторым уравнением, получим:
$2cdot2H_2O + 2H_2O= 2H_2 + O_2 + 4H^+ + 2cdot 2OH^–$
$6H_2O= 2H_2 + O_2 + 4H^+ + 4OH^–$.
Ионы водорода и гидроксид-ионы реагируют друг с другом:
$mathrm{4H^+ + 4OH^– = 4H_2O}$
После сокращения молекул воды в левой и правой частях получаем полное уравнение электролиза:
$Sigma: hspace{0.5cm} 2H_2O xrightarrow[]{textrm{эл.ток}} 2H_2 uparrow + O_2 uparrow$
Пример 3
Электролиз раствора гидроксида активного металла
$NaOH (p-p) leftrightarrow Na^+ + OH^−$
K(-): $2H_2O + 2bar{e} = H_2 uparrow + 2OH^−$
A(+): $2H_2O — 4bar{e} = O_2 uparrow + 4H^+$
$Sigma: hspace{0.5cm} 2H_2O xrightarrow[]{textrm{эл.ток}} 2H_2 uparrow + O_2 uparrow$
Пример 4
Электролиз раствора соли среднеактивного металла и бескислородной кислоты
$ZnCl_2 leftrightarrow Zn^{2+} + 2Cl^−$
K”катод”(-): $Zn^{2+} + 2bar{e} = Zn^0$
$2H_2O + 2bar{e} = H_2 uparrow + 2OH^−$
A”анод”(+): $2Cl^- − 1bar{e} cdot 2 = Cl_2 uparrow$
$Sigma: hspace{0.5cm} 2ZnCl_2(p-p) + 2H_2O xrightarrow[]{textrm{эл.ток}} Zn +H_2uparrow + Zn(OH)_2downarrow + 2Cl_2 uparrow$
Обратите внимание, что при электролизе водных растворов солей среднеактивных металлов на катоде одновременно выделяется и металл и водород.
Иногда, в рамках решения ЕГЭ, требуется упрощенная запись этого процесса. В таком случае следует записать только выделение водорода на катоде (основной процесс):
$Sigma: hspace{0.5cm} ZnCl_2(p-p) + 2H_2O xrightarrow[]{textrm{эл.ток}} H_2uparrow + + Zn(OH)_2downarrow + Cl_2 uparrow$
Пример 5
Электролиз раствора соли среднеактивного металла и кислородсодержащей кислоты
$ZnSO_4 (p-p) leftrightarrow Zn^{2+} +SO_4^{2−}$
K(-): $Zn^{2+} + 2bar{e} = Zn^0$
$2H_2O + 2bar{e} = H_2 uparrow + 2OH^−$
A(+): $2H_2O — 4bar{e} = O_2 uparrow + 4H^+$
$Sigma: hspace{0.5cm} 2ZnSO_4 (p-p)+ 4H_2O xrightarrow[]{textrm{эл.ток}} Zn + +H_2uparrow + Zn(OH)_2downarrow + 2H_2SO_4 + O_2 uparrow$
Иногда, в рамках решения ЕГЭ, требуется упрощенная запись этого процесса. В таком случае следует записать только выделение водорода на катоде (основной процесс):
$Sigma: hspace{0.5cm} 2ZnSO_4 (p-p)+ 2H_2O xrightarrow[]{textrm{эл.ток}} 2Zn + 2H_2SO_4 + O_2 uparrow$
Пример 6
Электролиз гидроксида менее активного металла :
$Fe(OH)_3xrightarrow[]{textrm{эл.ток}} ne$
невозможно (нерастворим)
Источник
Электролиз (греч. elektron – янтарь + lysis — разложение) – химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы – положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.
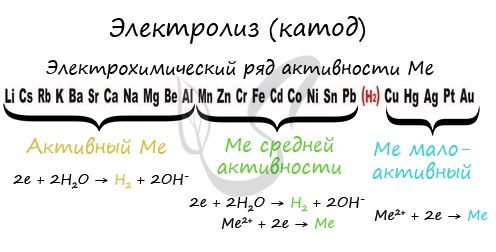
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) – на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды – выделяется водород.
В случае, если на катод поступают ионы водорода – H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ – 2e = H2
Анод
К аноду притягиваются анионы – отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-,
I-, F-, S2-, CH3COO-.

При электролизе кислородсодержащих анионов: SO42-, PO43- – на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор – если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор – самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ – CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH
Натрий – активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача – получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
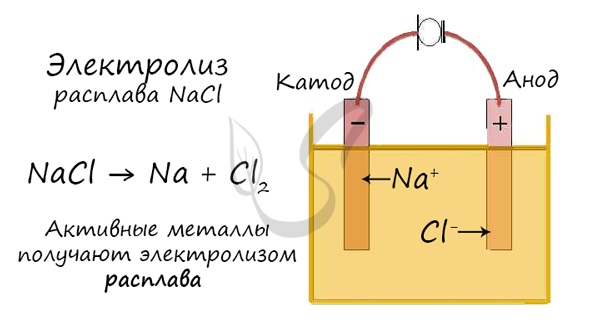
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Что такое электролиз? Для более простого понимания ответа на этот вопрос давайте представим себе любой источник постоянного тока. У каждого источника постоянного тока всегда можно найти положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
NaCl = Na+ + Cl−
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na+ направятся к отрицательно заряженному электроду – катоду. В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−. То есть на катоде протекает процесс:
Na+ + 1e− = Na0,
А на аноде:
Cl− − 1e− = Cl
Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
Сl∙ + ∙Cl = Cl2
Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
2Cl− − 2e− = Cl2
То есть мы имеем:
Катод: Na+ + 1e− = Na0
Анод: 2Cl− − 2e− = Cl2
Подведем электронный баланс:
Na+ + 1e− = Na0 |∙2
2Cl− − 2e− = Cl2 |∙1<
Сложим левые и правые части обоих уравнений полуреакций, получим:
2Na+ + 2e− + 2Cl− − 2e−= 2Na0 + Cl2
Сократим два электрона аналогично тому, как это делается в алгебре получим ионное уравнение электролиза:
2Na++ 2Cl− = 2Na0 + Cl2
далее, объединив ионы Na+ и Cl− получим, уравнение электролиза расплава хлорида натрия:
2NaCl(ж.) => 2Na + Cl2
Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
Другими словами, ни у катионов Na+, ни у анионов Cl− не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
При этом могут происходить процессы:
Катод:
2H2O + 2e− = 2OH− + H2
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
В таком случае является возможным только восстановление молекул воды на катоде.
Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
2H2O + 2e− = 2OH− + H2
Это касается металлов, находящихся в начале ряда активности по Al включительно.
2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
2H2O + 2e− = 2OH− + H2
Men+ + ne = Me0
К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
2Н+ + 2е− = Н2 – в случае кислоты
Men+ + ne = Me0 – в случае соли
На аноде тем временем ситуация следующая:
1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F−), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
2Сl− − 2e = Cl2
S2- − 2e = So
Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
4ОН− − 4е− = 2H2O + O2
3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F−) на аноде идет процесс окисления молекул воды:
2H2O – 4e− = O2 + 4H+
4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
2RCOO− − 2e− = R-R + 2CO2
Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
Пример №1
Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
Решение
При расплавлении хлорида цинка происходит его диссоциация:
ZnCl2 = Zn2+ + 2Cl−
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
Катод: Zn2+ + 2e− = Zn0 |∙1
Анод: 2Cl− − 2e− = Cl2 |∙1
ZnCl2 = Zn + Cl2
Пример №2
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.
Катод:
2H2O + 2e− = 2OH− + H2
Zn2+ + 2e− = Zn0
Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
Анод:
2Cl− − 2e− = Cl2
В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
Пример №3
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
Нитрат меди в растворе находится в продиссоциированном состоянии:
Cu(NO3)2 = Cu2+ + 2NO3−
Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
Катод:
Cu2+ + 2e− = Cu0
Нитрат-ион NO3− — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом:
Катод: Cu2+ + 2e− = Cu0 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
2Cu(NO3)2 + 2H2O = 2Cu0 + O2 + 4HNO3
Пример №4
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
Решение:
Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
СН3СООК = СН3СОО− + К+
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
Катод:
2H2O + 2e− = 2OH− + H2
Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
Анод:
2СН3СОО− − 2e− = CH3−CH3 + 2CO2
Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
Катод: 2H2O + 2e− = 2OH− + H2 |∙1
Анод: 2СН3СОО− − 2e− = CH3−CH3 + 2CO2 |∙1
2H2O + 2СН3СОО− = 2OH− + Н2+ CH3−CH3 + 2CO2
Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
2H2O + 2СН3СООK = 2KOH + Н2+ CH3−CH3 + 2CO2
Пример №5
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
H2SO4 = 2H+ + SO42-
На катоде будет происходить восстановление катионов водорода H+ , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
Катод: 2Н+ + 2e− = H2 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
4Н+ + 2H2O = 2H2 + O2 + 4H+
Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
2H2O = 2H2 + O2
Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.
Пример №6
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
Диссоциация гидроксида натрия:
NaOH = Na+ + OH−
На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
Катод: 2H2O + 2e− = 2OH− + H2 |∙2
Анод: 4OH− − 4e− = O2 + 2H2O |∙1
4H2O + 4OH− = 4OH− + 2H2 + O2 + 2H2O
Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
2H2O = 2H2 + O2
Источник
