Какие продукты получаются при гидролизе жира
Жиры – органические соединения, по строению являющиеся сложными эфирами трехатомного спирта глицерина и высших карбоновых (жирных)
кислот.
К жирным кислотам (их формулы лучше выучить 😉 относятся:
- Пальмитиновая – C15H31COOH (предельная)
- Стеариновая – C17H35COOH (предельная)
- Олеиновая – C17H33COOH (непредельная, 1 двойная связь в радикале)
- Линолевая – C17H31COOH (непредельная, 2 двойные связи в радикале)
- Линоленовая – C17H29COOH (непредельная, 3 двойные связи в радикале)
Растительные и животные жиры
Жиры образуются в организме растений и животных, служат запасным питательным веществом. В строении растительных и животных жиров
есть некоторые важные отличия.
Заметьте, что растительные жиры чаще жидкие и в них входят преимущественно остатки непредельных жирных кислот, а животные жиры – твердые и
содержат остатки предельных жирных кислот.

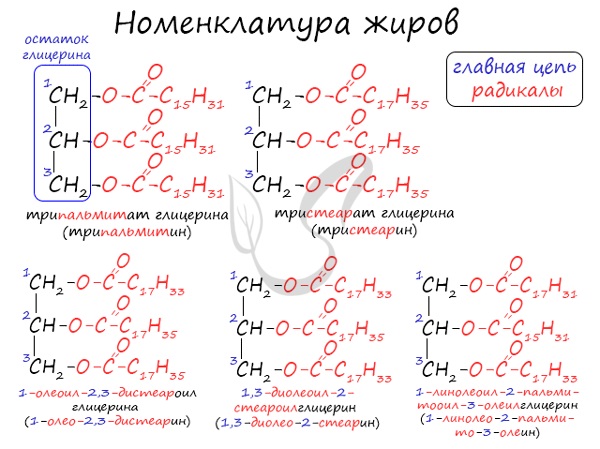
Номенклатура жиров
По систематической номенклатуре жиры принято называть триацилглицеринами. Названия жирам дают в зависимости от ацилов – остатков жирных
кислот, входящих в их состав. Для формирования единого названия к остаткам кислот добавляют суффикс “оил”.
В соответствии с тривиальной номенклатурой, жиры называют, добавляя окончание “ин” к названию кислоты и приставку, указывая, сколько гидроксогрупп
в молекуле глицерина подверглось этерификации. В общем лучше 1 раз увидеть, чем 100 раз услышать 😉
Получение жиров
Жиры (по строению сложные эфиры) получаются в реакции этерификации, протекающей между трехатомным спиртом глицерином и высшими карбоновыми
(жирными) кислотами.
В зависимости от того, какие именно кислоты участвуют в реакции, образуются различные жиры.

Химические свойства жиров
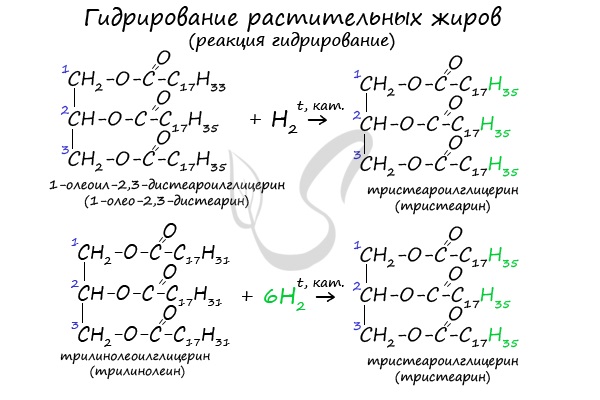
- Гидрирование растительных жиров
- Гидролиз
В состав растительных жиров входят непредельные кислоты, которые поддаются гидрированию и превращаются в предельные. Таким путем в пищевой
промышленности получают маргарин.
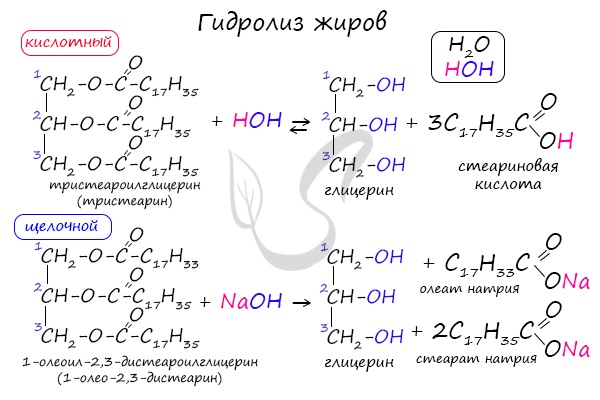
Как сложные эфиры, жиры способны вступать в реакцию гидролиза, который может быть кислотным и щелочным. В результате кислотного гидролиза
образуется глицерин и исходные жирные кислоты, в результате щелочного гидролиза – глицерин и соли жирных кислот.
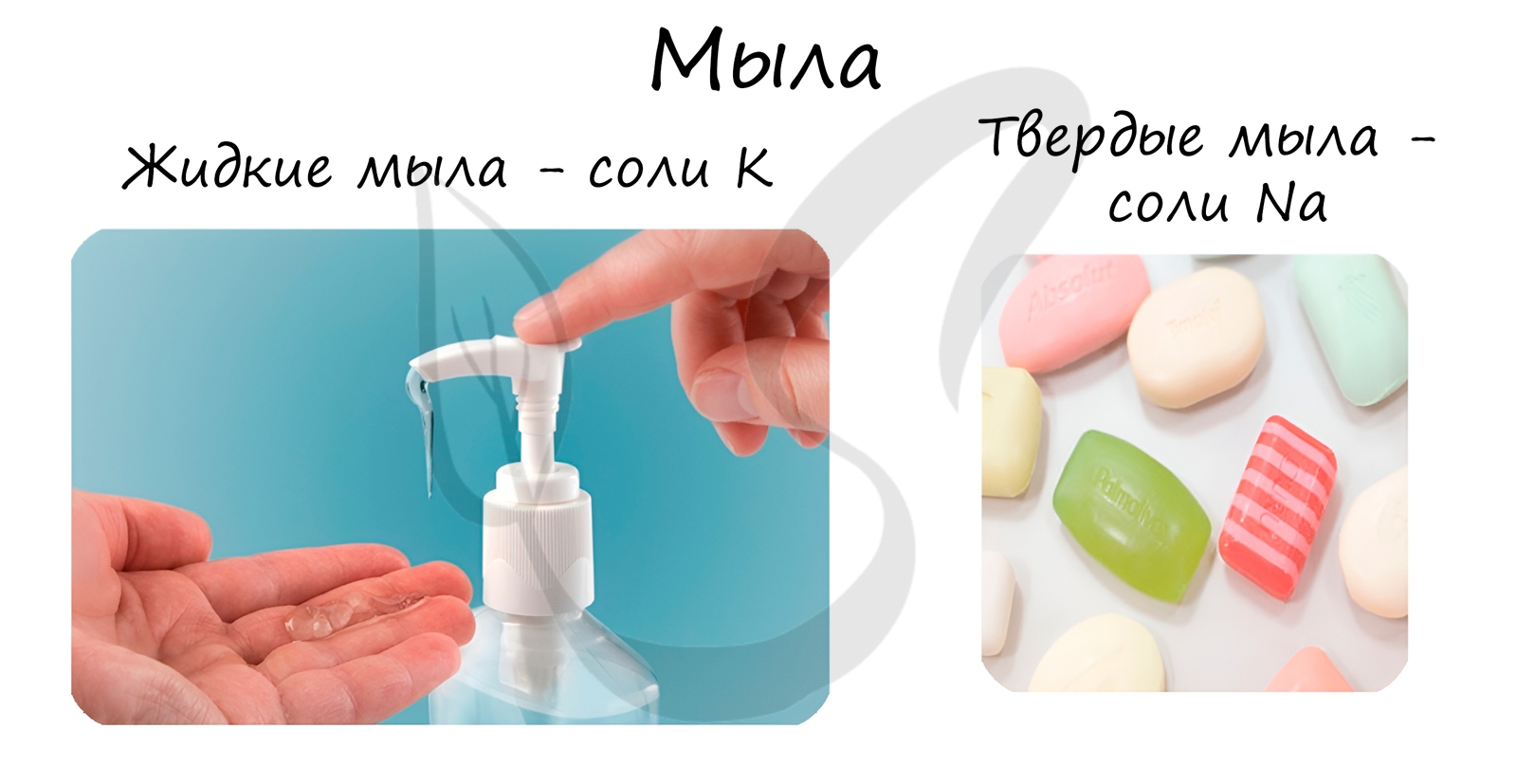
Реакция щелочного гидролиза жиров называется реакцией омыления, в результате получаются соли жирных кислот – мыла. Кислотный гидролиз протекает
обратимо, щелочной – необратимо.

В состав твердого мыла входят соли Na, в состав жидкого – K.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Жиры – это сложные эфиры, образованные глицерином и высшими одноосновными карбоновыми кислотами (жирными кислотами).
.

Жиры образуются при взаимодействии глицерина и высших карбоновых кислот:

| Жирные (высшие) кислоты | |
| Предельные кислоты | Непредельные кислоты |
| Масляная кислота С3Н7 -СООН | Олеиновая кислота С17Н33СООН (содержит одну двойную связь в радикале) СН3—(СН2)7—СН = СН—(СН2)7—СООН |
| Пальмитиновая кислота С15Н31 — СООН | Линолевая кислота С17Н31СООН (две двойные связи в радикале) СН3-(СН2)4-СН = СН-СН2-СН = СН-СООН |
| Стеариновая кислота С17Н35 — СООН | Линоленовая кислота С17Н29СООН (три двойные связи в радикале) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:

Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин

1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия.

2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина:

Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира.
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca2+ и Mg2+ дают с высшими кислотами нерастворимые в воде соли.
Например, тристеарат глицерина взаимодействует с сульфатом кальция
![]()
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата.
![]()
Далее алкилсульфат гидролизуется щелочью:
![]()
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Источник

А. Классификация липидов
Липиды — большая группа веществ биологического происхождения, хорошо растворимых в органических растворителях, таких, как метанол, ацетон, хлороформ и бензол. В то же время эти вещества нерастворимы или мало растворимы в воде. Слабая растворимость связана с недостаточным содержанием в молекулах липидов атомов с поляризующейся электронной оболочкой, таких, как О, N, S или P (см. с. 14)
Липиды подразделяются на омыляемые и неомыляемые. Из огромного множества липидов здесь приведены лишь некоторые представители. Отдельные классы липидов обсуждаются в последующих разделах.
Омыляемые липиды. Структурные компоненты омыляемых липидов связаны сложноэфирной связью. Эти липиды легко гидролизуются в воде под действием щелочей или ферментов. Омыляемые липиды включают три группы веществ: сложные эфиры,фосфолипиды и гликолипиды. В группу сложных эфиров входят нейтральные жиры (глицерин+три жирные кислоты), воски (жирный спирт+жирная кислота) и эфиры стеринов (стерин+жирная кислота). Группа фосфолипидов включает фосфатидовые кислоты (глицерин+две жирные кислоты+фосфатная группа), фосфатиды (глицерин+две жирные кислоты+фосфатная группа+спирт) исфинголипиды (сфингозин+жирная кислота+фосфатная группа+спирт). К группе гликолипидов относятся цереброзиды (сфингозин+жирная кислота+один углеводный остаток) и ганглиозиды (сфингозин+жирная кислота+несколько углеводных остатков, в том числе нейраминовая кислота).
Группа неомыляемых липидоввключает предельные углеводороды и каротиноиды, а также спирты. В первую очередь это спирты с длинной алифатической цепью, циклические стерины (например, холестерин) и стероиды (эстрадиол, тестостерон и др.). Важнейшую группу липидов образуют жирные кислоты. К этой группе относятся также эйкозаноиды, которые можно рассматривать как производные жирных кислот
Гидролиз жиров[править | править вики-текст]
Гидролиз для жиров характерен, так как они являются сложными эфирами. Он осуществляется под действием минеральных кислот и щелочей при нагревании. Гидролиз жиров в живых организмах происходит под влиянием ферментов. Результат гидролиза — образование глицерина и соответствующих карбоновых кислот: С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH
Расщепление жиров на глицерин и соли высших карбоновых кислот проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омыление жиров (см. Мыло).
С3H5(COO)3-(C17H35)3 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
тристеарин (жир) + едкий натр → глицерин + стеарат натрия (мыло)
Аналитическая характеристика жиров
Кроме температуры плавления и затвердевания, для характеристики жиров применяются следующие величины: кислотное число, число омыления, йодное число.
Природные жиры нейтральны. Однако при переработке или хранении вследствие процессов гидролиза или окисления образуются свободные кислоты, количество которых непостоянно. Кислотное число представляет собой число миллиграммов гидроксида калия, необходимое для нейтрализации свободных жирных кислот, содержащихся в 1 г жира.
Число омыления равно числу миллиграммов гидроксида калия, расходующихся при омылении 1 г жира кипячением последнего с избытком гидроксида калия в спиртовом растворе. Число омыления чистого триолеина равно 192. Высокое число омыления указывает на присутствие кислот с «меньшими молекулами». Малые числа омыления указывают на присутствие более высокомолекулярных кислот или же неомыляемых веществ. При взаимодействии с щелочами жиры гидролизуются с образованием солей высокомолекулярных кислот, называемых «мылами».
Йодное число выражается числом граммов йода, которое может присоединяться по двойным связям к 100 г жира. Для определения йодного числа применяют растворы хлорида йода ICl, бромида йода IBr, или йода в растворе сулемы, которые более реакционноспособны, чем сам йод. Йодное число является мерой ненасыщенности кислот жиров. Оно важно для оценки качества высыхающих масел.[1,2]
ОМЫЛЕНИЕ, гидролиз сложного эфира с образованием спирта и к-ты (или ее соли):
Происхождение термина “омыление” связано с методом произ-ва мыла из жиров. Омылением часто наз. гидролитич. превращения любых производных к-т, приводящие к к-там или их солям (омыление нитрилов, амидов,хлорангидридов и т.п.):
Поскольку галогензамещенные углеводороды можно рассматривать как эфиры галогеноводородных к-т, их гидролизтакже часто называют омылением:
Иногда термин “омыление” применяют к др. случаям гидролиза орг. соед., напр. омыление простых эфиров.
32. Высшие жирные кислоты. Мыла. Детергенты. Химические свойства Высшие жирные кислоты (ВЖК), натуральные (природные) и синтетические карбоновые кислоты алифатического ряда с числом атомов углерода в молекуле не менее 6.
Натуральные высшие жирные кислоты – преимущественно одноосновные кислоты нормального строения с четным числом атомов углерода в молекуле; могут быть насыщенными и ненасыщенными (с двойными связями, реже с тройными). Кроме карбоксильной группы, они могут содержать другие функциональные группы, например ОН. Содержатся в животных жирах и растительных маслах в виде сложных эфировглицерина (так называемых глицеридов), а также в природных восках в виде эфиров высших жирных спиртов. Наиболее распространены кислоты с 10-22 атомами углерода в молекуле (см. табл. 1).
Получают натуральные высшие жирные кислоты из жиров и масел. В промышленности используют преимущественно высокотемпературный (200-225 oС) гидролиз под давлением (~ 2,50 МПа), реже – кислотныйгидролиз в присутствии контакта Петрова. В лабораторных условиях высшие жирные кислоты синтезируют кислотным гидролизом в присутствии реактива Твитчеля (смесь олеиновой и серной кислот с бензолом), ферментативным (липазным) гидролизом, омылением растворами гидроксидов металлов I группы с последующим разложением образовавшихся солей (мыл) водными растворами H2SO4 или НСl.
мыла, соли высших жирных (С8-С18), нафтеновых и смоляных кислот; одни из основных моющих средств. Технические смеси водорастворимых (калиевых, натриевых, аммониевых и три-этаноламмониевых) солей этих кислот называют щелочными мылами, водонерастворимые соли, содержащие металлы II, III и других групп (например, Са, Mg, Ni, Mn, Al, Co, Pb и других) – металлическими.
Щелочные мыла получают главным образом из стеариновой, пальмитиновой, лауриновой, олеиновой, нафтеновых кислот, канифоли и таллового масла.
Индивидуальные соли высших жирных кислот – кристаллические вещества; плотность около 1,05 г/см3, т. пл. 225-260 °С. В зависимости от условий кристаллизации мыла существуют в моноклинной или ромбической форме; последняя характеризуется лучшей растворимостью в воде. При наличии в мыле ничтожных количеств воды температураплавления понижается до 100°С. Соли ненасыщенных жирных кислот лучше растворимых в воде и труднее кристаллизуются, чем соли насыщенных. Безводные мыла гигроскопичны; их гигроскопичность зависит от природы кислотного остатка и связанного с ним катиона. При повышенных температурах мыла и вода смешиваются во всех отношениях; при комнатной – водные растворы мыла образуют твердые гели, содержащие воду, макс. кол-во которой зависит от природы жирной кислоты и иона металла. При определенной концентрации мыла образуют мицеллярныерастворы и проявляют максимальное моющее действие. Важная характеристика мыла-концентрация, при которой происходит образование мицелл, называют критической концентрацией мицеллообразования (см. табл.). В области критической концентрации свойства растворов мыла (поверхностное натяжение, электрическая проводимость, осмотическое давление и др.) резко изменяются.
Детергенты (лат. detergens, detergentis очищающий) — поверхностно-активные вещества; в медицине используются в качестве моющих и дезинфицирующих средств, применяются также при изготовлении некоторых фармацевтических, в т.ч. ферментных, препаратов, в пищевой промышленности и др.
Поверхностно-активные вещества (ПАВ) при добавлении к так называемым дисперсным системам концентрируются на границе раздела фаз, вызывают снижение поверхностного (межфазного) натяжения и дают возможность этим прежде четко разделенным фазам «проникать» друг в друга, т.е. растворяться. В воде молекулы Д. при определенной концентрации, превышающей так называемую критическую концентрацию мицеллообразования (в среднем от 10-2 до 10-4 моль/л), объединяются в агрегаты (мицеллы). С липидами, белками, каротиноидами и другими нерастворимыми в воде веществами Д. образуют смешанные мицеллы, способствуя тем самым переходу этих веществ в раствор (на этом основано применение Д. в качестве моющих средств) и иногда — изменению их химических свойств.
Желчные кислоты и их соли обладают свойствами Д. и, попадая с желчью в тонкую кишку, взаимодействуют с липидами пищи, делают их водорастворимыми и тем самым доступными для расщепления липолитическими ферментами пищеварительного тракта и способными всасываться в кишечнике. Некоторые ПАВ (например, додецилсульфат натрия) вызывают диссоциацию белковых комплексов. Такие ПАВ способны инактивировать вирусы и бактериальные токсины.
Ряд ПАВ, обладающих сильным бактерицидным действием, применяют для дезинфекции белья в прачечных, стеклянной посуды в учреждениях общественного питания и больницах, мытья и обеззараживания медицинского инструментария. Различные моющие средства,являющиеся Д., получили широкое распространение. Такие ПАВ, как жировое мыло, стиральные порошки типа «Новость», сульфанол и др., используют для дезактивации. Многие Д.
являются хорошими пенообразователями и эмульгаторами, благодаря чему они применяются для приготовления лекарственных эмульсий и мазей (см. Лекарственные формы), косметических препаратов (кремов и т.п.), маргаринов, майонезов и др.
33 Оксикислоты. Яблочнвая, молочная,и лимонная кислоты. Химические свойства,Оксикислоты – производные кислот, которые получаются в результате замещения одного или нескольких атомов водорода в радикале кислоты одной или несколькими гидроксильными (спиртовыми) группами.
В простейших случаях оксикислоты содержат одну карбоксильную и одну гидроксогруппу, тогда их общая формула будет:
Более общая формула оксикислот:
Таким образом, оксикислоты имеют две различные функциональные группы: карбоксильную (кислотную) и гидроксильную (спиртовую) группы.
Соединения, содержащие различные функциональные группы, обычно называются соединениями со смешанными функциями.
В зависимости от наличия одного или нескольких карбоксилов оксикислоты делят на одноосновные (с одним карбоксилом), двухосновные (с двумя карбоксилами), трехосновные (с тремя карбоксилами) и т. д.
По числу спиртовых гидроксилов различают монооксикислоты (с одним гидроксилом), диоксикислоты (с двумя гидроксилами) и т. д.
В большинстве случаев оксикислоты обозначают эмпирическими наименованиями – по нахождению в том или ином продукте и т.д.
Например, одноосновная кислота с тремя атомами углерода, найденная впервые в молоке, называется молочной кислотой; двухосновная оксикислота с четырьмя атомами углерода, впервые найденная в яблоках – яблочной кислотой, и т. д.
Наряду с этими названиями пользуются и другими, например, прибавляя слово окси- к названию той кислоты, от которой производится данная оксикислота путем замещения водорода на гидроксил. Так, молочной кислоте (с тремя атомами углерода) соответствует пропионовая СН3–СН2–СООН, и поэтому молочную кислоту называют также оксипропионовой кислотой, а яблочную – оксиянтарной кислотой. Место гидроксильной группы оксикислоты обозначают обычно греческой буквой, начиная обозначения атомов в углеродной цепи в порядке греческого алфавита от того атома углерода, который непосредственно связан с карбоксильной группой. Поэтому более точное название молочной кислоты – с обозначением места гидроксила – α-оксипропио-новая кислота (альфа-оксипропионовая кислота):
Согласно международной номенклатуре, названия оксикислот производят от названий соответствующих кислот, прибавляя приставку окси- и указывая положение углеродного атома, у которого стоит спиртовая группа. Например, молочная кислота по международной номенклатуре называется 2-оксипропановой.
Молочная кислота (соли лактаты) CH3CH(OH)COOH. Широко распространена в природе, является продуктом молочнокислого брожения углеводов. Содержит асимметрический атом углерода и существует в виде двух энантиомеров. В природе встречаются оба энантиомера молочной кислоты. При молочнокислом брожении образуется рацемическая D,L-молочная кислота. D-молочная (мясо-молочная) кислота образуется при восстановлении пировиногралной кислоты под действием кофермента НАД Н и накапливается в мышцах при интенсивной работе.
Дата добавления: 2015-10-19; просмотров: 3383 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
Источник
