Какие продукты образуются при каталитическом окислении аммиака

Одним из важнейших соединений азота является аммиак. По физическим свойствам это — бесцветный газ с резким, удушающим запахом (это запах водного раствора гидроксида аммония NH₃·H₂O). Газ хорошо растворяется в воде. В водном растворе аммоний является слабым основанием. Является одним из важнейших продуктов химической промышленности.
NH₃ — хороший редуктор, как в молекуле аммония, азот имеет самую низкую степень окисления -3. Многие характеристики аммиака определяются парой одиночных электронов в атоме азота – реакции присоединения с аммиаком происходят из-за его присутствия (эта пара одиночек расположена на свободной орбите Протона H⁺).
Как получить аммиак

Существуют два основных практических метода получения аммиака: один в лаборатории, другой — в промышленности.
Рассмотрим получение аммиака в промышленности. Взаимодействие молекулярного азота и водорода: N₂ + 2H₂ = 2NH₃ (обратимая реакция). Этот метод получения аммиака называется реакцией Хабера. Для молекулярного азота и водорода, которые должны прореагировать, их необходимо нагреть к 500 ᵒC или 932 ᵒF, давлению MPA 25-30 необходимо создаться. Пористый утюг должен присутствовать как катализатор.
Получение в лаборатории – это реакция между хлоридом аммония и гидроксидом кальция: СА(OH)₂ + 2NH₄Cl = CaCl₂ + 2NH₄OH (как NH₄OH — очень слабое соединение, оно сразу же распадается на газообразный аммиак и воду: NH₄OH = NH₃ + H₂O).
Реакция окисления аммиака
Они протекают с изменением состояния окисления азота. Так как аммиак — хороший редуктор, его можно использовать для уменьшения тяжелых металлов от их окисей.
Уменьшение металлов: 2NH₃ + 3CuO = 3Cu + N₂ + 3H₂O (когда меди (II) оксид нагревают в присутствии аммиака, металлическая медь красного цвета уменьшается).
Окисление аммиака в присутствии сильных окислителей (например, галогенов) происходит по уравнению: 2NH₃ + 3Cl₂ = N₂ + 6HCl (для проведения этой окислительно-восстановительной реакции требуется нагрев). При воздействии перманганата калия на аммиак в щелочной среде наблюдается образование молекулярного азота, марганцовокислого калия и воды: 2NH₃ + 6KMnO₄+ 6KOH = 6K₂MnO₄+ N₂ + 6H₂O.
При интенсивном нагревании (до 1200 ° C или 2192 ᵒF) аммиак может распадаться на простые вещества: 2NH₃ = N₂ + 3H₂. На 1000 oC или 1832 аммиак реагирует с метаном CH4:2CH₄ + 2NH₃ + 3O₂ = 2HCN + 6H₂O (синильной кислоты и воды). Путем оксидации аммиака с гипохлоритом натрия гидразин Н₂Х₄ можно получить: 2NH + NaOCl = N2H4 + NaCl + H2O
Сжигание аммиака и его каталитическое окисление кислородом

Окисление аммиака кислородом имеет определенные особенности. Существует два различных типа окисления: каталитический (с катализатором), быстрый (горение).
При горении происходит окислительно-восстановительная реакция, продуктами которой являются молекулярный азот и вода: 4NH3 + 2O2 = 2N2 + 6H2O (пламя желто-зеленое, горение начинается при 651 или 103,8 градусов по Фаренгейту, так как это температура самовоспламенения аммиака). Каталитическое окисление кислорода также происходит при нагревании (около 800 ᵒC или 1472 ᵒF), но один из продуктов реакции отличается: 4NH₃ + 5O₂ = 4NO + 6H₂O (в присутствии платины или оксидов железа, марганца, хрома или кобальта в качестве катализатора продуктами окисления являются оксид азота (II) и вода).
Рассмотрим однородное окисление аммиака кислородом. Бесконтрольная однотипная оксидация участка газа аммиака — относительно медленная реакция. О ней не сообщается подробно, но нижний предел воспламеняемости аммиачно-воздушных смесей при 25 оС составляет около 15 % в интервале давлений 1-10 бар и уменьшается по мере повышения начальной температуры газовой смеси.
Если CNH~ — это молевая доля NH3 в смеси воздух-аммиак с температурой tmixed (OC), то из данных CNH = 0.15-0 следует, что предел воспламеняемости низкий. Поэтому разумно работать с достаточным запасом прочности ниже нижнего предела воспламеняемости, как правило, данные о смешивании аммиака с воздухом часто далеки от совершенства.

Химические свойства
Рассмотрим контактное окисление аммиака до оксида азота. Типичные химические реакции с аммиаком без изменения степени окисления азота:
- Реакция с водой: NH₃ + H₂O = NH₄OH = NH₄⁺ + он⁻ (реакция обратима, так как гидроксид аммония NH₄OH — это нестойкое соединение).
- Реакция с кислотами с образованием нормальных и кислых солей: NH₃ + HCl = NH₄Cl (нормальный хлорид аммония соли сформирован);NH₃ + H₂SO₄ = NH₄HSO₄ (в реакции аммиака с холодной концентрированной серной кислотой образуется кислотная соль гидросульфат аммония); 2NH₃ + H₂SO₄ = (NH₄)₂SO₄.
- Реакции с солями тяжелых металлов с образованием комплексов: 2NH₃ + AgCl = [Ag(NH₃)₂]Cl (сложные соединения серебра (I) хлоридные формы диамина).
- Реакция с haloalkanes: NH3 + CH3Cl = [CH3NH3]Cl (формы гидрохлорида метиламмония – это замещенный ион аммония NH4=).
- Реакция со щелочными металлами: 2NH₃ + 2K = 2KNH₂ + H₂ (образуется амид калия KNH₂; азот не изменяет состояние окисления, хотя реакция окислительно-восстановительная). Реакции присоединения происходят в большинстве случаев без изменения состояния окисления (все вышеперечисленные, кроме последней, классифицируются данным типом).

Заключение
Аммиак — популярное вещество, которое активно используется в промышленности. На сегодняшний день она занимает особое место в нашей жизни, так как большинство продуктов ее деятельности мы используем каждый день. Эта статья будет полезна для прочтения многим, кто захочет узнать о том, что нас окружает.
Окисление аммиака и его свойства — все о путешествиях на News4Auto.ru
Поделитесь ссылкой и ваши друзья узнают, что вы знаете ответы на все вопросы. Спасибо ツ
Источник
4NH3 + 5O2 = 4NO + 6H2O +Q (3.1)
4NH3 + 3O2 = 2N2 + 6H2O +Q (3.2)
4NH3 + 4O2 = 2N2O + 6H2O +Q (3.3)
Кроме реакций (1-3) в контактном аппарате возможно протекание других побочных реакций, снижающих селективность процесса. Так, например, при повышении времени контактирования больше оптимального, возможна термическая диссоциация аммиака:
2NH3 N2 + 3H2 – Q (3.4)
При повышении линейной скорости аммиачно-воздушной смеси, низкой температуре, отравлении катализатора происходит проскок аммиака, что приводит к образованию элементарного азота:
4NH3 + 6NO = 5N2 + 6H2O +Q (3.5)
Таким образом, процесс окисления аммиака до оксида азота (II) является сложным, т.к. наряду с целевым получаются побочные продукты.
О равновесном состоянии основной реакции (1) можно судить по величине константы равновесия, которая при температуре 9000С равна 1053. Известно, что для обратимых реакций константы равновесия имеют значения в пределах 10-2 – 102. Наиболее вероятные побочные реакции 2-3 также имеют значения констант равновесия намного превышающие величину 102. Поэтому процесс окисления аммиака до оксида азота (II) – необратимый.
Энергетическая характеристика: процесс окисления аммиака до оксида азота (II) имеет отрицательный тепловой эффект, идет с выделением теплоты, т.е. является экзотермическим.
Выбор оптимальных условий проведения процесса.
Катализатор.
Реакция (11.1) в объеме не идет даже при высоких температурах из-за большой величины энергии активации. Для реализации этой реакции необходимы катализаторы, активно адсорбирующие кислород. В промышленности чаще всего применяют платиново-родиевые катализаторы. Окисление аммиака на этих катализаторах протекает очень быстро, время контактирования – 10-4 сек, выход при этом составляет 98%.
Неплатиновые катализаторы, состоящие из оксидов железа и хрома, также дают высокие выходы (около 96%), но скорость реакции уменьшается в 100 раз.
Таким образом, процесс окисления аммиака до оксида азота (II) является гетерогенно-каталитическим, идет во внешнедиффузионной области. Лимитирующая стадия – диффузия аммиака к поверхности катализатора.
Помимо активности, катализатор должен обладать селективностью, так как состав конечных продуктов будет определяться соотношением скоростей реакций 3.1 – 3.3.
Температура.
На платиновом катализаторе зависимость выхода NO от температуры имеет максимум, рис. 3.1.
Рис. 3.1. Зависимость практического выхода оксида азота (II) от темепартуры:
1 –при давлении 0,1 МПа, 2 –п 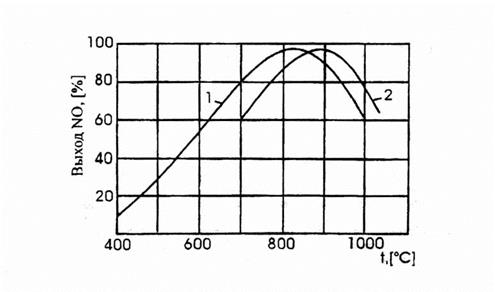
ри давлении 0,8 МПа.
Такой характер кривой определяется влиянием температуры на возможность протекания побочных реакций.
При низких температурах, примерно до 5000С, когда количество адсорбированного кислорода сравнительно невелико, окисление аммиака протекает в основном с образованием элементарного азота. С повышением температуры до 700-8000С выход NO возрастает, так как увеличивается доля активных центров катализатора, занятых кислородом, и растет скорость диффузии исходных веществ к поверхности катализатора. При дальнейшем повышении температуры происходит десорбция кислорода и резко возрастают скорости побочных реакций.
Давление.
Давление в процессе окисления аммиака связано с температурой. Чем выше давление, тем требуется более высокая температура для достижения одного и того же выхода (рис.11.1.).
Проведение процесса под давлением имеет ряд преимуществ: повышается скорость процесса, увеличивается интенсивность катализатора, значительно возрастает скорость реакции:
NO +0,5O2 =NO2 (3.6.),
которая является лимитирующей в производстве азотной кислоты.
В промышленности процесс окисления аммиака до оксида азота (II) проводят при давлении – 0,8 МПа.
4. Соотношение исходных компонентов.
При стехиометрическом соотношении кислорода к аммиаку равном 1,25 в смеси будет содержаться 14,4 об.% аммиака, что соответствует области взрывоопасных концентраций. Кроме этого, при таком соотношении часть активных центров катализатора не заполняется кислородом, что будет способствовать протеканию побочных реакций с образованием элементарного азота.
Источник
В отсутствие катализатора наиболее быстро протекает реакция (3.3) –окисление аммиака до свободного азота.
Для ускорения реакции (3.1) – окисление аммиака до NO – необходим катализатор. Поскольку при окислении аммиака протекают три реакции (3.1; 3.2; 3.3), а целевой является реакция (3.1), то важнейшим условием является выбор катализатора, отличающегося высокой селективностью.
Катализаторы, избирательно ускоряющие реакцию (3.1) можно разделить на два вида:
- платина и её сплавы с металлами платиновой группы (родием и палладием).
- оксиды железа, никеля и кобальта.
В азотнокислотной промышленности применяют в основном платиновые катализаторы. Окисление аммиака на платиновом катализаторе относится к числу наиболее быстрых каталитических реакций. В производственных условиях практически полное окисление аммиака в NO достигается за время (1–2)·10–4 секунды (0,0001 – 0,0002 с).
Время контактирования. Можно и нужно ли изменять время пребывания реагентов на контактной массе? Время изменять нецелесообразно, так как при уменьшении длительности контакта часть аммиака «проскакивает», не успевая окислиться, а при увеличении времени контактирования реакционная смесь перегревается, возрастает вклад реакции (3.3) с образованием свободного азота.
В промышленности для окисления аммиака применяют из первой группы платиновые катализаторы. Это сплав платины Pt с палладием Pd (4 %) и родием Rh (3%). (Введение до 7,5% родия Rh повышает механическую прочность катализатора и вследствие этого уменьшаются потери платины за счёт уноса газом).
Платиновые катализаторы выполняются в виде сеток из тонкой проволоки диаметром 0,06 – 0,09 мм, имеющих 1024 отверстий в 1см2. Сетки скрепляются в виде пакета, устанавливаемого в контактном аппарате.
На 1м2 активной поверхности контактной сетки под атмосферным давлением (0,1 МПа) можно окислить до 600 кг аммиака, а при давлении 0,8 МПа – до 3000 кг аммиака в сутки.
Однако при работе под давлением 0,8 МПа и более платиновый катализатор разрушается быстрее.
Разрушению катализатора способствуют также многие контактные яды (соединения серы, фосфин и другие), которые помимо отравления катализатора снижают его механическую прочность. Примеси (пыль, ржавчина, смазочные масла), содержащиеся в газе, также снижают активность и прочность катализатора.
Для восстановления катализатора его промывают разбавленным раствором соляной кислоты.
Всё перечисленное приводит к тому, что в процессе окисления аммиака катализатор становится рыхлым, и мельчайшие частицы его уносятся с потоком газа. Если под атмосферным давлением унос платины на 1т азотной кислоты составляет 0,04 – 0,06 г, то при повышенном он достигает уже 0,15 – 0,20 г на 1т.
Часть платины улавливается и регенерируется, НО и при этом расход платины составляет значительную часть себестоимости азотной кислоты.
С целью экономии платины в промышленности применяют двухстадийное контактирование, при котором аммиак частично окисляется на платиноидных сетках, а затем доокисляется в слое неплатинового зернистого катализатора.
В качестве неплатиновых катализаторов применяют различные композиции оксидов или солей, в том числе оксиды железа или хрома, соли хрома.
Удельная производительность платинового катализатора велика благодаря высокой скорости реакции окисления аммиака. Для платинового катализатора скорость всего процесса окисления определяется диффузионными процессами.
В промышленности применяют разные типы контактных аппаратов для окисления аммиака, но все они имеют одинаковый принцип действия.
При повышенном давлении устанавливают до 18 сеток. Но если применять двухстадийное контактирование число платиноидных сеток может быть уменьшено до 1 – 3.
Механизм действия катализатора.
Механизм гетерогенного окисления аммиака состоит из следующих последовательных стадий:
- диффузия молекул NH3 и O2 из газовой фазы к поверхности катализатора;
- активированная адсорбция молекул O2 на поверхности катализатора с образованием промежуточного соединения;
- хемосорбция молекул NH3 с образованием комплекса;
- разложение комплекса с регенерацией катализатора и образованием молекул NO и H2O (или десорбция продуктов реакции);
- диффузия продуктов реакции с поверхности катализатора в газовую фазу.
Определяющей или лимитирующей стадией всего процесса окисления является диффузия O2 к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузной области.
Окисление аммиака на оксидном железном катализаторе идет кинетической области.
Селективность процесса окисления NH3 до NO в присутствии платиновых катализаторов выражается уравнением:
Селективность процесса окисления
и составляет 0,95 – 0,98 долей единицы.
Источник
| Институт тонких химических технологий имени М.В. Ломоносова |
Кафедра общей химической технологии
ОТЧЕТ О ЛАБОРАТОРНОЙ РАБОТЕ
Каталитическое окисление аммиака
Вариант 1.
| Выполнила | __________________ | Бархатова М.Д. ХЕБО-13-17 |
| Проверил | __________________ | д.х.н., профессор Брук Л.Г. |
Москва 2020
В настоящее время практически единственным промышленным способом получения азотной кислоты является контактное окисление аммиака кислородом воздуха в оксид азота (II) (1) с последующим окислением последнего в оксид азота(IV) (2) и поглощением полученных оксидов водой (3):
4NH3 + 5O2 = 4NO + 6H2O (1)
2NO + O2 = 2NO (2)
4NO2 + 2H2O + O2 = 4HNO3 (3)
Окисление аммиака кислородом воздуха до оксида азота (II) является первой стадией процесса получения азотной кислоты (1). Наряду с основной реакцией окисления аммиака до оксида азота (II) происходит окисление аммиака до молекулярного азота и оксида азота(I):
4NH3 + 3O2 = 2N2 + 6H2O (4)
4NH3 + 4O2 = 2N2O + 6H2O (5)
При определенных условиях возможна диссоциация аммиака (6), а также последовательные реакции, приводящие к образованию молекулярного азота (7 и 8):
2NH3 = N2 + 3H2 (6)
2NO = N2 + O2 (7)
4NH3 + 6NO = 5N2 + 6H2O (8)
Таким образом, окисление аммиака − процесс сложный.
Константы равновесия реакций (1, 4, 5) весьма велики (значительно больше 102) и, следовательно, все эти реакции практически необратимы. Реакция диссоциации аммиака (6) в интервале температур от −6 до 500°С обратима, при температурах выше 500°С она почти нацело смещена в сторону продуктов разложения аммиака.
Некаталитическое окисление аммиака в газовой фазе при высоких температурах протекает не с образованием оксида азота (II) (1), а с образованием молекулярного азота (4). Для эффективной реализации реакции (1) необходим селективный катализатор, активно адсорбирующий кислород. В промышленности чаще всего применяют платино-родиевые сплавы (кроме платины до 10% родия, палладия, рутения, осмия и др.) в виде сеток. Окисление аммиака на этом катализаторе протекает очень быстро, при времени контактирования порядка 10-4 с, а выход NO составляет примерно 98% на аммиак. Неплатиновые катализаторы, состоящие из оксидов железа и хрома, дают выход оксида азота (II) около 96%, но скорость реакции примерно в 100 раз меньше, чем на платиновых сетках. В промышленности часто используют комбинированный катализ с окислением вначале на платиновых сетках, а потом – на оксидном катализаторе.
Окисление аммиака на платиновом катализаторе протекает в несколько стадий:
1) диффузия реагирующих веществ из газового объема к поверхности катализатора;
2) активированная адсорбция кислорода на активных центрах катализатора с образованием поверхностного комплекса (катализатор-кислород), из которого затем образуется новый комплекс (катализатор – кислород – аммиак);
3) стадии превращения последнего комплекса с образованием оксида азота (II) и воды;
4) десорбция продуктов реакции с поверхности катализатора (NO и H2O обладают небольшой адсорбционной способностью при температурах процесса и легко удаляются с поверхности);
5) диффузия продуктов реакции в газовый объем.
Наблюдаемая скорость каталитического окисления аммиака будет определяться скоростью диффузии того реагента, который находится в недостатке.
Механизм процесса окисления аммиака на поверхности катализатора схематично представлен на рис.1.

Рис.1. Схема окисления аммиака кислородом на поверхности платинового катализатора: 1 – старые связи, 2 – вновь образовавшиеся связи,
3 – место разрыва связей
Степень занятости активных центров катализатора кислородом в значительной степени зависит от температуры и концентрации кислорода в поступающей газовой смеси. Связывание кислорода с поверхностью катализатора в зависимости от температуры может происходить как за счет физической адсорбции, так и за счет хемосорбционных процессов. Физическая адсорбция и хемосорбция − процессы экзотермические, а значит, равновесное содержание сорбированного на катализаторе кислорода уменьшается с повышением температуры (рис.2). Физическая адсорбция даже при низких температурах протекает достаточно быстро и поэтому до значения t1 кривая представляет собой равновесную кривую физической адсорбции газа. При t1 одновременно с физической адсорбцией начинает протекать с небольшой скоростью и хемосорбция. С повышением температуры скорость хемосорбции возрастает, и при температуре t2 количество адсорбированного газа приближается к равновесному.
При дальнейшем повышении температуры происходит разрыв связей между адсорбированным газом и активными центрами катализатора, что приводит к резкому снижению количества адсорбированного вещества. Это снижение обусловлено тем, что наряду с возрастанием константы скорости сорбции с повышением температуры начинает сказываться смещение равновесия в сторону десорбции. Скорость десорбции растет быстрее, чем скорость сорбции вследствие меньшей энергии активации последней. Таким образом, практическая кривая адсорбции имеет минимум и максимум.

Рис.2. Зависимость количества адсорбированного кислорода от
температуры: 1 – равновесная кривая физической адсорбции,
2 и 3 – равновесная и практическая кривые хемосорбции
Выбор оптимальных условий для сложного необратимого каталитического процесса сводится к созданию такого технологического режима, который обеспечивал бы высокую скорость основной реакции.
Температура. На платиновом катализаторе с изменением температуры практический выход оксида азота (II) изменяется по кривой с максимумом (рис.3). Такой характер кривой определяется влиянием температуры на возможность протекания побочных реакций и на их скорость.
При низких температурах, примерно до 500°С, когда количество адсорбированного кислорода сравнительно невелико, окисление аммиака протекает в основном с образованием молекулярного азота (2.1.4), некоторого количества оксида азота (II) и, возможно, оксида азота(I).

Рис.3. Зависимость практического выхода оксида азота (II) от температуры при разных давлениях: 1 – 0,1 МПа, 2 – 0,8 Мпа
С повышением температуры до 700-800°С выход NOвозрастает, так как увеличивается доля активных центров катализатора, занятых кислородом (кривая 3, рис.2) и растет скорость диффузии исходных веществ к поверхности катализатора. При дальнейшем повышении температуры происходит повышение скорости десорбции кислорода, и резко возрастают скорости побочных каталитических реакций и реакций, протекающих в объеме. В результате снижается выход оксида азота (II) и возрастает выход молекулярного азота. При выборе температуры окисления аммиака необходимо учитывать другой фактор, влияющий на экономические показатели процесса – потери дорогостоящей платины, которые возрастают с повышением температуры.
Необходимый температурный режим в реакторе может быть обеспечен теплом, выделяющимся при реакциях окисления аммиака, т.е. окисление аммиака проводят в автотермическом режиме.
Состав исходной смеси. Для обеспечения высокого выхода оксида азота (II) необходимо проводить процесс при избытке кислорода (рис.4). При стехиометрическом отношении кислорода к аммиаку (см. реакцию (1)), равном 1,25, часть активных центров катализатора не заполняется кислородом, что способствует реакциям разложения аммиака, окисления его до N2и, возможно, до N2O. В промышленности при использовании платино-родиевых сеток объемное отношение поддерживается в пределах 1,7 − 1,9.

Рис.4. Зависимость практического выхода оксида азота (II) от объемного отношения кислорода к аммиаку
Повышение отношения кислорода к аммиаку свыше двух не сказывается на выходе оксида азота (II), но приводит к снижению концентрации оксида азота (II) в нитрозных газах за счет введения воздуха, что ухудшает работу абсорбционного отделения, где происходит поглощение нитрозных газов водой с образованием азотной кислоты. При использовании неплатиновых катализаторов отношение кислорода к аммиаку должно быть более двух.
Давление. Процесс окисления аммиака является стадией производства азотной кислоты, включающего еще стадии окисления оксида азота (II) в оксид азота (IV) (9) и абсорбцию последнего водой (10). Проведение всех стадий под небольшим давлением имеет ряд преимуществ: повышается скорость и производительность последующих стадий в производстве азотной кислоты: реакции окисления оксида азота (II) в оксид азота (IV) и абсорбции нитрозных газов водой, уменьшается объём аппаратов.
2NO + O2 = 2NO2 (9)
2NO2 + H2O + 0,5 O2 = 2HNO3(10)
Повышение давления имеет большое значение для работы агрегатов большой единичной мощности. Однако с повышением давления уменьшается скорость внешней диффузии аммиака к поверхности катализатора, которая является лимитирующей, и затрудняется процесс десорбции продуктов каталитического окисления с поверхности катализатора в объём. Для компенсации этого необходимо повышать температуру процесса. Чем выше давление, тем более высокая температура требуется для достижения одного и того же выхода оксида азота (II) (рис.3).
С повышением температуры увеличиваются потери платины. Потери платины из-за летучести образующихся на ее поверхности оксидов и ее эрозии составляют при 900 – 950 ̊С и 0,8 МПа 250 − 400 мг на 1 т 100% HNO3. Часть платины осаждается на стенках коммуникаций и может быть собрана и регенерирована (до 50 – 70%). Потери платины могут быть уменьшены за счет добавок других металлов 8-ой группы (Pd, Rh, Ru).
Время контактирования. Реакция окисления аммиака происходит во внешнедиффузионной области, и поэтому увеличение объемной скорости и уменьшение времени контактирования оказывает положительное влияние на интенсивность процесса (рис.5).

Рис.5. Зависимость практического выхода оксида азота (II) от времени контактирования
Схема лабораторной установки
Схема представлена на рис 6. Газообразный аммиак из баллона 1 через ротаметр 2 поступает в смеситель 3. Ротаметр 2 не калиброван и является лишь индикаторным прибором, регистрирующим заданный расход аммиака (h мм). Расход аммиака регулируется вентилем А. Воздух подается с помощью воздуходувки 4, очищается от масла в фильтре 5, заполненном стеклянной ватой, затем поступает в смеситель 3. Расход воздуха измеряют с помощью калиброванного ротаметра 6 и регулируют вентилем Б. Аммиачно-воздушная смесь поступает в верхнюю часть контактного аппарата 7 и проходит через комбинированный катализатор (четыре платиновых сетки и слой оксидного катализатора). Полученные нитрозные газы по нижней трубке направляют на нейтрализацию.

Рис.6. Схема лабораторной установки для окисления аммиака: 1 – баллон; 2,6 – ротаметры; 3 – смеситель; 4 – воздуходувка; 5 – фильтр; 7 -контактный аппарат: 8 – катализаторная корзина; 9 – термопара; 10 – спираль; 11 – смотровое окно; 12 – колба для отбора пробы газа
Контактный аппарат состоит из трех частей: верхнего стального конуса, футерованного алюминием; средней цилиндрической части и нижнего конуса, изготовленного из хромоникелевой стали. С целью снижения потерь тепла аппарат снаружи покрыт теплоизоляцией. Между фланцами верхнего конуса и цилиндрической частью зажат фланец катализаторной корзины 8 для таблеток неплатинового катализатора. Над корзиной укреплены платиновые сетки. Для измерения температуры в зоне катализатора в качестве датчика используют термопару 9. В верхний конус контактного аппарата вмонтирована платиновая спираль 10, которая разогревается электрическим током от сети через ЛАТР: сила тока контролируется амперметром. Аппарат имеет смотровое стекло 11 для наблюдения за разогреванием катализатора. Трубка с краном В служит для отбора аммиачно-воздушной смеси, поступающей в контактный аппарат, трубка с краном Г − для отбора нитрозных газов. Трубка с краном Д необходима для слива слабой азотной кислоты, образующейся при частичной конденсации влажных нитрозных газов.
Порядок выполнения работы
Подготовка колб для отбора газовых проб
1. Круглодонные колбы с пришлифованными пробками должны быть вымыты. Горловины колб и шлифы очищают от остатков смазки фильтровальной бумагой, наносят на шлиф пробки и горловину вакуумную смазку и тщательно притирают (шлифы после смазки и притирания должны быть совершенно прозрачными).
2. В колбу, предназначенную для анализа аммиачно-воздушной смеси, наливают из бюретки 25 мл 0,1 н раствора серной кислоты и 3 капли индикатора метилового красного. В другую колбу, предназначенную для анализа нитрозных газов, наливают 25 мл 0,1 н раствора гидроксида натрия и добавляют 3 капли того же индикатора. Затем пробки на колбах вновь притирают.
3. Колбы помещают поочередно в защитное устройство из металлической сетки и откачивают воздух вакуумным насосом до момента закипания жидкости. После этого поворачивают пробку так, чтобы отверстие в ней не совпадало с отверстием в горлышке колбы.
4. Взвешивают колбы на электронных весах.
Техника проведения эксперимента
1. Включают воздуходувку 4 и устанавливают вентилем Б заданный расход воздуха.
2. Осторожно поворачивая вентиль А, устанавливают заданный расход аммиака. Во избежание получения взрывчатой смеси содержание аммиака в аммиачно-воздушной смеси не должно превышать 11% объем. (не более 45 дел. (!)).
3. Для начала реакции необходимо разогреть катализатор, для чего включают платиновую спираль 10.
4. При достижении в контактном аппарате температуры 300°С выключают ток, проходящий через спираль. В дальнейшем температура в контактном аппарате будет поддерживаться за счет тепла, выделяющегося при реакции.
После установления постоянной температуры в контактном аппарате (600оС) отбирают пробы аммиачно-воздушной смеси и смеси нитрозных газов. Эта операция выполняется двумя студентами следующим образом:
1. Проводят отдувку нитрозных газов, для чего открывают кран Г и в течение нескольких секунд выпускают газ в выхлопную линию.
2. Присоединяют подготовленную колбу с кислотой к газоотборной трубке с краном В, а со щелочью к газоотборной трубке с краном Г.
3. Открывают краны В и Г.
4. Осторожно поворачивают пробки так, чтобы отверстия на них близко подошли к отросткам на горловинах колб.
5. Одновременно по счету «раз» дополнительным поворотом пробок обеспечивают поступление газа в колбы.
6. Через 3 – 4 с поворачивают пробки в первоначальное положение, прекращая, таким образом, доступ газа в колбы, перекрывают краны В и Г, и отсоединяют колбы.
7. Прекращают подачу аммиака, затем после полного охлаждения контактного аппарата выключают воздуходувку.
8. Определяют концентрации аммиака в аммиачно-воздушной смеси и оксида азота (II) в нитрозных газах. Если нужно провести опыт при других условиях, то изменяют расход воздуха или аммиака и вновь отбирают пробы газовых смесей на анализ после установления постоянной температуры в реакторе.
Исходные данные
Вариант 1.
Расход воздуха при условиях лаборатории – 40 л/мин
Температура в контактном аппарате – 750оС.
Данные о катализаторах:
-платиновый:
число сеток – 1,
рабочая площадь сетки – 40 см2,
число ячеек – 1024 на см2,
диаметр нити 0,09 мм.
-неплатиновый:
объем катализатора – 90 мл,
доля свободного объема – 0,6.
Концентрация аммиака в аммиачно-воздушной смеси – 5,6% масс.
Концентрация оксида азота (II) в нитрозных газах – 9,2% масс.
Температура в лаборатории – 18оС,
барометрическое давление – 750 мм.рт.ст.
Расчётная часть
Выход оксида азота (II) по аммиаку, который в предположении 100 % степени превращения аммиака совпадает с селективностью:
Содержание аммиака и воздуха в аммиачно-воздушной смеси в объемных процентах:
Объёмный расход аммиака:
Расходы аммиака и воздуха, приведённые к нормальным условиям:
Массовые количества введенных веществ:
Количество полученного оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O (1)
Количество оставшегося в газовой смеси кислорода:
4NH3 + 5O2 = 4NO + 6H2O (1)
4NH3 + 3O2 = 2N2 + 6H2O (4)
Количество образовавшегося азота по реакции (4):
Количество реакционной воды:
Таблица 1. Материальный баланс контактного аппарата для окисления аммиака
| ПРИХОД | РАСХОД | ||||||
| Наименование | л, н.у. | г | %масс | Наименование | л, н.у. | г | %масс |
| Аммиак | 3,75 | 2,85 | 5,64 | Оксид азота (II) | 3,50 | 4,68 | 9,26 |
| Воздух | 37,03 | Азот по реакции | 0,13 | 0,16 | 0,32 | ||
| В том числе: Кислород | Азот из воздуха | 29,25 | 36,57 | 72,37 | |||
| 7,78 | 11,11 | 21,99 | Кислород | 3,215 | 4,59 | 9,08 | |
| Азот | 29,25 | 36,57 | 72,37 | Вода | 4,53 | 8,97 | |
| Невязка | 0 | 0 | |||||
| Всего: | 40,78 | 50,53 | 100,00 | Всего | 50,53 | 100,00 | |
Базис – 1 кг NO, коэффициент пересчета = 1000/4,68=213,675
Таблица 2. Материальный баланс контактного аппарата для окисления аммиака (по базису)
| ПРИХОД | РАСХОД | ||||||||||
| Наименование | л, н.у. | г | %масс | Наименование | л, н.у. | г | %масс | ||||
| Аммиак | 801,28 | 608,97 | 5,64 | Оксид азота (II) | 747,86 | 1000,00 | 9,26 | ||||
| Воздух | 7912,38 | Азот по реакции | 27,78 | 34,18 | 0,32 | ||||||
| В том числе: Кислород | Азот из воздуха | 6249,99 | 7814,10 | 72,37 | |||||||
| 1662,39 | 2373,93 | 21,99 | Кислород | 686,97 | 980,77 | 9,08 | |||||
| Азот | 6249,99 | 7814,10 | 72,37 | Вода | 967,95 | 8,97 | |||||
| Невязка | 0 | 0 | |||||||||
| Всего: | 8713,66 | 10797,00 | 100,00 | Всего | 10797,00 | 100,00 | |||||
Время контактирования:
- Для платинового катализатора
- Для неплатинового катализатора:
Объёмное отношение O2 к NH3:
Интенсивность работы катализатора:
- Для платиногового катализатора:
- Для неплатинового катализатора:
Практический выход оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O (1)
Источник
