Какие продукты образуются при хлорировании метана
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^circ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Итак, если смесь метана с хлором нагреть до $200^circ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
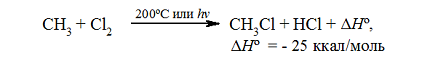
Рисунок 1. Хлорирование метана
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
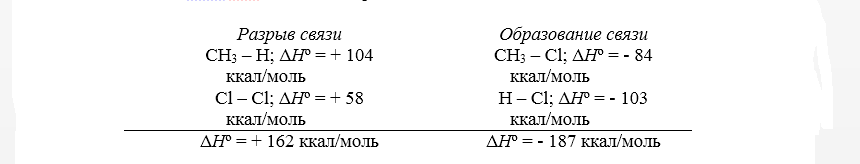
Рисунок 2. Хлорирование метана
Замечание 1
Суммарный тепловой эффект $Delta underline{H}^circ = – 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
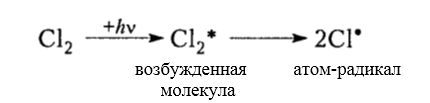
Рисунок 3. Хлорирование метана
рост цепи
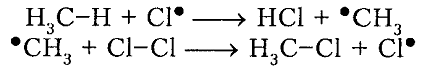
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
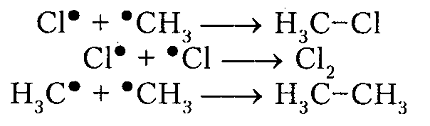
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
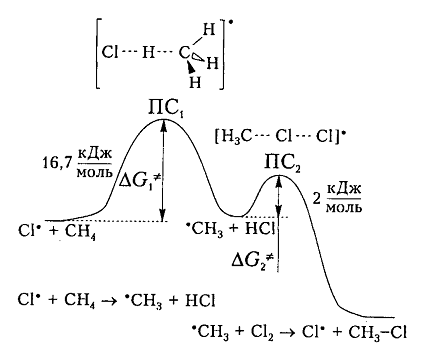
На рис. 6 показана энергетическая диаграмма хлорирования метана.

Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи – связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах – плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
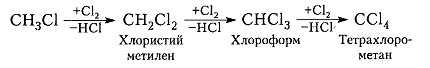
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов (кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
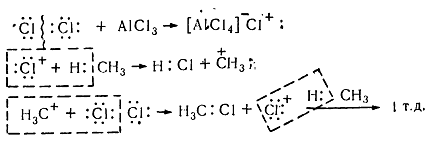
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Источник
Рис.. х-33. Продукты хлорирования метана. [c.553]
Переработка продуктов хлорирования сильно усложняется тем, что оно идет с большим избытком углеводорода. Если целью процесса в первую очередь является получение высших продуктов хлорирования метана, то хлористый метил и хлористый метилен могут быть возвращены в процесс. Если хотят получить хлористый метилен, то на повторное хлорирование возвращают в первую очередь хлористый метил. [c.114]
Прямое хлорирование метана в настоящее время применяют главным образом для производства хлористого метилена, широко используемого в качестве растворителя. При этом процессе неизбежно образуются и другие продукты хлорирования метана. Обычно хлорирование ведут так, чтобы в качестве побочного продукта образовался в основном хлористый метил. [c.206]
Кинетика реакции хлорирования метана и его хлорпроизводных в кипящем слое катализатора — активированного угля при 375°С. Использовав экспериментальное распределение продуктов хлорирования метана и его хлорпроизводных во взвешенном слое катализатора — активированного угля [17]—в совокупности с решением системы дифференциальных З равнений скоростей бимолекулярной последовательной необратимой реакции, протекающей в четыре ступени (8), мы Получаем следующее соотношение между константами скорости рассматриваемой реакции [c.29]
В настоящее время не удалось установить такие условия, которые позволили бы получать только один из продуктов хлорирования метана. Состав продуктов хлорирования в большей степени зависит от соотношения реагентов и температуры, чем от катализаторов. [c.268]
Хлорирование метана протекает с большой скоростью. При температуре 400—450° в зависимости от отношения хлора к метану время контакта составляет 5—10 сек. При изучении кинетики реакции термического хлорирования метана Пиз и Вольц [6] установили, что первым продуктом хлорирования метана является хлористый метил. Скорость хлорирования хлористого метила оказалась выше скорости хлорирования метана. [c.370]
Поток, выходящий из реактора 41 по линии 50, подают в отделение сепарации и выделения 51, рециркулируемые компоненты выделяются и возвращаются в реактор 41 по линии 46. Продукты хлорирования метана выводятся из зоны разделения 51 по линии 52. [c.192]
Реакции хлорирования относятся к числу важнейших проц ессов нефтехимической нромышленности. Парафины и особенно олефины легко реагируют с хлором, давая в результате продукты, являюш иеся важнейшими промежуточными и конечными продуктами современной промышленности алифатической химии. Значение продуктов хлорирования метана, этана, этилена, нропена, пентана, а также высокомолекулярных парафиновых углеводородов, получаемых из парафинистых нефтяных фракций или синтезом Фишера-Тропша, в настояш ее время очень велико. [c.112]
Рассмотрим кинетику процесса хлорирования метана и его хлорпроизводных в кипящем слое катализатора—-кварцевого песка при температуре 350 С. Использование распределения продуктов хлорирования метана в кварцевом песке дает такое соотноше-ние между константами скоростей рассматриваемой реакции ki k2 ki = I , 4 0,8 0,5. [c.26]
Таким образом, константа скорости второй реакции образования метиленхлорида почти в 1,,5 раза больше константы скорости реакции образования хлористого метила, а константа скорости образования хлороформа составляет 0,57 константы скорости второй реакции. Константа скорости образования четыреххлористого углерода, в свою очередь, составляет 0,625 константы скорости третьей реакции образования хлороформа. С помощью этих данных мы получаем аналитическое выражение для распределения продуктов хлорирования метана и его хлорпроизвод-ных в кипящем слое катализатора — кварцевого песка [c.27]
Аналитическое выражение распределения продуктов хлорирования метана в зависимости от времени пребывания и степени превращения в реакторе объемного хлорирования имеет вид [c.32]
Продукт хлорирования метана [c.454]
Охлажденные в холодильниках продукты хлорирования метана подвергают осушке сначала в системе прямоточных циклонов 6 от них отделяют капли воды, а затем в абсорберах типа трубы Вентури 7 обрабатывают концентрированным раствором серной кислоты. [c.19]
Промышленный способ хлорирования метана, как он был применен впервые Хохстер Фарбеверкен, состоит в том, что метан и хлор в соотношении 5 1 смешиваются и подаются в стальную, облицованную бетоном трубу, обогреваемую газом [7] (рис. 57). При этом образуются одновременно все продукты хлорирования метана и от молярного соотношения зависит, какие продукты хлорирования будут преобладать. Образование отдельных продуктов хлорирования метана в зависимости от молярного соотношения хлора к метану представлено данными табл. 59. [c.114]
Хлорнроизводпые метана. Продукты хлорирования метана являются прежде всего растворителями. Хлористый метил часто применяется так жо, как метилирующий агент (метилцеллюлоза и др.). На рис. 61 показаны возможные направления псиользовапия хлористого метила. [c.118]
В настоящее время, если ограничиться лишь немногими примерами, продукты хлорирования метана играют важную роль в качестве растворителей, хлористый этил — как исходный продукт для производства тетраэтилсвинца, 1,3-дихлорпропан — для производства циклопропана, применяемого как анестезирующее вещество, и хлористый амил — в качестве исходного продукта для производства амилового спирта и амилфенолов последние находят широкое применение в лакокрасочной промышленности. [c.136]
Четыреххлористый углерод можно получить и из метана путем его хлорирования или из хлорированных метанов, образующихся при хлорировании метана. Первая промышленная установка для хлорирования метана, пущенная в 1923 г. фирмой Farbwerke Hoe hst, давала четыреххлористый углерод наряду с метилхлоридом, метилен-хлоридом (главным продуктом) и хлороформом в различных соотношениях. Чтобы добиться полного хлорирования до четыреххлористого углерода, хлораторы соединили каскадом, а хлор и продукты хлорирования метана направили противотоком. [c.203]
Составьге схему взаимодействия хлора с метаном. Объясните механизм (Зг,) этой реакции. Где используются продукты хлорирования метана [c.14]
Хлорирование метана протекает обычно с образованием всех его хлорпроизводных — хлористого метила, метиленхлорида, хлороформа и четыреххлористого углерода. Регулируя отношение хлора к метану, можно обеспечить преимущественное получение одного из продуктов хлорирования метана, как это показано на рис. 1.1, построенном автором по литературным данным [41, 42] значение тепла реакции в соответствии с составом метанхлоридов, образующихся при хлорировании 1 моля метана, нанесено на график по расчетным данным автора. Получению метанхлоридов хлорированием метана посвящено значительное количество работ и патентов, рассмотренных Эллисом [43], Сукневичем [44], Солодарем [24]. [c.370]
На рис. 1Х-13 приведена схема такой комплексной локальной установки для очистки сточных вод производства хлорме-танов, осуществленная на одном из предприятий хлорной промышленности. Сточные воды, содержап1ие смесь хлороформа, метилепхлорида, четыреххлористого углерода и других продуктов хлорирования метана (700—1400 г/м в пересчете на органический хлор) предварительно подаются в двухсекционный отстойник 1 для осаждения взвешенных веществ. Из отстойника сточная вода направляется на двухслойный фильтр 2, загруженный песком и антрацитовой крошкой (или гранулами активного угля АГ-3). Осветленная вода, прошедшая фильтры, направляется через теплообменник 3 в отпарную колонку 4, заполненную кольцами Рашига. В теплообменнике сточная вода нагревается за счет тепла, отдаваемого водой, выходящей нз отпарной колонны. Кубовая жидкость в отпарнон колонне нагревается до 95°С паром, который подается в кипятильник 5. [c.269]
Большое значение приобрело производство хлорсодержащих полимерных продуктов, в частности поливинилхлоридных смол и хлоропренового каучука, а также хлорсодержащих растворителей (дихлорэтана, перхлоруглеродов, трихлорэтилена и продуктов хлорирования метана — четыреххлористого углерода, хлороформА, хлористого метилена и хлористого метила). Значительная масса хлора расходуется на получение хлорпроизводных бензола, многочислен-JiHx средств защиты растений от вредителей и болезней и других хлорпродуктов. [c.9]
Хлориды углеводородов широко используются в народном хозяйстве. Продукты хлорирования метана являются прежде всего растворителями. Кроме того, хлористый метил часто применяется в качестве метилирующего агента при производстве ме-тилцеллюлозы. Хлористый метил -используется как хладагент для холодильных машин и растворитель при получении бутил-каучука. [c.251]
Имеется ряд работ [15—17], в которых в результате экспериментальных разработок получены кривые распределения продуктов реакции. В некоторых работах ([16—17]) дается довольно сложный метод определения констант скоростей выде Ляется предпоследний продукт хлорирования метана — хлороформ, затем при хлорировании последнего находится константа скорости этой уже простой реакции. [c.26]
При получении хлороформа как целевого продукта хлорирование метана широкого применения не имеет. Это связано с трудностями регулирования высокоэкзотермического процесса и отвода тепла. Новые процессы получения высших хлоридов метана разрабатываются на основе фотохимического хлорирования метиленхлорида [c.366]
Отдельные представители. Наибольшее значение имеют в технике продукты хлорирования метана и этана, а также фторхлориды. [c.103]
Галогенирование. Из галогенов наиболее широко используется хлор вследствие дешевизны и достаточной химической активности. При взаимодействии метана с хлором на свету атомы водорода постепенно замещаются хлором. Как было установлено экспериментальными исследованиями, реакция протекает по радикальному цепному механизму. Молекулярный хлор под влиянием света расщепляется на атомный, который иницирует (начинает) радикальную реакцию он отщепляет водород от метана, образуя радикал метил и хлористый водород. Метильный радикал взаимодействует с молекулярным хлором и стабилизируется в первый продукт хлорирования метана — хлористый метил, который по аналогичной схеме подвергается дальнейшему хлорированию, образуя последовательно хлористый метилен, хлоро рм и тетрахлорметан (четыреххлористый углерод) [c.41]
Наибольшее значение имеют в технике продукты хлорирования метана и этана, а также фторхлориды. [c.114]
Источник
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Строение алканов
Гомологический ряд
Получение алканов
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
![]() Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н

Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
![]()
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н

2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
![]()
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
![]()
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана.
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
![]()
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:![]()
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.

Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
![]()
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
![]()
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.

Источник
