Какие особенности воды обеспечивают ей свойство растворителя

Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
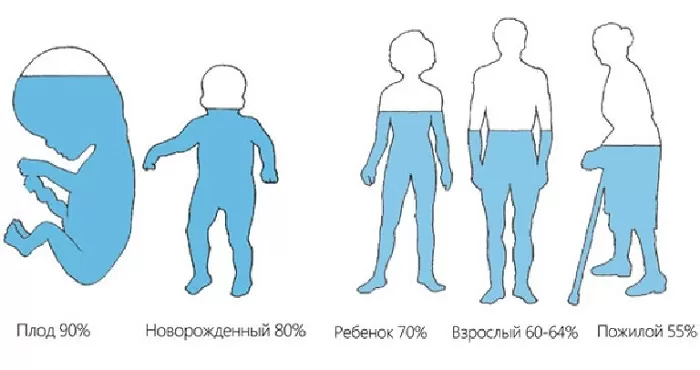
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.

Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.

Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.

В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.

Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Источник
А. Структурные свойства воды как растворителя [c.106]
Вода растворяет большинство комплексных соединений, и понятно, что в большинстве кинетических исследований комплексов в качестве растворителя использовали воду. Однако интерпретация полученных при этом кинетических данных усложнена из-за особых свойств воды как растворителя. Эти свойства по своей природе могут быть или структурными, или кинетическими. [c.106]
Кислотные свойства в наибольшей степени выражены у оксидов хлора, так как разность электроотрицательностей хлора и кислорода наименьшая (разд. 35.2.1). В соответствии с общими закономерностями С /) дает наиболее сильную кислоту (табл. В.26). Следует учитывать также свойства воды как растворителя. В таблице В.26 указаны продукты, образующиеся при взаимодействии оксидов галогенов с водой. Свойство оксидов, а следовательно, и кислородных кислот образовывать соединения полимерного типа в соответствии с общими правилами (разд. 35.2.1) наиболее типично для иода. Перечень извест- [c.503]
СВОЙСТВА ВОДЫ КАК РАСТВОРИТЕЛЯ [c.11]
Если растворенные газы не вступают в химические реакции с содержащимися в воде солями, то последние влияют на растворимость газов чисто физически, изменяя свойства воды как растворители (эффект Сеченова). Этот эффект приводит в большинстве случаев к уменьшению растворимости (высаливание) и редко к увеличению растворимости (всаливание). [c.129]
Ниже приведены физико-химические свойства воды как растворителя [c.223]
Объясните, почему свойства воды как растворителя обычно ухудшаются при понижении температуры от 90 до 35°С. [c.74]
Все это многообразие влияния органических веществ на белковые молекулы определяется, в основном, тремя факторами концентрацией органических молекул, длиной цепи их неполярной части и природой гидрофильной группы, причем осуществляться это действие может как путем непосредственного связывания (взаимодействия) дифильных молекул с молекулами белка, так и в результате изменения свойств воды как растворителя в присутствии органических молекул. При низких концентрациях органического вещества, когда его влияние на структуру воды невелико, преобладает эффект связывания. Связывание в таких условиях не вызывает конформационных изменений белковых молекул (либо [c.28]
Вода – бесспорно, наиболее распространенный в косметике растворитель, причем сильный растворитель, который может растворять соли, кислоты, щелочи, а также большое количество органических веществ. Вода служит основным компонентом в лосьонах для лица, в косметическом молочке и легких кремах, а также во многих шампунях. Во всех этих косметических средствах в воде растворены всевозможные вещества. Если то или иное вещество не растворяется в ней в достаточной степени, то свойства воды как растворителя можно улучшить, добавив в нее небольшие количества обычного спирта или глицерина. [c.124]
В связи с особыми физико-химическими свойствами воды как растворителя было интересно исследовать кинетику окислительно-восстановительной реакции в замороженных водных растворах. Тетраметил-4-оксипиперидин-1-оксил хорошо растворим в воде, гидразобензол в воде не растворяется. Поэтому в качестве второго реагента была выбрана аскорбиновая кислота. [c.209]
Прежде чем обсуждать свойства воды как растворителя, следует коротко рассмотреть теорию кислот и оснований. В химии водных растворов кислотой можно назвать любое вещество, которое является донором ионов водорода, а основанием — вещество, которое служит донором ионов гидроксила. Процесс нейтрализации заключается в образовании молекул растворителя — воды [c.320]
Свойства водно-дисперсных систем и их поведение в тех или иных процессах обусловлено в первую очередь свойствами воды как растворителя. [c.31]
В этот раздел вошли задачи, связанные, помимо традиционно рассматриваемых химических свойств названных соединений, со свойствами воды как растворителя. Сюда относятся задачи на физико-химическую сущность процесса растворения, на реакции гидролиза сложных веществ в водном растворе, разложение некоторых веществ водой. [c.83]
Вода как растворитель. Уникальные свойства воды как растворителя определяются малыми размерами, полярностью ее молекул и наличием у них двух неподеленных электронных пар. Диполи молекул воды активно взаимодействуют с ионами, находящимися в кристаллических решетках ионных кристаллов и с полярными молекулами, образующими молекулярные кристаллы. В тех случаях, когда энергия гидратации ионов или полярных молекул превышает энергии кристаллических решеток, происходит растворение кристаллических веществ в воде (см. гл. 7). [c.256]
Образование некоторыми веществами гомогенных систем в природных водах определяется в основном специфическими свойствами воды как растворителя. Последние обусловлены структурой электронного облака ее молекулы. Особенность воды как полярного растворителя создает условия для возникновения однофазных систем молекулярных и ионных [c.50]
Особенности формирования покрытий из водных растворов пленкообразователей связаны со специфическими свойствами воды как растворителя ее низкой температурой кипения и одновременно низким давлением паров (2,38 кПа при 20 °С), большим поверхностным натяжением (72,7 мДж/м ) и высокой теплотой парообразования (2,47 МДж/кг). Водные краски характеризуются резким нарастанием вязкости по мере испарения воды. Это затрудняет ее диффузию из внутренних слоев и замедляет пленкообразование. Оптимальным является ступенчатый режим формирования таких покрытий удаление большей части воды при температурах до 100 °С и окончательное обезвоживание и отверждение при более высоких температурах. [c.44]
Свойства воды как растворителя [c.48]
Сравнительно полно обсуждены термодинамические свойства предельно разбавленных растворов для систем, в которых растворителем является вода. Для водных систем имеется специальный обзор [101, в котором содержатся сведения об энергиях Гиббса, энтальпиях, теплоемкостях, энтропиях, объемных эффектах растворения большого числа органических соединений в воде. В обзоре специальное внимание уделено специфическим свойствам воды как растворителя, подчеркнуто особенно значительное для водных систем влияние температуры на свойства разбавленных растворов. [c.31]
Изменение свойств воды как растворителя в широком диапазоне параметров, в основном характерных для условий работы теплосиловых установок, связано с изменением ее плотности от 1000 до 0,6 кг/м и температуры от 20 до 600 °С. Это вызывает изменение диэлектрической постоянной воды от 84 до 1,1 Ф/м и изменение степени ассоциации молекул воды от значительной до практически нулевой. [c.116]
Для гидратации белка наибольшее значение имеют пептидные связи, за счет которых притягивается примерно /3 всей гидрата-ционной воды. В общем частицы гидрофильных коллоидов связывают значительные количества воды так, 1 г сухого крахмала при растворении связывает 0,18 г воды, 1 г яичного альбумина (белка) — 0,35 г воды, 1 г карбоксигемоглобина — 0,353 г воды. Связанная полярными группами вода приобретает новые качества, приближающие ее к твердому веществу ее молекулы имеют уплотненное расположение, свойства воды как растворителя понижены, она не замерзает при низких температурах и т. п. В свою очередь, гидратированное вещество также приобретает иные свойства повышается его устойчивость в растворе, уменьшается скорость диффузии и др. Вязкость и скорость образования внутренних структур в этих растворах значительно выше, чем в коллоидных. [c.174]
Уникальные свойства воды как растворителя объясняют сочетанием в ее молекуле трех свойств высокой полярность] водородными связями с растворимыми веществами и донорнь свойствами. Она часто является лигандом в комплексных соеди ниях и кристаллогидратах. [c.32]
Взаимодействие белков с неполярными молекулами обусловлено гидрофобными взаимодействиями, возникновение которых определяется особыми структурными свойствами воды как растворителя. Структура и свойства воды являются в настоящее время предметом многочисленных физико-химических исследований. Современные структурные лтодели воды в основном базируются на классических представлениях Франка и Эванса [25 и Франка и Вэна [26]. Результаты выполненных в последние годы исследований обобщены в ряде обзоров [27—32]. Состояние воды в биологических системах специально рассмотрено в ряде работ [15, 33-36]. [c.8]
Закономерности, подобные приведенным на рис. 1, следует рассматривать не более как вариации второго метода сравнительного расчета М.Х. Ка-рапетьянца применительно к растворимости [46]. Они могут быть с успехом использованы для пpибJшжeннoгo расчета растворимости газов в неполярных и малополярных жидкостях. Однако следует отметить, что даже в этом случае специфические свойства воды как растворителя находят свое отражение. Корреляционный график для НтО явно выпадает из группы прямых для других растворителей, отличаясь от них наклоном и местом, занимаемым на рисунке. [c.110]
Полученные результаты показьшают, что изотопные эффекты гадратации катионов являются не только количественным отражением большей структурированности тяжелой воды за счет упрочнения водородных связей при замене атомов протия на атомы дейтерия. Они свидетельствуют также о наличии у воды развитой трехмерной структуры, определяюшей специфичность свойств воды как растворителя. В качестве подтверждения этого тезиса можно привести данные Кришнана и Фридмана [86] по измерению энтальпийных характеристик изотопных эффектов сольватации ионов в протонированном и дейтерированном метаноле СНзОО. Найдено, что АЯ°н о в метаноле значительно меньше, чем в воде. Эю свидетельствует о качественно иной природе действия ионов на воду по сравнению со спиртами. В частности, делается вьшод, что эффекты разрушения присущи только водным растворам. К этому следует, по-видимому, добавить, что поскольку в метаноле не происходит дестабилизации структуры, то, следовательно, в этом (и, очевидно, подобных ему) растворителе не может иметь место явление отрицательной сольватации (по крайней мере при [c.143]
Укажем на то обстоятельство, что ряд набухания одновалентных анионов в точности повторяет такой же ряд адсорбируемости (стр. 105) и обращенный ряд коагуляции лиофобных золей (стр. 135). Внешне эта закономерность очевидно связана с размерами (радиусом) ионов, а внутренне—со степенью ионной сольватации (гидратации). Недавно автор настоящего руководства показал, что в подобном же закономерном порядке идет воздействие ионов (не только анионов, но и катионов) на объемные] теплоемкостные свойства воды как растворителя. На основании этого им было высказано соображение, по которому влияние лиотропных рядов ионов на все важнейшие свойства гидрофильных дисперсных систем лежит не в воздействии их на вещество дисперсной фазы, а в воздействии на структуру воды—растворителя (в разрыхлении ее одними ионами и в уплотнении другими). [c.185]
Кислотные свойства воды как растворителя [20, 21] обусловлены образованием гидроксониевого катиона Н3О+ (ситуацию упрощают и говорят об образовании иона водорода). Сольватация протонов в воде не завершается ионом Н3О+. Это более сложный процесс так, обнаружен достаточно устойчивый катион Н904 [c.56]
Особенности формирования покрытий из водных растворов определяются свойствами воды как растворителя и структурой водных растворов. Вода характеризуется высоким поверхностным натяжением, способностью гидратировать как низкомолекулярные, так и полимерные соединения, сильной гидролизующей способностью, достаточно выраженной амфотерностью и т. д. [7]. В зависимости от сродства воды к пленкообразо-вателю (т. е. в зависимости от гидрофильности пленкообразователя и его молекулярной массы) их взаимодействие приводит к образованию либо мицеллярных растворов, либо лио-фильных дисперсий. В зависимости от этого вода может быть термодинамически хорошим или плохим растворителем. Для снижения поверхностного натяжения и улучщения термодинамического качества растворителя в водную пленкообразующую систему вводят спирты — низкомолекулярные типа изопропилового и высококипящие, такие как целлозольвы. Введение высококипящего спирта обеспечивает неограниченное смещение в процессе пленкообразоваиия, особенно при термоотверждении, и создает такие условия испарения растворителя, при которых сводится к минимуму изменение конформации и взаимного расположения макромолекул пленкообразователя при прохождении раствором всего концентрационного интервала от исходного состояния до пленкообразователя, свободного от растворителя [7, 164]. [c.102]
Специфические свойства воды как растворителя частично обусловлены влиянием растворенного вещества на структуру растворителя. Выше уже обсуждалась тенденция к образованию айсбергов при введении неполярных веществ в воду, что приводит не только к выделению тепла, но и к большому отрицательному изменению энтропии (раздел А-6). Эти эффекты нередко проявляются в уменьшении растворяющей способности воды с повышением температуры, например при растворении полиметакри-ловой кислоты [131]. Иногда водные растворы полимеров осаждаются при нагревании. Это наблюдалось для сополимеров винилового спирта и ацетатов [132], метилцеллюлозы [133, 134] и других водорастворимых полимеров. Однако растворяющая способность воды не всегда снижается при повып1ении температуры. Например, при исследовании полиакриламида Зильберберг и др. [131] обнаружили, что вода становится термодинамически лучшим растворителем по мере повышения температуры. Во всяком случае следует помнить, что взаимодействие молекул воды с макромолеку-лярным растворенным веществом сильно локализовано на отдельных участках, и поэтому следует ожидать, что параметр взаимодействия между растворителем и растворенным веществом может изменяться в широких пределах в зависимости от состава системы. Приведем наглядный пример найлон имеет чрезвычайно большое сродство к воде при очень малой ее концентрации [135]. Однако растворимость воды в этом полимере довольно ограничена, а растворимость найлона в воде слишком мала, чтобы ее можно было обнаружить. Очевидно, что в таких случаях следует рассматривать отдельно взаимодействие воды с сильно полярными амидными группами и с неполярными участками полимерного растворенного вещества. [c.70]
Вода является рабочим веществом в паровых машинах и турбинах она служит для поднятия давления в нефтеносных пластах, для передачи работы в гидравлических прессах, размыва грунтов и т. д. Особенно велико значение воды в химической, и родственных ей отраслях промышленности. Здесь нет почти ни одного процесса, который пе требовал бы регулирования температурного режима, подвода или отвода тепла. Достаточно вспомнить роль водяного охлаждения в производстве серной и азотной кислот, аммиака при выплавке чугуна, производстве каменноугольного кокса. В производстве широко используются свойства воды как растворителя, для промывания исходных и промежуточных материалов и продуктов. Например, при получении водорода из геиераторгюго или природного газа громадные количества двуокиси углерода удаляются из газовых смесей путем растворения ее в воде. Для разделения сильвинита его обрабатывают водой. [c.103]
Распределение гидрофильных и гидрофобных остатков на поверхности белковой молекулы является признаком, определяющим растворимость белка в различных растворителях. Хотя гидрофобные группы стремятся сконцентрироваться внутри белковой молекулы, значительная их часть располагается на поверхности и контактирует с растворителем (рис. 3.1). Гидрофобным группам на поверхности молекул наряду с заряженными и другими полярными группами принадлежит важная роль в определении поведения белков. Основным компонентом растворителей всегда является вода, хотя есть основания предполагать, что, например, интегральные мембранные белки можно было бы выделять, используя неводные растворители. Для изменения растворимости белка можно манипулировать свойствами воды как растворителя, изменяя ионную силу, pH, количество добавляемых, смешивающихся с 50Д0Й, органических растворителей и других инертных веществ или полимеров, а также комбинируя эти изменения с изменениями- температуры. Чаще всего для селективного осаждения белков используют нейтральные соли. Это и будет предметом обсуждения двух следующих разделов. [c.57]
Участие органического вещества в формировании химического состава подземных вод проявляется а) в образовании различных форм связей с химическими элементами (органокомплексы и элементорганические соединения) б) в микробиологических процессах в) в окис-лительно-восстановительных процессах, протекающих химическим путем г) в изменениях физико-химических свойств воды как растворителя. [c.230]
Источник
