Какие особенности строения и свойств воды

Вода (H2O) — важнейшее неорганическое вещество клетки. В клетке в количественном отношении вода занимает первое место среди других химических соединений. Вода выполняет различные функции: сохранение объёма, упругости клетки, участие во всех химических реакциях. Все биохимические реакции происходят в водных растворах. Чем выше интенсивность обмена веществ в той или иной клетке, тем больше в ней содержится воды.
Обрати внимание!
Вода в клетке находится в двух формах: свободной и связанной.
Свободная вода находится в межклеточных пространствах, сосудах, вакуолях, полостях органов. Она служит для переноса веществ из окружающей среды в клетку и наоборот.
Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами, и соединена с некоторыми белками.
Вода обладает рядом свойств, имеющих исключительное значение для живых организмов.
Структура молекулы воды
Уникальные свойства воды определяются структурой её молекулы.
Между отдельными молекулами воды образуются водородные связи, определяющие физические и химические свойства воды.
Характерное расположение электронов в молекуле воды придаёт ей электрическую асимметрию. Более электроотрицательный атом кислорода притягивает электроны атомов водорода сильнее, в результате молекула воды является диполем (обладает полярностью). Каждый из двух атомов водорода обладает частично положительным зарядом, а атом кислорода несёт частично отрицательный заряд.
Частично отрицательный заряд атома кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул. Таким образом, каждая молекула воды стремится связаться водородной связью с четырьмя соседними молекулами воды.
Свойства воды
Так как молекулы воды полярны, то вода обладает свойством растворять полярные молекулы других веществ.
Вещества, растворимые в воде, называются гидрофильными (соли, сахара, простые спирты, аминокислоты, неорганические кислоты). Когда вещество переходит в раствор, его молекулы или ионы могут двигаться более свободно и, следовательно, реакционная способность вещества возрастает.
Вещества, нерастворимые в воде, называются гидрофобными (жиры, нуклеиновые кислоты, некоторые белки). Такие вещества могут образовывать с водой поверхности раздела, на которых протекают многие химические реакции. Следовательно, тот факт, что вода не растворяет некоторые вещества, для живых организмов также очень важен.
Вода обладает высокой удельной теплоёмкостью, т. е. способностью поглощать тепловую энергию при минимальном повышении собственной температуры. Чтобы разорвать многочисленные водородные связи, имеющиеся между молекулами воды, требуется поглотить большое количество энергии. Это свойство воды обеспечивает поддержание теплового баланса в организме. Большая теплоёмкость воды защищает ткани организма от быстрого и сильного повышения температуры.
Для испарения воды необходима довольно большая энергия. Использование значительного количества энергии на разрыв водородных связей при испарении способствует его охлаждению. Это свойство воды предохраняет организм от перегрева.
Пример:
примерами этого могут являться транспирация у растений и потоотделение у животных.
Вода обладает также высокой теплопроводностью, обеспечивая равномерное распределение тепла по всему организму.
Обрати внимание!
Высокая удельная теплоёмкость и высокая теплопроводность делает воду идеальной жидкостью для поддержания теплового равновесия клетки и организма.
Вода практически не сжимается, создавая тургорное давление, определяя объём и упругость клеток и тканей.
Пример:
гидростатический скелет поддерживает форму у круглых червей, медуз и других организмов.
Благодаря силам сцепления молекул на поверхности воды создаётся плёнка, обладающая такой характеристикой, как поверхностное натяжение.
Пример:
благодаря силе поверхностного натяжения происходит капиллярный кровоток, восходящий и нисходящий токи растворов в растениях.
К числу важных в физиологическом отношении свойств воды относится её способность растворять газы (O2, CO2 и др.).
Вода является также источником кислорода и водорода, выделяемых при фотолизе в световую фазу фотосинтеза.
Биологические функции воды
- Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма. В природе вода переносит продукты жизнедеятельности в почву и к водоёмам.
- Вода — активный участник реакций обмена веществ.
- Вода участвует в образовании смазывающих жидкостей и слизей, секретов и соков в организме (эти жидкости находятся в суставах позвоночных животных, в плевральной полости, в околосердечной сумке).
- Вода входит в состав слизей, которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей. Водную основу имеют и секреты, выделяемые некоторыми железами и органами: слюна, слёзы, желчь, сперма и т. д.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
https://infourok.ru/prezentaciya_po_biologii_na_temu_mineralnye_veschestva_i_voda-409343.htm
https://otvet.mail.ru/question/182353364
https://www.studfiles.ru/html/2706/741/html_fBK8q_mH0r.UWHS/htmlconvd-PYhDG9_html_1c3325a2.png
Источник
Вода – неорганическое вещество, молекулы которого состоят из двух атомов водорода и одного атома кислорода. Количество воды неодинакова в разных организмах. Больше всего воды содержит тело медуз (95-98%), водоросли (более 80%), меньше всего ее у насекомых (40-50%), слоевища лишайников (5-7%). В теле млекопитающих в среднем 75% воды, в том числе у человека – 60-65% массы тела. Количество воды неодинакова и в различных тканях и органах одного и того же организма. Например, у человека содержание воды в тканях и органах таков: кровь (83,0%), почки (82,7%), сердце (79,2%), легкие (79,0%), мышцы (75 6%), мозг (74,8%), кожа (72,0%), скелет (22,0%), жировая ткань (10,0%).
Большая часть воды (70% объема) находится в клетках тела в свободном и связанном виде, меньшая часть (30% объема) – перемещается во внеклеточном пространстве организма и находится в свободном состоянии. Связанная вода (4 5%) бывает осмотически связанной (вода в связях с ионами и низкомолекулярными соединениями), коллоидно связанной (вода в связях как с внутренними, так и с расположенными на поверхности химическими группами высокомолекулярных соединений) и структурно свя связанной (вода в замкнутом пространстве высокомолекулярных биополимеров сложной структуры). Свободная вода (95-96%) является универсальным растворителем.
Значение воды . Количественно вода занимает первое место среди химических соединений любой которой клетки. Наличие воды является обязательным условием жизнедеятельности организмов. Какие же функции выполняет в биосистемах эта самая распространенная на Земле вещество?
• Вода – универсальный растворитель для ионных и многих ковалентных соединений, обеспечивает протекание химических реакций, транспорт веществ в клетку и из клетки.
• Вода – реагент, при участии которого в клетках происходят реакции гидролиза и гидратации, окислительно-восстановительные и кислотно-основные реакции.
• Вода – теплорегулятор, поддерживает оптимальный тепловой режим организмов и обеспечивает равномерное распределение тепла в живых системах.
• Вода – осморегулятора, что обеспечивает форму клеток, транспорт неорганических веществ.
• Вода – опора, обеспечивает упругий состояние клеток (тургор), выступает амортизатором от механических воздействий на организм, выполняет функцию гидроскелет у многих животных.
• Вода – средство транспорта, осуществляет связь в клетках, между клетками, тканями, органами и обеспечивает гомеостаз и функционирование организма как единого целого.
• Вода – среда обитания для водных организмов, в нем осуществляются пассивное движение, внешнее оплодотворение, распространение семян, гамет и личиночных стадий наземных организмов.
• Вода – конформатор, имеет большое значение в организации пространственной структуры (конформации) биополимеров.
Свойства воды. Роль воды в биосистемах определяется ее физико-химическими свойствами.
■ Для чистой воды характерны прозрачность, отсутствие вкуса, цвета, запаха. Природная вода всегда содержит различные примеси: растворенные вещества в виде ионов, нерастворенные вещества – в виде суспензии. Вода – единственное вещество на Земле, которая одновременно и в большом количестве встречается в жидком, твердом и газообразном состояниях.
■ Плотность воды при температуре 4 ° С является максимальной и составляет 1 г / см3. С понижением температуры плотность уменьшается, поэтому лед плавает на поверхности воды.
■ Вода имеет аномально высокие удельную теплоемкость (4,17 Дж / ГК), теплоту испарения (при температуре 100 ° С – 2253 Дж / г), теплоту таяния (при температуре 0 ° С – 333,98 Дж / г).
■ Воде свойственный исключительно большое поверхностное натяжение за счет мощных сил сцепления (когезии), связанных с образованием водородных связей между молекулами.
■ Для воды характерное свойство прилипания (адгезии), которая проявляется в случае поднятия ее против гравитационных сил.
■ Воде в жидком состоянии свойственна текучись, нестискуванисть, чем обусловлены явления осмоса и тургора.
■ Вода обладает амфотерными свойствами, то есть проявляет свойства как кислоты так и основы и участвует в кислотно-основных реакциях.
■ Вода способна выступать и как восстановитель, и как окислитель, осуществляя биологически важные окислительно-восстановительные реакции обмена веществ.
■ Молекулы воды полярны, благодаря чему участвуют в реакциях гидратации, обеспечивая растворения многих химических соединений.
■ Вода участвует в биологически важных реакциях разложения – реакциях гидролиза.
■ Молекулы воды способны диссоциировать на ионы: Н2О = Н + + ОН.
Особенности строения молекул воды. Уникальные свойства воды определяются структурой ее молекул.
В молекуле воды каждый атом водорода содержится у атома кислорода ковалентной связью, энергия которого почти 110 ккал / моль. Благодаря этому вода является очень стойкой химическим соединением. Водяной пар начинает разлагаться на О, и Н, при температуре, выше 1000 ° С.
В молекуле воды две пары электронов из четырех образованные ковалентной связью и смещены к одной из сторон молекулы с формированием двух положительно заряженных полюсов. А две другие пары остаются неразделенными и смещены относительно ядра атома кислорода к противоположной стороне, где образуют два отрицательно заряженные полюса.
Итак, молекулы воды являются полярными.
Благодаря полярности соседние молекулы воды могут взаимодействовать между собой и с молекулами полярных веществ с образованием водородных связей, обуславливающих уникальные физические свойства и биологические функции воды. Энергия этой связи, по сравнению с энергией ковалентной связи, невелика. Она составляет всего 4,5 ккал / моль, и благодаря тепловому движению эти связи между молекулами воды постоянно возникают и разрываются. Водородные связи – это связи между двумя ковалентно связанными атомами с большим значением электроотрицательности ( О, N , F ) посредством атома водорода Н. Обычно водородная связь обозначают тремя точками и этим отмечают , что он намного слабее ; чем ковалентная связь ( примерно в 15-20 раз ).
Водородные связи играют определяющую роль в образовании специфической квази и кристаллической структуры воды. Согласно современным представлениям, основой строения воды является кристаллическая решетка с размытой тепловым движением частью молекул свободной воды. Для воды в твердом состоянии характерные молекулярные кристаллические решетки, поскольку кристаллы строятся из молекул, связанных друг с другом водородными связями. Именно наличием элементов кристаллической решетки, а также дипольнистю молекул воды и обусловлено очень большое значение относительной диэлектрической проницаемости воды.
Молекулы жидкой воды способны к полимеризации или ассоциации с образованием ассоциатов (Н2О) n. Образование плотных ассоциатов происходит +4 С, чем и объясняется большое плотность воды при этой температуре. При нагревании водородные связи разрушаются и ассоциаты начинают расщепляться, поскольку энергия теплового движения становится больше от энергии этих связей. Разрыва связей требует много энергии, откуда и высокие температура кипения и удельная теплоемкость воды. Это имеет существенное значение для организмов во время колебаний температуры среды обитания.
Рентгеноструктурный анализ воды установлено, что и в жидкой воде остаются фрагменты структуры льда. При температуре 20 ° С около 70% молекул находится в воде в виде агрегатов, содержащих в среднем по 57 молекул в каждом. Такие агрегаты называют кластерами. Молекулы воды, входящих в состав кластера, скованные и метаболически инертные. Активная роль в реакциях обмена веществ принадлежит только свободным молекулам воды. Если кластеров много, то это приводит к иммобилизации воды, то есть к исключению свободной воды, ограничения ферментативных процессов и к снижению функциональной активности клетки.
БИОЛОГИЯ + При диссоциации определенных электролитов, в том числе и воды, образуются ионы Н + и ОН – , от концентрации которых зависит кислотность или основность растворов и, соответственно, структурные особенности и активность многих биомолекул и жизненных процессов. Эту концентрацию измеряют с использованием водородного показателя – рН . pH – отрицательный десятинный логарифм концентрации

Образование водородной связи

молекула воды
ионов Н + . В чистой воде эта концентрация составляет 1-10 -7 моль / л ( -log 10 -7 = 7 ) . Поэтому нейтральной реакции воды соответствует pH 7, кислой-pH <7 и основной -pH> 7. Протяженность шкалы pH – от 0 до 14. Значение pH в клетках слабощелочная. Изменение его на одну-две единицы губительна для клетки. Постоянство pH в клетках поддерживается за счет буферных систем, которые содержат смесь электролитов. Они состоят из слабой кислоты ( донора Н +) и сопряженной с ней основы ( акцептора Н +) , которые в соответствии связывают ионы H + и боны ОН – , благодаря чему реакция pH внутри клетки почти не меняется.
Гидрофильные и гидрофобные соединения. В молекул воды две пары совместных электронов смещены к кислорода, поэтому электрический заряд внутри молекул распределен неравномерно: протоны Н + обусловливают положительный заряд на одном полюсе, а пары электронов кислорода – отрицательный заряд на противоположном полюсе. Эти заряды равны по величине и расположены на определенном расстоянии друг от друга. Итак, молекула воды – это постоянный диполь, который может взаимодействовать с носителями положительных и отрицательных зарядов. Наличием полюсов в молекулах воды объясняется способность воды к химическим реакциям гидратации.
Благодаря своей полярности молекулы воды могут присоединяться к молекулам или ионов растворимых в воде веществ с образованием гидратов (соединений воды с растворенным веществом). Эти реакции являются экзотермическими и, в отличие от реакций гидролиза, гидратация не сопровождается образованием водородных или гидроксильных ионов.
При взаимодействии молекул воды с молекулами полярных веществ притяжения молекул воды к розчинюванои вещества превышать энергию притяжения между молекулами воды. Поэтому молекулы или ионы таких соединений встраиваются в общую систему водородных связей воды. Гидрофильные вещества – это полярные вещества, которые способны хорошо растворяться в воде. Это растворимые кристаллические соли, моносахариды, определенные аминокислоты, нулеинови кислоты и др.
В случае взаимодействия молекул воды с молекулами неполярных веществ энергия притяжения молекул воды в них будет меньше, чем энергия водородных связей. Неполярные молекулы пытаются изолироваться от молекул воды, они группируются между собой и вытесняются из водного раствора. Гидрофобные вещества – это неполярные вещества, которые не растворяются в воде. Это нерастворимые минеральные соли, липиды, полисахариды, определенные белки и др. Некоторые органические молекулы имеют двойные свойства: на одних их участках сосредоточены полярные группы, на других – неполярные. Таковы многие белки, фосфолипиды. их называют амфифильных веществами.

Распределение молекул воды вокруг аниона и катиона
Где Карбон, там разнообразие органических веществ, где Карбон, там самые разнообразные по молекулярной архитектурой конструкции.
Энциклопедия юного химика
Источник
Самое важное, уникальное по свойствам и составу вещество нашей планеты – это, конечно, вода. Ведь именно благодаря ей на Земле жизнь есть, в то время как на других известных сегодня объектах Солнечной системы ее нет. Твердая, жидкая, в виде пара – она нужна и важна любая. Вода и ее свойства составляют предмет изучения целой научной дисциплины – гидрологии.
Количество воды на планете
Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75% от общей массы. При этом следует учитывать связанную воду в органических соединениях, живых существах, минералах и прочих элементах.

Если учитывать только жидкое и твердое состояние воды, показатель падет до 70,8%. Рассмотрим, как распределяются эти проценты, где содержится рассматриваемое вещество.
- Соленой воды в океанах и морях, солончаковых озерах на Земле 360 млн км2.
- Пресная вода распределена неравномерно: ее в ледниках Гренландии, Арктики, Антарктиды заковано во льды 16,3 млн км2.
- В пресных реках, болотах и озерах сосредоточено 5,3 млн км2 оксида водорода.
- Подземные воды составляют 100 млн м3.
Именно поэтому космонавтам из далекого космического пространства видно Землю в форме шара голубого цвета с редкими вкраплениями суши. Вода и ее свойства, знание особенностей строения являются важными элементами науки. К тому же, в последнее время человечество начинает испытывать явную нехватку пресной воды. Может быть, такие знания помогут в решении данной проблемы.
Состав воды и строение молекулы
Если рассмотреть эти показатели, то сразу станут понятны и свойства, которые проявляет это удивительное вещество. Так, молекула воды состоит из двух атомов водорода и одного атома кислорода, поэтому имеет эмпирическую формулу Н2О. Кроме того, при построении самой молекулы большую роль играют электроны обоих элементов. Посмотрим, что собой представляют структура воды и ее свойства.
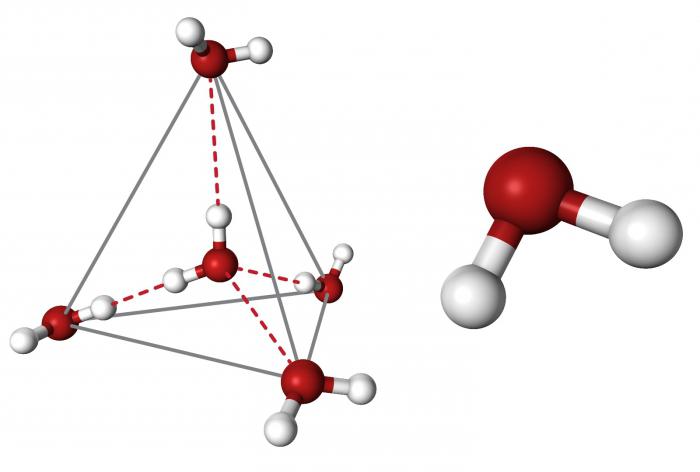
Очевидно, что каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Интересно то, что оксид построен в форме тетраэдра – атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма.
Угол между центром атома кислорода и ядрами водородов составляет 104,5 0С. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды – диполь. Это определяет то, какой может быть вода, и ее физические свойства также зависят от строения молекулы. Для живых существ эти особенности играют жизненно важную роль.
Основные физические свойства
К таковым принято относить кристаллическую решетку, температуры кипения и плавления, особенные индивидуальные характеристики. Все их и рассмотрим.
- Строение кристаллической решетки оксида водорода зависит от агрегатного состояния. Оно может быть твердым – лед, жидким – основная вода при обычных условиях, газообразным – пар при повышении температуры воды свыше 100 0С. Красивые узорные кристаллы формирует лед. Решетка в целом рыхлая, но соединение очень прочное, плотность низкая. Видеть ее можно на примере снежинок или морозных узоров на стеклах. У обычной воды решетка не имеет постоянной формы, она изменяется и переходит из одного состояния в другое.
- Молекула воды в космическом пространстве имеет правильную форму шара. Однако под действием земной силы тяжести она искажается и в жидком состоянии принимает форму сосуда.
- То, что по структуре оксид водорода – диполь, обуславливает следующие свойства: высокая теплопроводность и теплоемкость, которая прослеживается в быстром нагревании и долгом остывании вещества, способность ориентировать вокруг себя как ионы, так и отдельные электроны, соединения. Это делает воду универсальным растворителем (как полярным, так и нейтральным).
- Состав воды и строение молекулы объясняют способность этого соединения образовывать множественные водородные связи, в том числе с другими соединениями, имеющими неподеленные электронные пары (аммиак, спирт и прочие).
- Температура кипения жидкой воды – 1000С, кристаллизация наступает при +40С. Ниже этого показателя – лед. Если же увеличивать давление, то температура кипения воды резко возрастет. Так, при высоких атмосферах в ней можно растопить свинец, но она при этом даже не закипит (свыше 3000С).
- Свойства воды весьма значимы для живых существ. Например, одно из самых важных – поверхностное натяжение. Это формирование тончайшей защитной пленки на поверхности оксида водорода. Речь идет о воде в жидком состоянии. Эту пленку разорвать механическим воздействием очень сложно. Учеными установлено, что понадобится сила, равная весу в 100 тонн. Как ее заметить? Пленка очевидна, когда вода капает из крана медленно. Видно, что она словно в какой-то оболочке, которая растягивается до определенного предела и веса и отрывается в виде круглой капельки, слегка искаженной силой тяжести. Благодаря поверхностному натяжению многие предметы могут находиться на поверхности воды. Насекомые, имеющие особые приспособления, могут свободно передвигаться по ней.
- Вода и ее свойства аномальны и уникальны. По органолептическим показателям данное соединение – бесцветная жидкость без вкуса и запаха. То, что мы называем вкусом воды, – это растворенные в ней минералы и другие компоненты.
- Электропроводность оксида водорода в жидком состоянии зависит от того, сколько и каких солей в нем растворены. Дистиллированная вода, не содержащая никаких примесей, электрический ток не проводит.
Лед – это особое состояние воды. В структуре этого ее состояния молекулы связаны друг с другом водородными связями и формируют красивую кристаллическую решетку. Но она достаточно неустойчива и легко может расколоться, растаять, то есть деформироваться. Между молекулами сохраняется множество пустот, размеры которых превышают размеры самих частиц. Благодаря этому плотность льда меньше, чем жидкого оксида водорода.

Это имеет большое значение для рек, озер и прочих пресных водоемов. Ведь в зимний период вода в них не замерзает полностью, а лишь покрывается плотной коркой более легкого льда, всплывающего наверх. Если бы данное свойство не было характерно для твердого состояния оксида водорода, то водоемы промерзали бы насквозь. Жизнь под водой была бы невозможна.
Кроме того, твердое состояние воды имеет большое значение как источник огромного количества питьевых пресных запасов. Это ледники.
Особенным свойством воды можно назвать явление тройной точки. Это такое состояние, при котором лед, пар и жидкость могут существовать одновременно. Для этого требуются такие условия, как:
- высокое давление – 610 Па;
- температура 0,010С.
Показатель прозрачности воды варьируется в зависимости от посторонних примесей. Жидкость может быть полностью прозрачной, опалесцентной, мутной. Поглощаются волны желтого и красного цветов, глубоко проникают лучи фиолетовые.

Химические свойства
Вода и ее свойства – важный инструмент в понимании многих процессов жизнедеятельности. Поэтому они изучены очень хорошо. Так, гидрохимию интересуют вода и ее химические свойства. Среди них можно назвать следующие:
- Жесткость. Это такое свойство, которое объясняется наличием солей кальция и магния, их ионов в растворе. Подразделяется на постоянную (соли названных металлов: хлоридов, сульфатов, сульфитов, нитратов), временную (гидрокарбонаты), которая устраняется кипячением. В России воду перед использованием смягчают химическим путем для лучшего качества.
- Минерализация. Свойство, основанное на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ, ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
- Окислительно-восстановительные свойства. Как универсальный растворитель, катализатор, ассоциат, вода способна взаимодействовать с множеством простых и сложных соединений. С одними она выступает в роли окислителя, с другими – наоборот. Как восстановитель реагирует с галогенами, солями, некоторыми менее активными металлами, с многими органическими веществами. Последние превращения изучает органическая химия. Вода и ее свойства, в частности, химические, показывают, насколько она универсальна и уникальна. Как окислитель она вступает в реакции с активными металлами, некоторыми бинарными солями, многими органическими соединениями, углеродом, метаном. Вообще химические реакции с участием данного вещества нуждаются в подборе определенных условий. Именно от них и будет зависеть исход реакции.
- Биохимические свойства. Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой.
- Взаимодействие с газами с образованием клатратов. Обычная жидкая вода может поглощать даже неактивные химически газы и располагать их внутри полостей между молекулами внутренней структуры. Такие соединения принято называть клатратами.
- Со многими металлами оксид водорода формирует кристаллогидраты, в которые он включен в неизменном виде. Например, медный купорос (CuSO4*5H2O), а также обычные гидраты (NaOH*H2O и другие).
- Для воды характерны реакции соединения, при которых происходит образование новых классов веществ (кислот, щелочей, оснований). Они не являются окислительно-восстановительными.
- Электролиз. Под действием электрического тока молекула разлагается на составные газы – водород и кислород. Один из способов получения их в лаборатории и промышленности.
С точки зрения теории Льюиса вода – это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоей амфотерности в химических свойствах.

Вода и ее полезные свойства для живых существ
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода – источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.
- Для человека вода – источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.
- Издревле считалось, что вода – это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород – газ, благодаря которому существует жизнь на нашей планете.
Можно назвать еще десятки причин того, почему вода – это самое широко распространенное, важное и необходимое вещество для всех живых и искусственно созданных человеком объектов. Мы привели только самые очевидные, главные.

Гидрологический цикл воды
Иными словами, это ее круговорот в природе. Очень важный процесс, позволяющий постоянно пополнять исчезающие запасы воды. Как он происходит?
Основных участников трое: подземные (или грунтовые) воды, поверхностные воды и Мировой океан. Важна также и атмосфера, конденсирующая и выдающая осадки. Также активными участниками процесса являются растения (в основном деревья), способные поглощать огромное количество воды в сутки.
Итак, процесс происходит следующим образом. Грунтовые воды заполняют подземные капилляры и стекаются к поверхности и Мировому океану. Затем поверхностные воды поглощаются растениями и транспирируются в окружающую среду. Также происходит испарение с огромных площадей океанов, морей, рек, озер и прочих водоемов. Попав в атмосферу, вода что делает? Конденсируется и проливается обратно в виде осадков (дождь, снег, град).
Если бы не происходили эти процессы, то запасы воды, особенно пресной, давно бы уже закончились. Именно поэтому охране и нормальному гидрологическому циклу уделяется людьми большое внимание.
Понятие о тяжелой воде
В природе оксид водорода существует в виде смеси изотопологов. Это связано с тем, что водород формирует три вида изотопа: протий 1Н, дейтерий 2Н, тритий 3Н. Кислород, в свою очередь, также не отстает и образует три устойчивые формы: 16О, 17О, 18О. Именно благодаря этому существует не просто обычная протиевая вода состава Н2О (1Н и 16О), но еще и дейтериевая, и тритиевая.

При этом устойчива по структуре и форме именно дейтериевая (2Н), которая включается в состав практически всех природных вод, но в малом количестве. Именно ее называют тяжелой. Она несколько отличается от обычной или легкой по всем показателям.
Тяжелая вода и ее свойства характеризуются несколькими пунктами.
- Кристаллизуется при температуре 3,82 0С.
- Кипение наблюдается при 101,42 0С.
- Плотность составляет 1,1059 г/см3.
- Как растворитель в несколько раз хуже легкой воды.
- Имеет химическую формулу D2O.
При проведении опытов, показывающих влияние подобной воды на живые системы, было установлено, что жить в ней способны лишь некоторые виды бактерий. Для приспособления и акклиматизации колониям потребовалось время. Но, приспособившись, они полностью восстановили все жизненно важные функции (размножение, питание). Кроме того, стали очень устойчивы к воздействию радиоактивного излучения. Опыты на лягушках и рыбах положительного результата не дали.
Современные области применения дейтерия и образованной им тяжелой воды – атомная и ядерная энергетика. Получить в лабораторных условиях такую воду можно при помощи электролиза обычной – она образуется как побочный продукт. Сам дейтерий формируется при многократных перегонках водорода в специальных устройствах. Применение его основано на способности замедлять нейтронные синтезы и протонные реакции. Именно тяжелая вода и изотопы водорода – основа для создания ядерной и водородной бомбы.
Опыты на применении дейтериевой воды людьми в небольших количествах показали, что задерживается она недолго – полный вывод наблюдается через две недели. Употреблять ее в качестве источника влаги для жизни нельзя, однако техническое значение просто огромно.
Талая вода и ее применение
Свойства такой воды издревле были определены людьми как целебные. Давно было замечено, что при таянии снега животные стараются напиться водой из образовавшихся лужиц. Позже были тщательно исследованы ее структура и биологическое воздействие на организм человека.

Талая вода, ее признаки и свойства находятся посередине между обычной легкой и льдом. Изнутри она образована не просто молекулами, а набором кластеров, сформированных кристаллами и газом. То есть внутри пустот между структурными частями кристалла находятся водород и кислород. По общему виду строение талой воды сходно со строением льда – сохраняется структурность. Физические свойства такого оксида водорода незначительно меняются в сравнении с обычным. Однако биологическое воздействие на организм отличное.
При замораживании воды первой фракцией превращается в лед более тяжелая часть – это дейтериевые изотопы, соли и примеси. Поэтому эту сердцевину следует удалять. А вот остальная часть – чистая, структурированная и полезная вода. Каково воздействие на организм? Учеными Донецкого НИИ были названы следующие виды улучшений:
- Ускорение восстановительных процессов.
- Укрепление иммунитета.
- У детей после ингаляций такой водой происходит восстановление и излечение простудных заболеваний, проходит кашель, насморк и прочее.
- Улучшается дыхание, состояние гортани и слизистых оболочек.
- Общее самочувствие человека, активность повышаются.
Сегодня существует ряд сторонников лечения именно талой водой, которые пишут свои положительные отзывы. Однако есть ученые, в том числе медики, которые эти взгляды не поддерживают. Они считают, что вреда от такой воды не будет, но и пользы мало.
Энергетика
Почему свойства воды могут изменяться и восстанавливаться при переходе в разные агрегатные состояния? Ответ на этот вопрос следующий: у данного соединения существует своя информационная память, которая записывает все изменения и приводит к восстановлению структуры и свойств в нужное время. Биоэнергетическое поле, через которое проходит часть воды (та, что поступает из космоса), несет в себе мощный заряд энергии. Эту закономерность часто используют при лечении. Однако с медицинской точки зрения не каждая вода способна оказать благоприятный эффект, в том числе и информационный.<
