Какие особенности строения атомов металлов определяют их свойства

Положение металлов в периодической системе
В перечне простых веществ, составленном великим французским химиком Лавуазье в 1789 г. присутствует 17 металлов, в первом варианте периодической таблицы Д.И. Менделеева (1869) – их уже 47. Из 114 химических элементов 92 являются металлами. В традиционном варианте Периодической системе элементы-металлы расположены в начале периодов, а также в побочных подгруппах. Условной границей, отделяющей металлы от неметаллов, служит прямая, проведенная от бора до астата в длинном варианте периодической таблицы. Металлы оказываются левее и ниже этой прямой, неметаллы – правее и выше, а элементы, находящиеся вблизи прямой имеют двойственную природу, иногда их называют металлоидами. В Периодической системе, утвержденной ИЮПАК, металлы расположены в 1-12 группах.

ОСОБЕННОСТИ СТРОЕНИЯ МЕТАЛЛОВ
Атомы металлов на внешнем уровне содержат не более четырех электронов, как правило, от одного до трех. Отдавая эти электроны, они приобретают устойчивую оболочку ближайшего инертного газа:

$Ca^0 hspace{10pt}-2bar{e}rightarrow Ca^{+2}$
$overbrace{1s^22s^22p^63s^23p^64s^2}hspace{10pt}-2bar{e}rightarrowoverbrace{1s^22s^22p^63s^2 3p^6}$
Таким образом, металлы в химических реакциях являются восстановителями – они приобретают положительную степень окисления. В этом заключается их принципиальное отличие от элементов-неметаллов.
Определение
Способность атома элемента смещать на себя электроны химической связи называют электроотрицательностью.
Вследствие низких значений электроотрицательности металлы легче отдают электроны, чем притягивают их, и, следовательно проявляют восстановительные свойства.
Слова «металл» и «неметалл» применимы не только к химическим элементам, но и к простым веществам. Например, говоря, что простое вещество является металлом, мы подразумеваем не только что оно состоит из атомов элемента-металла, но и определенную общность физических (металлический блеск, пластичность) и химических (восстановитель) свойств. Металлические свойства простых веществ убывают при движении по периоду слева направо, а по группе – снизу вверх. В наибольшей степени металлические свойства выражены у элементов главной подгруппы I группы Периодической системы – щелочных металлов. Их атомы настолько легко отдают валентный электрон, что в природе эти элементы встречаются исключительно в виде соединений.
Кристаллическая решетка и металлическая связь
Металлы имеют металлическую кристаллическую решетку, в узлах которой расположены отдельные атомы. Они слабо удерживают валентные электроны, которые по этой причине свободно перемещаются по всему объему металла, формируя единое электронное облако и в равной степени притягиваются всеми атомами. Такая связь называется металлической.
Общие свойства металлов – пластичность, способность отражать свет, тепло- и электропроводность – объясняются особенностями их строения. При сильном надавливании кусок металла изменяет форму – часть атомов смещается, но не рассыпается: общее электронное облако прочно удерживает все атомы вместе. В электрическом поле свободные электроны начинают двигаться в определенном направлении, такое упорядоченное движение электронов называют электрическим током.
Чем больше в металле свободных электронов и чем сильнее колебания атомов, находящихся в узлах решетки, тем быстрее происходит выравнивание температуры во всем куске металла, то есть тем больше его теплопроводность. Поэтому относительные значения тепло- и электропроводности для многих металлов близки.
Физические свойства металлов
Агрегатное состояние и температуры плавления. Температуры плавления металлов меняются в очень широких пределах. Самый легкоплавкий из металлов – ртуть – при комнатной температуре является жидкостью. Металл галлий плавится от теплоты человеческого тела. Из металлов широко применяемых в технике, наиболее легкоплавкие – олово и свинец. Наибольшую температуру плавления имеет вольфрам, из которого изготавливают нити накаливания лампочек. Металлы с температурой плавления выше $1000^oC$ принято называть тугоплавкими.



ртуть галлий вольфрам
Окраска. Среди металлов немногие обладают характерной окраской. «Золото через свой изрядно желтый цвет и блещущую светлость от прочих металлов отлично», – писал Михаил Васильевич Ломоносов. Медь имеет розово-красный цвет, серебро и платина – белый, щелочной металл цезий – бледно-желтый. Для описания цвета других металлов трудно подобрать слова. Все они кажутся нам серыми с тем или иным едва заметным оттенком.


медь литий
Плотность. Металлы сильно различаются по плотности. Наиболее легкими являются щелочные металлы литий, натрий и калий. Литий плавает даже на поверхности керосина – жидкости с плотностью меньшей плотности воды. Металлы с плотностью ниже 5 г/см$^3$ называют легкими. К ним, помимо щелочных и щелочно-земельных металлов, принадлежат магний, алюминий и другие. В число наиболее тяжелых входят переходные металлы, расположенные в шестом периоде, а также актиноиды. Ртуть, например, имеет плотность 13,6 г/см$^3$, то есть литровая банка, заполненная ртутью, весит 13,6 кг!
Твердость вещества оценивают по его способности оставлять царапину на другом веществе. Наиболее твердым веществом является алмаз – он оставляет след на любых поверхностях. Из металлов по твердости к алмазу приближается хром – он царапает стекло. Наиболее мягкие металлы – щелочные. Они легко режутся ножом. Мягкими являются также свинец, олово, цинк, серебро.

Электро- и теплопроводность. Все без исключения металлы хорошо проводят электрический ток. Наибольшей электропроводностью обладает серебро, немного уступают ему медь и золото. Серебро – очень дорогой металл. Его используют в электротехнике при изготовлении высокоточных дорогостоящих приборов. Самые хорошие провода, применяемые в быту, медные. Они во много раз превосходят по самим характеристикам провода, изготовленные из алюминия. При прохождении через металл электрического тока часть электрической энергии преобразуется в тепловую – металл нагревается. Использование алюминиевых проводов при больших нагрузках на электрическую сеть может привести к их плавлению. Особенно опасны места стыка алюминиевых и медных проводов – они нагреваются намного быстрее. Неисправная электропроводка является причиной многих пожаров.
Пластичность. Многие металлы пластичны, то есть обладают способностью изменять форму, например, расплющиваться при ударе молотком. Наибольшей пластичностью обладают золото, серебро, медь, олово. Их можно раскатывать в фольгу.



Фольга из меди Фольга из золота
Источник
Металлы – твёрдые элементы, сплавы которых широко применяются в промышленности, строительстве и повседневной жизни. Пластичность, твёрдость, тепло- и электропроводность, а также способность к плавке и ковке обусловлены строением металлов.

Строение
Электронное строение атома металла включает:
- положительно заряженное ядро;
- отрицательно заряженные электроны.
Ядро состоит из протонов и нейтронов. Количество протонов, заряд ядра и число электронов соответствуют порядковому номеру металла в периодической таблице.
Электроны в металлических атомах расположены намного дальше от ядра, чем электроны неметаллов. Этим объясняется лёгкость отделения валентных электронов, поэтому металлы всегда являются восстановителями в химических реакциях.
Атомы всех металлов, за исключением ртути, образуют кристаллические решётки. Кристаллическая решётка состоит из повторяющихся комплексов атомов – элементарных кристаллических ячеек, которые бывают трёх видов. Их отличия описаны в таблице строения металлов.
Вид решётки | Характеристика | Примеры |
Кубическая объёмно-центрированная (ОЦК) | Восемь ионов находятся по углам условного куба, один – в середине | Fe, Cr, Mo, W, V |
Кубическая гранецентрированная | Ионы располагаются в углах куба и в центре каждой грани. Центр куба свободен | Cu, Ag, Ni, Pb, Al |
Гексагональная плотноупакованная | Шестигранная призма. В углах и в центре между ними находятся ионы. Посередине призмы лежат ионы, образующие треугольник | Zn, Ti, Mg, Co, Zr |
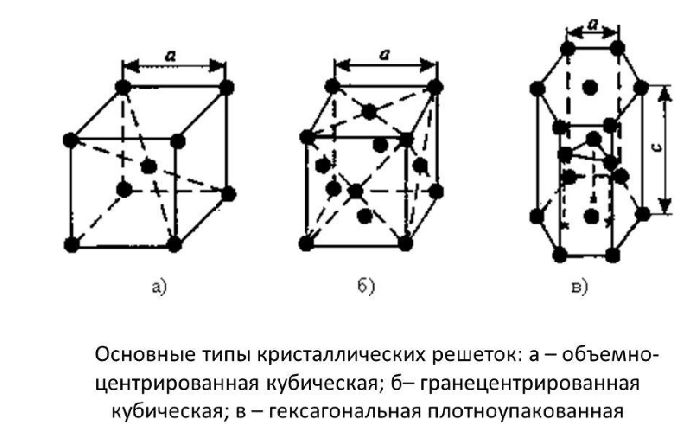
Рис. 1. Виды решёток металлов.
Физические свойства
Металлы отличаются от неметаллов характерными физическими свойствами:
- имеют металлический блеск;
- проводят электрический ток и тепло;
- не имеют запаха;
- обладают серебристо-серым цветом (исключение – медь и золото).
Благодаря пластичности и плавке металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальное – случайные примеси и специально вводимые вещества. Сплавы отличаются высокой прочностью, упругостью, хрупкостью. Широко применяются сплавы на основе железа (чёрные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Виды
Классификация металлов приведена в таблице.
Признак | Вид | Пример |
Температура кипения | Легкоплавкие (Т<1000°С) | K, Al, Zn |
Тугоплавкие (Т>1000°С) | Au, Cu, Ni | |
Плотность | Лёгкие (ρ<5 г/см3) | Li |
Тяжёлые (ρ>5 г/см3) | Os | |
Твёрдость | Мягкие – режутся ножом | Na, Rb, Cs |
Твёрдые – используются для резки | Cr |
В химии по структуре орбиталей атома металла различают s-, p-, d-, f-металлы.
Химические свойства
Металлы являются восстановителями и вступают в реакцию с неметаллами, образуя оксиды, гидроксиды, соли. Самыми активными являются щелочные и щелочноземельные металлы, расположенные в I и II группах таблицы Менделеева. Благородные металлы (Au, Ag, Pt) малоактивны и не взаимодействуют с кислородом и водой.
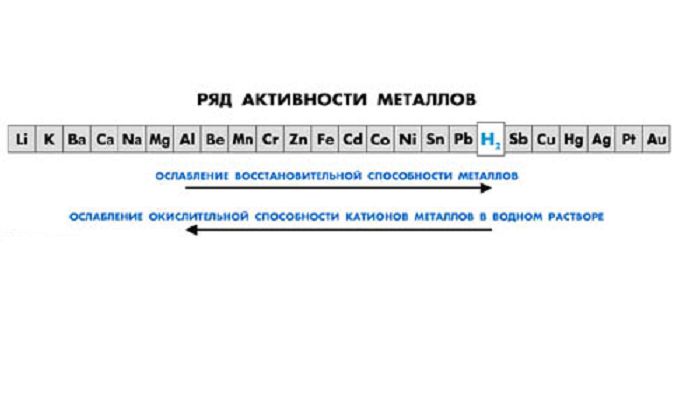
Рис. 2. Шкала активности металлов.
Особенности химического взаимодействия металлов с другими элементами описаны в таблице.
Взаимодействие | Продукты | Уравнение |
С кислородом | Оксиды | 2Mg + O2 → 2MgO |
С серой | Сульфиды | Zn + S → ZnS |
С азотом | Нитриды | 6Li + N2 → 2Li3N |
С фосфором | Фосфиды | 3Ca + 2P → Ca3P2 |
С галогенами | Галогениды | 2Na + Cl2 → 2NaCl |
С водой | Гидроксиды | 2Na + 2H2O → 2NaOH + H2 |
С кислотами | Соли | 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 |
С солями (замещают менее активные металлы) | Соль | 2Fe + Cu2SO4 → Fe2SO4 + 2Cu |
Золото растворяется в царской водке (смеси соляной и азотной кислот), серебро – в концентрированной азотной и горячей серной кислотах.

Рис. 3. Золото.
Что мы узнали?
Рассмотрели особенности строения атомов металлов, физические и химические свойства. Металлы состоят из элементарных кристаллических ячеек, отличающихся конфигурацией. Элементы обладают металлическим блеском, электропроводностью, пластичностью, твёрдостью. Металлы – восстановители. Наиболее активные находятся в I и II группах таблицы Менделеева. Металлы реагируют с кислородом, водой, кислотами, галогенами и неметаллами.
Тест по теме
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 193.
Источник
Таблица химических элементов содержит наименования и характеристики ста пяти различных веществ. Основная масса из них является металлами. Эти химические элементы имеют достаточно широкое распространение на нашей планете. Металлы можно встретить в различных соединениях в атмосфере и в недрах земли, в составе живых организмов и растений, а также водах океанов, морей озер и рек. Свойства данных химических элементов весьма специфичны. Их характеристики имеют ярко выраженные отличия от веществ других групп. Так, если элемент относится к разряду металла, то у него в обязательном порядке должен наблюдаться определенный перечень свойств:
– наличие плотной кристаллической структуры;
– выраженный блеск;
– способность к электрической проводимости;
– высокая степень теплопроводности;
– снижение способности проводить электричество с увеличением теплового режима;
– легкая отдача электронов;
– тягучесть, а также ковкость;
– способность образовывать различные сплавы.
Строение металлов, которое определено современным научным мировоззрением, представляет собой кристаллическую решетку. В ее основе находятся свободные электроны и ионы, обладающие положительным зарядом. Сам кристалл изображается в форме решетки, имеющей пространственную структуру. Узлы данной системы заняты ионами, а между ними находятся электроны, обладающие высокой способностью к движению. Строение атомов металлов позволяет активным частицам постоянно перемещаться. Электроны совершают переходы между атомами, а также вращаются вокруг их ядер. Зная особенности строения атомов металлов, можно легко объяснить возникновение в них электрического тока. Он появляется под воздействием разности потенциалов, когда электроны, не имеющие связей с ионами, начинают упорядоченное движение в одном направлении.
Особенности строения атомов металлов обуславливают и высокую тепловую проводимость данных элементов. Электроны, которые совершают непрерывное движение, обмениваются энергией с ионами в момент столкновения с последними. Элементы, находящиеся в узлах кристаллической решетки, передают колебания соседним частицам, те следующим и так далее. Вследствие этого процесса тепловой режим металла уравновешивается. В результате температура всей массы становится одинаковой.
Особенности строения атомов металлов заключаются в существовании между ними связей ковалентного характера. В кристаллической решетке присутствует также сила кулона, которая притягивает электроны и ионы. Это и есть металлическая связь, которая существует между частицами элемента. Данный тип соединения присутствует даже при наличии жидкого состояния вещества. Исходя из этого, можно сделать вывод, что металлической связью обладают не отдельные частицы. Ею владеют их агрегаты.
С точки зрения химии, особенности строения атомов металлов заключаются в беспрепятственной отдаче электронов валентности и переходе при этом в ионы. Вследствие этого, само вещество служит энергетическим восстановителем. Способность отдавать свои электроны у различных металлов находит свое проявление в различной степени. Чем легче происходит данный процесс, тем более активным считается элемент. При этом его взаимодействие с другими веществами происходит максимально энергично. Существует ряд напряжений, который опытным путем был составлен Бекетовым – русским ученым-химиком. Металлы в этом перечне находятся в определенной последовательности, которая характеризует убывание их химической способности к активности. Исходя из ряда напряжений, можно определить свойства элемента:
– при снижении электродного потенциала металла увеличивается его восстановительная функция;
– металлы способны вытеснять из солевых растворов те элементы, которые расположены после них в ряду напряжений;
– металлы, располагаемые в перечне активности слева от водорода, могут вытеснять его из кислотных растворов.
Источник
Лекция Химия
Тема: Металлы, особенности строения атомов, способы
получения и свойства
План
1. Особенности строения атомов металлов.
2. Способы получения металлов.
3.Физические свойства металлов.
4. Химические свойства металлов.
1. Особенности строения атомов металлов
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s-элементы I и II групп (исключение — водород), все d– и f – элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
сравнительно слабая связь валентных электронов с ядром;
низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. металлы – восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Men+ + пе– = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
2. Способы получения металлов
С или СО (карботермия)
PbO + C = Pb + CO
Fe203 + 3СО = 2Fe + 3C02
Сульфиды предварительно обжигают:
2ZnS + 302 = 2ZnO + 2S02
ZnO + С = Zn + 2СО
Fe, Cu, Pb, Sn, Cd, Zn
Al, Mg и др.
(металлотермия)
Cr203 + 2AI = 2Cr + Al203
TiCI4 + 2Mg = Ti + 2MgCl2
Mn, Cr, W, Mo, Ti, V
H2(водородотермия)
Mo03 + 3H2 = Mo + 3H20
Оксиды активных металлов (МgО, СаО, А1203 и др.) водородом не восстанавливаются
Cu, Ni, W, Fe, Mo, Cd, Pb
Электрометаллургия – восстановление электрическим током
Виды электролиза
Примеры
Получаемые металлы
Электролиз расплавов
NaCl = Na+ + Cl-
расплав
К Na+ + е- = Na 2
А Cl- + 2е- = Cl2 1
2NaCl электролиз 2Na + Cl2
2Al2O3 электролиз 4Al + 3O2
Na3(AlF6)
Щелочные металлы, Be, Mg, Ca (из расплавленных хлоридов), Al – из расплавленного оксида
Электролиз растворов
NiSO4 = Ni2+ + SO42-
раствор
К Ni2+ + 2е- = Ni 2
А 2Н2О – 4е- = O2 + 4Н+ 1
2NiSO4 + 2Н2О электролиз 2Ni + О2 + Н2SO4
Zn, Cd, Co, Mn, Fe
Гидрометаллургия – восстановление из растворов солей
Примеры
Получаемые металлы
Металл, входящий в состав руды, переводят в раствор, затем восстанавливают более активным металлом:
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
CdO + H2SO4 = CdSO4 + H2O
CdSO4 + Zn = ZnSO4 + Cd
Cd, Ag, Au, Cu
Задания для самостоятельной работы
1. Атому магния в степени окисления +2 соответствует электронная конфигурация:
а) 1s2 2s2 2р6 3s2 3р6; в) 1s2 2s2 2р4;
б) 1s2 2s2 2р6; г) 1s2 2s2 2р6 3s2;
2. При частичном восстановлении водородом 30 г оксида кобальта. В получили смесь оксида и металла массой 26,8 г. Определите количество вещества водорода, вступившего в реакцию, и массовую долю кобальта в полученной смеси.
3. При электролизе раствора сульфата меди (II) в растворе образовалась кислота (около анода), на нейтрализацию которой затрачен раствор объемом 16 см (р = 1,05 г/см3) с массовой долей гидроксида калия 6%. Вычислите массу меди, которая выделилась на катоде.
4. Для восстановления марганца из оксида марганца(1/) путем алюмотермии было смешано 10,8 г алюминия и 26,2 г оксида. Определите, какое из исходных веществ осталось и какова его масса.
3. Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1).Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блеск и непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см3): Na, Са, Mg, Al, Ti — и тяжелые (плотность больше 5 г/см3): Zn, Cr, Sn, Mn, Ni, Сu, Ag, Pb, Hg, Аи, W, Os – самый тяжелый;
2). по значению температуры плавления — на легкоплавкие (tпл < 1000 °С): Hg, Na, Sn, Pb, Zn, Mg, Al, Ca, Ag — и тугоплавкие (tпл > 1000 °C): Au, Cu, Mn, Ni, Fe, Ti, Cr, Os, W – самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей (Fe, Со, Ni);
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях (Al, Cr, Ti);
в) диамагнитные — не притягиваются к магниту (Sn, Сu, Bi).
4. Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me – пе– = Meп+(окисление)
восстановитель
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
1). Взаимодействие металлов с простыми веществами — неметаллами
Металлы при определенных условиях взаимодействуют с неметаллами, например с кислородом образуют оксиды:
2Mg + 02 = 2MgO 4А1 + 302 = 2А1203
Из щелочных металлов только литий сгорает на воздухе с образованием оксида:
4Li + 02 = 2Li20
оксид лития
Основной продукт окисления натрия — пероксид:
2Na + 02 = Na202
пероксид
натрия
При горении других щелочных металлов образуются супероксиды, например:
+1 -1 0 0 -1 +1
2К + 202 = К204 ( К-О-О-О-О—К)
супероксид
калия
Оксиды натрия и калия могут быть получены при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
Na202 + 2Na = 2Na20
На реакции пероксида натрия с оксидом углерода (1V) основана регенерация воздуха в изолированных помещениях (например, на подводных лодках):
2Na2О2 + 2СО2 = 2Na2CО3 + О2
При нагревании металлы реагируют с другими неметаллами:
Mg + Br2 = MgBr2
4А1 + 3С = А14С3
бромид
карбид
магния
алюминия
2А1 + N2 = 2A1N
3Fe + С = Fe3C
нитрид
карбид
алюминия
железа
3Са + 2Р = Са3Р2
Са + 2С = СаС2
фосфид
карбид
кальция
кальция
Сu + S = CuS
2Mg + Si = Mg2Si
сульфид
силицид
меди (II) магния
Если металл проявляет переменную степень окисления, то активные неметаллы (фтор, хлор, бром, кислород) окисляют его до более высокой степени окисления, в которой он образует устойчивое в данных условиях соединение, а менее активные — до более низкой степени окисления. Так, железо проявляет в соединениях степени окисления +2 и +3 (иногда +6), из них +3 наиболее устойчива. В связи с этим при взаимодействии железа с хлором, бромом оно окисляется до степени окисления +3, а при взаимодействии с серой или иодом — до степени окисления +2:
2Fe + ЗС12 = 2 FeCl3 Fe + S = FeS
Щелочные и щелочно-земельные металлы при нагревании вступают в реакцию с водородом, образуя гидриды. Атомы водорода в данных соединениях имеют отрицательную степень окисления:
2Na + Н2 = 2NaH Ва + Н2 = BaH2
гидрид гидрид
натрия бария
Гидриды представляют собой кристаллические тугоплавкие солеобразные вещества белого цвета. Они активные восстановители за счет водорода в минимальной степени окисления (-1). Так, гидриды горят в атмосфере хлора, кислорода, энергично разлагаются водой с образованием щелочи и выделением водорода:
КН + С12 = КС1 + НС1 СаН2 + 02 = Са(ОН)2
ВаН2 + 2Н20 = Ва(ОН)2 + 2Н2
Гидриды применяют для получения водорода в полевых условиях (для водородной сварки), восстановления металлов из их оксидов, а также в органическом синтезе.
2). Взаимодействие металлов со сложными веществами
Если химические реакции протекают в водных растворах, то восстановительная активность металла определяется его положением в электрохимическом ряду напряжений.
А). Взаимодействие с водой
С водой при обычной температуре реагируют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды) и гидроксиды которых растворимы в воде (на поверхности металла не образуется защитная пленка). К таким металлам относятся щелочные и щелочно-земельные металлы:
2Na + 2Н20 = 2NaOH + Н2
Fe + Н20 (так как Fe(OH)2 нерастворим в воде)
При нагревании с водой или парами воды взаимодействуют металлы от магния до олова. Реакция протекает с образование» гидроксидов или оксидов и выделением водорода:
Mg + 2Н20 = Mg(OH)2 + Н2 3Fe + 4Н20 = Fe304 + 4H2
Б). Взаимодействие с щелочами
С растворами щелочей взаимодействуют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды), а их оксиды и гидроксиды амфотерны (оксидные и гидроксидные пленки растворяются в растворе щелочи). К таким металлам относятся цинк, алюминий, олово, бериллий, свинец и некоторые другие. Процесс протекает в три стадии:
1) растворение в щелочи пленки амфотерного оксида, которая покрывает поверхность металла;
2) взаимодействие металла, освобожденного от защитной оксидной пленки, с водой с образованием нерастворимого амфотерного гидроксида;
3) растворение образовавшейся пленки гидроксида в растворе щелочи.
Рассмотрим пример:
А1203 + 2NaOH + ЗН20 = 2Na[Al(OH)4]
амфотерный
2А1 + 6Н20 = 2А1(0Н)3 + ЗН2
амфотерный
2А1(ОН)3 + 2NaOH = 2Na[Al(OH)4)
амфотерный
(В результате второй реакции образовалось 2 моль А1(ОН)3, поэтому в уравнении третьей реакции записываем тоже 2 моль А1(ОН)3.)
Если просуммировать два последних уравнения, то получим уравнение реакции алюминия с раствором щелочи:
2А1 + 2NaOH + 6Н20 = 2Na[Al(OH)4) + ЗН2
Таким образом, при взаимодействии металла с раствором щелочи роль последней сводится к снятию с поверхности металла оксидной и гидроксидной пленки, а металл взаимодействует с водой.
Эти же металлы реагируют со щелочами при нагревании:
Zn + 2NaOH = Na2Zn02 + Н2
тв.
Металлы, высшие оксиды которых обладают амфотерными или кислотными свойствами, реагируют с щелочными расплава ми окислителей. В качестве окислителей используют нитраты калия или натрия, хлорат калия и др.
При взаимодействии с щелочными расплавами окислителей металлы образуют соли анионного типа, в которых, как правило, проявляют высшую степень окисления, например: +6
Fe + 3KN03 + 2КОН = K2Fe04 + 3KN02 + Н20
феррат калия
Аналогичные продукты образуются и при взаимодействии щелочных расплавов окислителей с оксидами металлов, в которых металлы проявляют промежуточную степень окисления: +3 +6
Fe203 + КСЮ3 + 4КОН = 2K2Fe04 + КС1 + 2Н20
В). Взаимодействие с кислотами
С разбавленными кислотами, которые проявляют окислительные свойства за счет ионов водорода (разбавленная серная, фосфорная, сернистая, все бескислородные и органические кислоты и др.), реагируют металлы:
расположенные в ряду напряжений до водорода (эти металлы способны вытеснять водород из кислоты);
образующие с этими кислотами растворимые соли (на поверхности этих металлов не образуется защитная солевая пленка).
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НС1 = 2А1С13 + 3Н2 Mg + H2S04 = MgS04 + H2
разб.
Сu + H2S04 (так как Сu стоит после Н2)
разб.
Pb + H2S04 (так как PbS04 нерастворим в воде)
разб.
С кислотами-окислителями — азотной и концентрированной серной, которые, как вам известно, проявляют окислительные свойства за счет атомов серы и азота в высших степенях окисления, взаимодействуют практически все металлы, расположенные в ряду напряжений как до, так и после водорода, кроме золота и платины. Так как окислителями в этих кислотах являются ионы кислотных остатков, а не ионы водорода, то прн их взаимодействии с металлами не выделяется водород. Металл под действием данных кислот окисляется до характерной (устойчивой) степени окисления и образует соль, а продукт восстановления кислоты зависит от активности металла и от степени разбавления кислоты.
Г). Взаимодействие металлов с кислотами-окислителями -2
активный металл Li — Zn Соль + H2S + Н20
+6 0
H2S04 (конц.) металл средней активности Cd — Pb Соль + S + Н20
+4
неактивный металл (после Н2) Соль + S02 + Н20
и Fe (при нагревании)
+4
HNO3((конц.) независимо от активности металла Соль + N02 + Н20
активный металл Li — Zn Соль + N2 + Н20
+1
HN03 (разб.) металл средней активности Fe — Pb Соль + N2O + Н20
+4
неактивный металл (после Н2) Соль + N0 + Н20
и Fe (при нагревании)
-3
HN03 (оч. разб.) активный металл Соль+ NH4N03 + H20
На основании схемы составим уравнения реакций меди и магния с концентрированной серной кислотой:
0 +6 +2 +4 0 +6 +2 -2
Сu+ 2H2S04 = CuS04 + S02 + 2Н20 4Mg + 5H2S04 = 4MgS04 + H2S + 4H20
kонц. kонц.
Следует иметь в виду, что на схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот. Так, при взаимодействии серной кислоты с цинком или магнием в зависимости от концентрации кислоты могут образоваться различные продукты восстановления серной кислоты:
Zn + 2H2S04 = ZnS04 + S02 + 2H20
70%-ная
3Zn + 4H2S04 = 3ZnS04 + S + 4H20
40% -ная
4Zn + 5H2S04 = 4ZnS04 + H2S + 4H20
25% -ная
Восстановление серной кислоты до сероводорода может протекать в растворе с массовой долей кислоты 25% и выше (если массовая доля серной кислоты ниже 25% , то она считается разбавленной). Однако по мере повышения концентрации кислоты возможность образования сероводорода уменьшается, так как при этом окислительные свойства серной кислоты усиливаются, а сероводород — активный восстановитель за счет атома серы в минимальной степени окисления (H2S). Поэтому концентрированная серная кислота окислит его до серы или до сернистого газа:
-2 +6 0
3H2S + H2S04 = 4S + 4Н20 (менее концентрированная H2S04)
-2 +6 +4
Н2S + 3H2S04 = 4S02 + 4H20 (более концентрированная H2S04)
Степень восстановления азотной кислоты при взаимодействии с одним и тем же металлом, например магнием или цинком, также определяется ее концентрацией. Концентрированная кислота восстанавливается до оксида азота (IV), так как низшие оксиды, образованные в ходе реакции, окисляются кислотой. По мере ее разбавления возрастает возможность образования продукта наиболее полного восстановления:
Mg + 4HN03 = Mg(N03)2 + 2N02 + 2H20
60% -ная
3Mg + 8HN03 = 3Mg(NOg)2 + 2NO + 4H20
30% -ная
4Mg + 10HN03 = 4Mg(N03)2 + N20 + 5H20
20% -ная
5Mg + 12HN03 = 5Mg(N03)2 + N2 + 6H20
10% -ная
4Mg + 10HN03 = 4Mg(N03)2 + NH4N03 + 3H20
3% -ная
Некоторые металлы (железо, алюминий, хром) не взаимодействуют с концентрированной серной и азотной кислотами при обычной температуре, так как происходит пассивация металла. Это явление связано с образованием на поверхности металла тонкой, но очень плотной оксидной пленки, которая и защищает металл. По этой причине концентрированную азотную и серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, проявляющими окислительные свойства за счет ионов Н+, он образует соли, в которых его степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых он проявляет более устойчивую степень окисления:
0 +2
Fe + H2S04 = FeS04 + H2
разб.
0 +3
2Fe + 6H2S04 = Fe2(S04)3 + 3S02 + 6H20
конц.
Д).Взаимодействие с растворами солей
Каждый металл, начиная с магния, вытесняет все следующие за ним в ряду напряжений металлы из растворов их солей:
Fe + CuS04 = FeS04 + Сu
Такие металлы, как литий, натрий, калий, кальций, барий. использовать для вытеснения менее активных металлов из водных растворов солей нельзя, так как при обычных условиях они реагируют с водой.
Источник
