Какие оксиды обладают только кислотными свойствами

Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?

Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
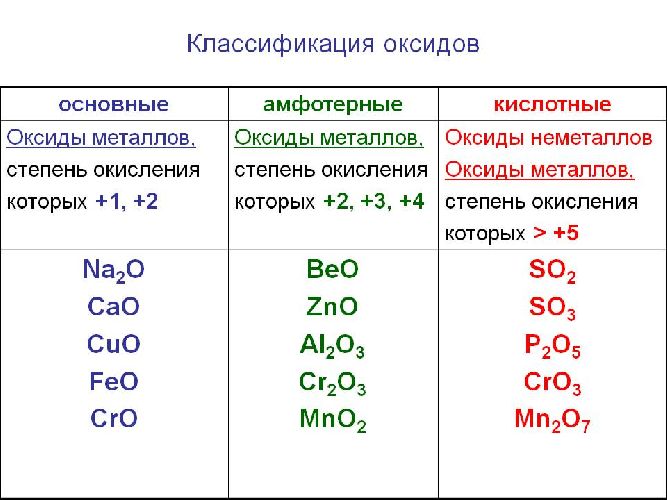
Рис. 1. Виды оксидов.
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
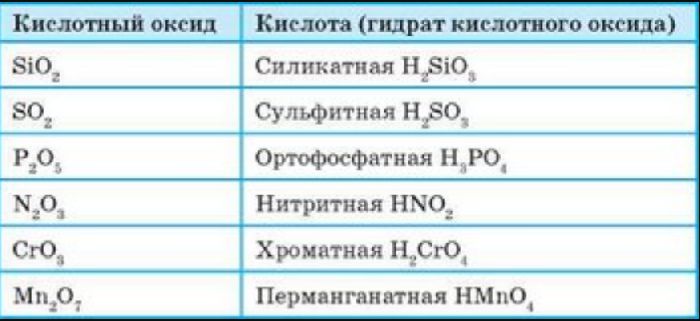
Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 891.
Источник
Запрос «Окись» перенаправляется сюда; об одноимённом фильме см. Окись (фильм).
Окси́д (синонимы: о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами также является класс минералов, представляющих собой соединения металла с кислородом (см. Окислы).
Соединения, которые содержат атомы кислорода, соединённые между собой, называют пероксидами или перекисями (содержат цепочку −O−O−), супероксидами (содержат группу О−
2) и озонидами (содержат группу О−
3). Они, строго говоря, не относятся к категории оксидов.
Классификация[править | править код]
В зависимости от химических свойств различают:
- Солеобразующие оксиды:
- основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
- кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
- амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
- Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
Существуют сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода — например, оксид лития-кобальта(III) Li2O·Co2O3, и двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления — например, оксид марганца(II,IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот. Так, оксид лития-кобальта(III) можно рассматривать как кобальтит лития Li2Co2O4, а оксид марганца(II,IV) — как ортоманганит марганца Mn3(MnO4)2.
Номенклатура[править | править код]
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом или одноокисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
В начале XIX века и ранее тугоплавкие, практически не растворимые в воде оксиды химики называли «землями».
Традиционная номенклатура[править | править код]
Оксиды с низшими степенями окисления (субоксиды) иногда называют закись и недокись (например, оксид углерода(II), CO — закись углерода; диоксид триуглерода, C3O2 — недокись углерода[1]; оксид азота(I), N2O — закись азота; оксид меди(I), Cu2O — закись меди).
Оксиды с высшими степенями окисления (например, оксид железа(III), Fe2O3) называют в соответствии с этой номенклатурой окись, а двойные (то есть с разными степенями окисления) оксиды — закись-окись (Fe3O4 = FeO·Fe2O3 — закись-окись железа, оксид урана(VI)-диурана(V), U3O8 — закись-окись урана).
Если какой-нибудь металл дает один основной окисел, то последний называют окисью, например окись кальция, окись магния и пр.; если их существует два, то окисел с меньшим содержанием кислорода называется закисью, например закись железа FeO и окись Fe2O3. Окись с меньшим содержанием кислорода, чем в закиси, называется недокисью
Эта номенклатура, однако, не отличается последовательностью, поэтому такие названия следует рассматривать скорее как традиционные.
Свойства[править | править код]
- При взаимодействии кислотного оксида с основным образуется соль.
- Оксиды взаимодействуют с водой, если образуется растворимая кислота или растворимое основание.
- Основные оксиды взаимодействуют с кислотами, а кислотные с основаниями.
Основные оксиды[править | править код]
1. Основный оксид + сильная кислота → соль + вода
2. Сильноосновный оксид + вода → гидроксид
3. Сильноосновный оксид + кислотный оксид → соль
4. Основный оксид + водород → металл + вода
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды[править | править код]
1. Кислотный оксид + вода → кислота
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль
3. Кислотный оксид + основание → соль + вода
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
4. Нелетучий оксид + соль1 → соль2 + летучий оксид
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1
Амфотерные оксиды[править | править код]
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
(в водном растворе)
(при сплавлении)
Получение[править | править код]
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды:
2. Обжиг или горение бинарных соединений в кислороде:
3. Термическое разложение солей:
4. Термическое разложение оснований или кислот:
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
6. Взаимодействие некоторых металлов с водой при высокой температуре:
7. Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:
8. Взаимодействие металлов с кислотами-окислителями:
9. При действии водоотнимающих веществ на кислоты и соли:
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
Примечания[править | править код]
Ссылки[править | править код]
- Таблица классификации оксидов
- Видеоурок про оксиды
Источник
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
![]() Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам: Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:
Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства: Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):![]() Основные оксиды реагируют с кислотными оксидами с образованием солей:
Основные оксиды реагируют с кислотными оксидами с образованием солей:![]() Аналогично реагируют и с кислотами, но с выделением воды:
Аналогично реагируют и с кислотами, но с выделением воды:![]() Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:![]()
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:![]() Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:![]() Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:
Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:![]() Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:
Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:![]() Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:![]()
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: ![]() И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом:  При обжиге или горении различных бинарных соединений:
При обжиге или горении различных бинарных соединений:![]() Термическое разложение солей, кислот и оснований :
Термическое разложение солей, кислот и оснований : Взаимодействие некоторых металлов с водой:
Взаимодействие некоторых металлов с водой:![]()
Применение оксидов
 Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Источник
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов

Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → 2Na2O2
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства основных оксидов.
Химические свойства кислотных оксидов.
Химические свойства амфотерных оксидов.
Источник
