Какие общие свойства раствора
ОСНОВНЫЕ СВОЙСТВА РАСТВОРОВ И ИХ КЛАССИФИКАЦИЯ
Раствором называется правильно подобранная смесь вяжущего, заполнителя, воды и, в необходимых случаях, специальных добавок, затвердевающая после нанесения ее на поверхность и превращающаяся в камень. До затвердения смесь этих материалов называют растворной смесью.
Вяжущее в растворе заполняет пространство между частичками заполнителя, прочно связывая их между собой в процессе твердения.
Вода в растворе вступает в химическую реакцию с вяжущим.
Заполнитель создает жесткий скелет в растворе, снижает его усадку и экономит вяжущее.
Классификация растворов.
Растворы классифицируют по различным признакам. По плотности растворы подразделяются на тяжелые (1500 кг/м3 и более) и легкие (менее 1500 кг/м3).
По скорости схватывания растворы подразделяются на быстросхватывающиеся и медленносхватывающиеся.
По количеству вяжущего растворы подразделяются на жирные и тощие. Жирными называют растворы с избытком вяжущего. Такие растворы пластичны, но при твердении могут потрескаться и дают большую усадку. Тощие растворы содержат недостаточное количество вяжущего материала. Такие растворы малопластичны, менее удобны в работе, но они дают небольшую усадку, что позволяет использовать их в облицовочных работах.
По виду вяжущего материала растворы подразделяются на глиняные, известковые, гипсовые, известково-гипсовые, цементные, цементно-известковые.
В зависимости от среды твердения различают воздушные растворы, твердеющие в воздушно-сухих условиях (например, гипсовые), и гидравлические, начинающие твердеть на воздухе и продолжающие твердеть в воде или во влажной среде (цементные).
В зависимости от количества вяжущих растворы подразделяют на простые – приготовленные на одном вяжущем материале – и смешанные – приготовленные на нескольких вяжущих.
Составы всех растворов записывают в виде чисел, обозначающих объемные части вяжущего и заполнителя. Составы простых растворов записывают в виде соотношения, состоящего из двух чисел. Первое число (как правило, единица) обозначает, что в растворе содержится одна объемная часть вяжущего материала. Второе число показывает, сколько объемных частей заполнителя необходимо взять на одну часть вяжущего материала. Например, цементный раствор состава 1: 3 означает, что на одну часть вяжущего (цемента) приходится три части заполнителя (песка).
Для смешанных растворов соотношение состоит из трех чисел. Первое число (единица) показывает объемную часть основного вяжущего материала; второе число обозначает количество дополнительного вяжущего, а третье – количество частей заполнителя. Рассмотрим, например, цементно-известковый раствор состава 1:2:8. Из названия раствора ясно, что первое число обозначает количество цемента (одна объемная часть), второе – количество извести (две объемные части), а третье – количество песка (восемь объемных частей).
Свойства растворных смесей.
К основным свойствам растворных смесей относятся удобоукладываемость, подвижность, водоудерживающая способность и расслаиваемость.
Удобоукладываемость – это свойство растворной смеси легко распределяться плотным и тонким слоем на основании, равномерно заполняя все его неровности и шероховатости. Удобоукладываемость зависит от пластичности (подвижности) и водоудерживающей способности смеси.
Для того чтобы с растворной смесью было легко работать, она должна быть пластичной. Пластичность смеси характеризуется ее подвижностью. Подвижность – это способность растворной смеси растекаться под действием собственной массы или приложенных к ней внешних сил. Для определения подвижности растворной смеси применяют эталонный конус (рис. 1). Масса 300 г, высота – 180 мм, диаметр основания – 150 мм, угол при вершине – 30°. Через каждые 10 мм на поверхности конуса нанесены деления по высоте. Конус опускают, и он под действием собственной массы погружается в растворную смесь. Подвижность растворной смеси измеряется в сантиметрах. Она равна глубине погружения эталонного конуса. Погружение конуса на глубину 7 см означает, что подвижность растворной смеси равна 7 см.
Рисунок 1. Эталонный конус для определения подвижности раствора: 1 – корпус; 2 – цепочка; 3 – кольцо
Водоудерживающая способность – это свойство растворной смеси удерживать воду при наличии ее отсоса пористым основанием.
Если растворную смесь с недостаточной водоудерживающей способностью (например, известковую) нанести на такое пористое основание, как кирпичная кладка, то поры основания быстро всосут в себя воду из растворной смеси, она обезводится, что приведет к уменьшению сроков схватывания, и в конечном результате затвердевший раствор будет менее плотным и прочным. Поэтому перед нанесением растворной смеси на пористое основание его предварительно смачивают водой.
Расслаиваемость – разделение растворной смеси на твердую и жидкую фракции при ее перевозке или хранении. Твердая и более тяжелая фракция – песок и вяжущее вещество – опускаются вниз, жидкая фракция – вода – собирается вверху.
Свойства растворов.
К основным свойствам растворов относятся прочность, водонепроницаемость, морозостойкость, усадка.
Прочность раствора характеризуется его маркой, которая определяется пределом прочности при сжатии стандартных образцов – кубов с ребрами 7,07 см, выполненных из растворной смеси и испытанных после 28-суточного твердения при температуре 25 °С (ГОСТ 5802 – 86). По пределу прочности на сжатие (кгс/см2) для строительных растворов установлены следующие марки: 4, 10, 25, 50, 75, 150, 200.
Водонепроницаемость – это свойство раствора не пропускать через себя воду. Степень водонепроницаемости зависит в основном от пористости раствора. Менее всего пропускают воду плотные растворы (например, цементные). Водонепроницаемость раствора повышают введением в него добавок при приготовлении растворной смеси – церезита, жидкого стекла или полимерных смол.
Морозостойкость – это свойство раствора в насыщенном водой состоянии выдерживать многократное число циклов попеременного замораживания и оттаивания без видимых признаков разрушения и значительного снижения прочности и массы. Морозостойкость раствора характеризуется маркой (Мрз). Марка определяется числом циклов попеременного замораживания и оттаивания, которые выдержат образцы – кубы с ребром 7,07 см в насыщенном водой состоянии. Различают следующие марки раствора по морозостойкости: Мрз 10, 15, 25, 35, 50, 100, 150, 200, 300.
Усадка – это уменьшение объема раствора при твердении вяжущих веществ. Усадка – нежелательное явление, так как она может вызвать появление трещин на отделываемой поверхности, разрушение штукатурки и облицовки.
Поделитесь ссылкой в социальных сетях
Источник
Классификация растворов
Введение
Растворы
Очень многие химические реакции, в том числе технические и жизненно важные, протекают в жидкой фазе.
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов. Человек, животные и растения усваивают питательные вещества в виде растворов. Растворами являются физиологические жидкости – плазма крови, лимфа, желудочный сок и др. Многие медицинские препараты являются растворами различных химических веществ в воде или в спирте.
Природная вода является раствором. В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание теории электролитической диссоциации является основой для изучения свойств неорганических и органических соединений и глубокого понимания механизмов химических реакций в растворах.
Растворами называют однородные системы, состоящие из двух или нескольких компонентов, состав которых можно изменять в определенных пределах без нарушения однородности.
Растворителем называется компонент, концентрация которого выше концентрации других компонентов.
Раствор это не механическая смесь, поскольку при растворении наблюдаются объемные и энергетические эффекты.
Раствор отличается от механической смеси гомогенностью, а от химического соединения:
a) переменным составом – от нуля до предела насыщения;
б) тем, что изменение свойств растворителя и растворённого вещества не носит радикальный характер.
Растворение – это самопроизвольный процесс, заключающийся во взаимодействии растворенного вещества с молекулами растворителя. Точка зрения Д. И. Менделеева:
раствор – это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Различают истинные и коллоидные растворы.
Истинные растворы – размер частиц ~10-10…10-11 м, т.е. атомы или молекулы.
Коллоидные растворы – размер частиц ~ 10-8… 5×10-10 м
Растворы бывают:
1) газообразные: газ-газ;
2) жидкие: газ-жидкость,
жидкость-жидкость,
твердое вещество – жидкость;
3) твердые: газ – твердое вещество,
твердое вещество – твердое вещество.
Жидкие растворы могут быть водные и неводные. Водные растворы – это растворы, в которых растворителем является вода.
Твёрдым раствором называется кристалл, кристаллическая решётка которого состоит из двух или более компонентов.
Растворы делятся на электролиты и неэлектролиты. Вещества, которые в растворе или расплаве полностью или частично распадаются на ионы и проводят электрический ток, называются электролитами.
Идеальным называется раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между взаимодействующими компонентами одинаковы.
Общие (коллигативные) свойства растворов те, которые не зависят от природы растворённых веществ, а зависит от количества растворенного вещества.
1.2.1 Закон Рауля:
понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворённого нелетучего вещества:
, (10.1)
где и – давление насыщенного пара растворителя над чистым растворителем и над раствором, Па;
х – мольная доля.
Первое следствие из закона Рауля:повышение температуры кипения DТкип пропорционально моляльной концентрации раствора:
DТкип= Кэ×Сm , (10.2)
где Кэ – эбулископическая постоянная растворителя,
Сm – моляльная концентрация, моль/1000 г .
Второе следствие из закона Рауля:понижение температуры замерзания DТзам пропорционально моляльной концентрации раствора:
DТкип=Кк×Сm , (10.3)
где Кк – криоскопическая постоянная.
Кк и Кэ – зависят от природы растворителя:
(10.4)
где DНкип – удельная теплота испарения, ;
Ткип – температура кипения чистого растворителя, К;
R – газовая постоянная, .
, (10.5)
где DНкриc. – удельная теплота кристаллизации, ;
Ткрит. – температура кристаллизации чистого растворителя, К.
1.2.2 Осмотическое давление
Если система, разделённая мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
Представим, что сосуд с двумя горлами для добавления раствора разделён мембраной (рисунок 1). В каждую часть сосуда зальём растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведёт к переходу части растворителя в ту часть сосуда, где концентрация растворённого вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнётся в сторону с меньшей концентрацией растворённого вещества (рисунок 1а). Если мембрана жёсткая, то в отсеке с большой концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рисунок 1а) не станет равным осмотическому давлению и не прекратит осмос.
Если внешнее давление больше атмосферного и приложено к более концентрированному раствору, то растворитель будет переходить в разбавленный раствор – обратный осмос.
Рисунок 10.1 – Схема разности осмотических давлений при концентрации x1<x2 при эластичной (а) и жесткой (б) мембранах
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Согласно Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворённое вещество, будучи переведенным в газообразное состояние в том же объёме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде:
π = СМ.R.T , (10.6)
где СМ – молярная концентрация, моль/л.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворённого вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворённых молекул, Вант-Гофф ввёл понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворённых молекул:
i = число частиц в растворе / число молекул в растворе . (10.7)
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением 2CH3COOH = (CH3COOH)2.
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в одном растворе уксусная кислота диссоциирует:
CH3COOH = CH3COO- + H+,
и число частиц становится больше числа молекул.
1.2.3 Закон распределения Нернста – Шилова:
при постоянной температуре соотношение равновесных концентраций между несмешивающимися жидкостями является величиной постоянной, независимой от общего количества компонентов:
, (10.8)
где Крас – коэффициент распределения;
Са и Сb – молярные концентрации веществ в растворах А и В, моль/л.
Источник
Запрос «Растворы» перенаправляется сюда; см. также другие значения.
Растворение поваренной соли (NaCl) в воде
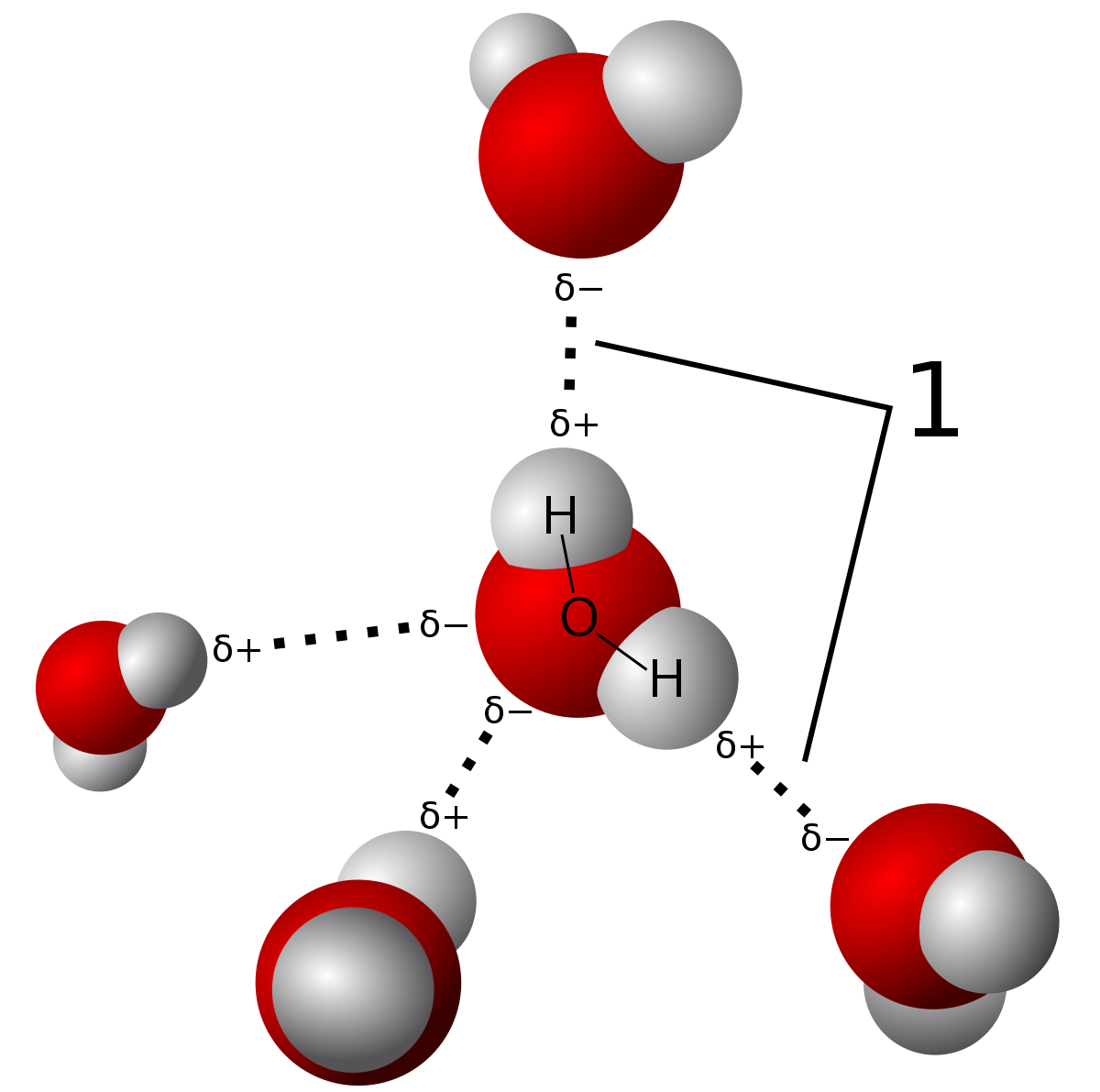
Вода является хорошим растворителем, поскольку молекулы полярны и способны образовывать водородные связи (1).
Раство́р — однородная (гомогенная) система, в состав которой входят молекулы (атомы, ионы) двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах.
От механической смеси раствор отличается однородностью, от химического соединения — непостоянством состава.
Растворителем называют вещество, частицы которого преобладают в растворе, при этом остальные компоненты раствора называют растворёнными веществами.
В зависимости от агрегатного состояния раствор может быть газовым (то же, что смесь газов), жидким или твёрдым. Обычно, говоря о растворе, имеют в виду жидкий раствор.
Образование того или иного типа раствора[уточнить] обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ[1].
По сравнению с индивидуальными веществами по структуре растворы сложнее[1].
Химическое взаимодействие растворенного вещества с растворителем в некоторых случаях приводит к диссоциации. Частицы (как ионы, образовавшиеся в результате диссоциации, так и недиссоциированные молекулы) часто взаимодействуют с растворителем, с образованием структур, которые называются сольватами (гидратами, если речь о водных растворах). Этот процесс называют сольватацией (гидратацией). Гидратную теорию растворов предложил русский учёный Д. И. Менделеев.
Твёрдые, жидкие, газообразные растворы[править | править код]
Чаще всего под раствором подразумевается жидкое вещество, например, раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким (водный раствор), твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и гетерогенность — см. «Золи».
Истинные и коллоидные растворы[править | править код]
Коллоидные и истинные/молекулярные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1 нм, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1 нм — 100 нм[2], частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение[править | править код]
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
При растворении кристаллических веществ, растворимость которых увеличивается с увеличением температуры, происходит охлаждение раствора ввиду того, что у раствора внутренняя энергия больше, чем у кристаллического вещества и растворителя, взятых отдельно. Например, кипяток, в котором растворяют сахар, сильно охлаждается[3].
Растворы электролитов и неэлектролитов[править | править код]
Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы.
Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы.
Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Растворы полимеров[править | править код]
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов.
Концентрация растворов[править | править код]
В зависимости от цели для описания концентрации растворов используются разные физические величины.
- Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить ещё некоторое его количество.
- Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
- Пересыщенный раствор (изредка используется термин перенасыщенный) — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе. Пересыщенные растворы неустойчивы, избыток вещества легко выпадает в осадок. Такой раствор нельзя получить путём растворения в нормальных условиях, обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).
- Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества. Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщенные. Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным.
- Разбавленный раствор — раствор с низким содержанием растворённого вещества. Отметим, что не всегда разбавленный раствор является ненасыщенным — например, насыщенный 0,0000134М раствор практически нерастворимого хлорида серебра является очень разбавленным. Граница между разбавленным и концентрированным растворами весьма условна.
См. также[править | править код]
- Эмульсия
- Гели
- Нанодисперсия
- Эвтектика
- Электролитическая диссоциация
- Сольватохромизм
Примечания[править | править код]
Литература[править | править код]
- Растворы // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- Растворы // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные—Трипсин. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Шахпаронов М. И. Введение в молекулярную теорию растворов. — М.: Государственное издательство технико-теоретической литературы, 1956. — 508 с.
- Реми Г. Курс неорганической химии. — М.: Издательство иностранной литературы, 1963, 1966. — Т. 1—2.
- Streitwieser, Andrew; Heathcock, Clayton H., Kosower, Edward M. Introduction to Organic Chemistry (неопр.). — 4th ed.. — Macmillan Publishing Company, New York, 1992.
Ссылки[править | править код]
- Растворы — статья из энциклопедии «Кругосвет»
- [www.xumuk.ru/encyklopedia/2/3823.html Растворы]. xumuk.ru. Дата обращения 11 марта 2015.
- Растворы, системы дисперсные и коллоидные. Базовая терминология — статья из https://samlib.ru/a/anemow_e_m/ege-6.shtml
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Источник
