Какие общие свойства подгруппы

Общая характеристика подгруппы
В пределах пятой группы главной подгруппы сверху вниз постепенно от атома азота к висмуту усиливаются металлические свойства и ослабевают неметаллические, что связано с увеличением радиуса атома и в связи с этим уменьшением силы притяжения внешних валентных электронов. Азот и фосфор — типичные неметаллы, мышьяк и сурьма неметаллы, но проявляют некоторые металлические свойства, висмут — элемент, обладающий металлическими свойствами (табл. 17).
Элементы этой подгруппы образуют два ряда оксидов, имеющих общие формулы: Э203 и Э205. В этих рядах от азота к висмуту уменьшаются кислотные свойства оксидов и их устойчивость и, соответственно, уменьшаются кислотные свойства и устойчивость их гидроксидов (табл. 18).
Элементы V группы главной подгруппы образуют водородные соединения с общей формулой ЭН3: NH3, РН3, AsH3, SbH3, ВШ3. В этом ряду от азота к висмуту возрастает радиус атома и длина связи Э—Н и, следовательно, уменьшается её прочность. От азота к висмуту уменьшается электроотрицательность элементов и поэтому полярность связи
Э—Н уменьшается. Однако связи Э—Н более прочные, чем у элементов подгруппы кислорода и галогенов и поэтому в водных растворах они не диссоциируют с отщеплением протона, т. е. не проявляют кислотных свойств.
Символ элемента | N | Р | As | Sb | Bi |
Название | Азот | Фосфор | Мышьяк | Сурьма | Висмут |
Порядковый номер | 7 | 15 | 33 | 51 | 83 |
Относительная атомная масса, Аг | 14,00 | 30,97 | 74,92 | 121,75 | 208,98 |
Ковалентный радиус, нм | 0,075 | 0,110 | 0,121 | 0,143 | 0,152 |
Энергия ионизации, кДж/моль | 1402,3 | 1011,7 | 947,0 | 833,7 | 703,2 |
Электронная формула* | ls22s22p3 | [Ne] Ss2Sps | [Ar] 3d104s24p3 | [Кг] 4d105s25p3 | [Xe] 4/145d106s26p3 |
Электроотрицательность | 3,04 | 2,19 | 2,18 | 2,05 | 2,02 |
Возможные степени окисления | -3, -2, -1, 0, +1, +2, +3, +4, +5 | -3, -2, -1, 0, +1, +2, +3, +4, +5 | —3, 0, +3, +5 | —3, 0, +3, +5 | —3, 0, +3, +5 |
Свойства элементов | Неметалл | Неметалл | Неметалл | Металлоподобное вещество | Металл |
* [Ne], [Ar], [Кг], [Xe] — электронные конфигурации неона, аргона, криптона и ксенона.
Свойства оксидов и гидроксидов элементов V группы главной подгруппы
Степень окисления | Кислотные оксиды | Амфотерные оксиды | Основные оксиды | ||
Э+3 | N203 | f*2^3 (Р^б) | -A-SgOg | Sb2Og | Bi203 |
Э+5 | n2o5 | p2o5 | As205 | Sb205 | |
Кислотные свойства и устойчивость оксидов уменьшаются | |||||
с. о. | Кислоты | Амфотерные гидроксиды | Основания | ||
Э+3 | hno2 | H3PO3 | HgAsOg | Sb(OH)g | Ш(ОН)3 |
Э+5 | HNOg | Н3Р04 | H3As04 | В свободном состоянии не выделены | |
Кислотные свойства и устойчивость гидроксидов уменьшаются | |||||
W Азот и его соединения ^
Азот открыт английским химиком Даниелем Резерфордом в 1772 г. Имеет химический знак N (читается «эн»). Наибольшая часть азота находится в воздухе в свободном состоянии и составляет 78,1% по объёму. В связанном состоянии содержится в составе некоторых минералов: индийской (KN03), чилийской (NaN03) и норвежской (Ca(N03)2) селитр и аммиаке. Азот входит в состав всех живых организмов, его много в составе белков, аминокислот, аминов и нуклеиновых кислот. Он встречается и в космосе: входит в состав комет, газовых туманностей и атмосферы Солнца.
Атом азота имеет следующее строение внешнего энергетического уровня:
Степени окисления атома азота
Степень окисления | Соединения азота | Степень окисления | Соединения азота |
-3 | NH3, NH4C1 | +2 | NO |
-2 | n2h4 | +3 | n2o3, kno2,hno2 |
-1 | nh2oh | +4 | no2 |
+1 | n2o | +5 | n2o5, hno3 |
За счёт трёх неспаренных электронов атом азота может образовывать три ковалентные связи. Кроме этого, за счёт свободной электронной пары он может образовывать ещё одну связь по донорно-акцепторному механизму с атомом, имеющим свободную орбиталь. При образовании химических связей в различных молекулах атом азота может проявлять различные степени окисления (с. о.) (табл. 19).
Наиболее распространены степени окисления -3 (при этом атом азота притягивает при образовании связей три электрона от наименее электроотрицательных атомов, например, в NH3), +3 (в тех случаях, когда атом азота отдаёт 3 электрона более электроотрицательным атомам, например, в HN02) и +5 (азот отдаёт более электроотрицательным атомам все пять электронов, например в HN03).
ПРОСТОЕ ВЕЩЕСТВО (N2)
Строение
Как уже отмечалось, атом азота на внешнем энергетическом уровне имеет три неспаренных р-электрона, которые располагаются на jo-орбиталях. Они лежат перпендикулярно друг другу и имеют форму равноплечей восьмёрки (рис. 21, а).
При образовании молекулы азота (N2) р^-орбиталь одного атома перекрывается с рх-орбиталью другого атома. Область перекрывания орбиталей имеет повышенную электронную плотность, что приводит к образованию ковалентной связи. Химическая связь, в которой область перекрывания орбиталей лежит на линии, связывающей центры атомов, называется о (сигма)-связью. Две другие ру- и р2-орбитали одного атома перекрываются боковыми поверхностями с аналогичными орбиталями другого атома, при этом образуются две тг-связи. д-Связь это ковалентная связь, возникающая при перекрывании орбиталей по обе стороны от линии, связывающей центры атомов (рис. 21,6, в). Таким образом, в молекуле азота имеется одна о- и две тс-связи, т. е. возникает тройная связь (N=N). Вследствие этого молекула азота очень прочная, обладает низкой реакционной способностью, устойчива даже при температуре 3000 °С, энергия её диссоциации 940 кДж/моль.
Свойства
Молекулярный азот — газ без цвета и запаха, плохо растворим в воде, лучше растворим в органических растворителях.
Рис. 21. Строение молекулы азота: а — расположение электронных орбиталей в атоме азота; б — перекрывание электронных облаков в молекуле азота; в — образование л-связи
При нагревании, в присутствии катализаторов или под воздействием ионизирующего облучения азот вступает в реакции со многими металлами и неметаллами. Во всех реакциях азот выступает как окислитель, лишь с кислородом и фтором как восстановитель. При обычных условиях азот взаимодействует лишь с литием:
С остальными металлами в реакцию азот вступает при нагревании:
При нагревании до 500 °С, высоком давлении и в присутствии катализатора (Fe) азот вступает в реакцию с водородом:
При температуре электрической дуги реагирует с кислородом, а при 1000 °С с бором и кремнием:
Получение
Получают азот сжижением воздуха с последующим отделением путём испарения. Среди лабораторных способов необходимо отметить разложение нитрита аммония и восстановление азотной кислоты активными металлами:
Азот используется для получения аммиака, для создания инертной атмосферы в различных производствах, как наполнитель электрических ламп.
Источник
Малюгина 4. Структура периодической системы . Группы и подгруппы.
Периодическая система состоит из семи периодов, десяти рядов и восьми групп, каждая из которых делится на главную и побочную подгруппы.
Группа периодической системы химических элементов (ПСХЭ) — вертикальный ряд химических элементов, расположенных по возрастанию заряда атомного ядра, которые имеют одинаковую высшую валентность в их соединениях, равную номеру группы. Номер группы указывается римской цифрой.
Рис.1. Группы ПСХЭ

Например, атом натрия (Z=11) имеет высшую валентность I, т. к расположен в I группе ПСХЭ, а атом хлора (Z=17) – VII, т. к. расположен в VII группе.
Например, все элементы II группы имеют высшую валентность II, поэтому формула высших оксидов элементов II периода в общем виде RO (MgO, CaO, BaO, ZnO и т. п.). Все элементы IV периода проявляют высшую валентность равную IV, поэтому формула высших оксидов элементов IV периода в общем виде RO2 (CO2, SiO2, TiO2, GeO2, и т. п.).
Иключения составляют элементы, указанные в таблице 1.
Таблица 1
Номер группы | Элементы | Высшая валентность |
I | Cu Au | II III |
VI | O | II |
VII | H F | I I |
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A) и побочные (подгруппы В).
Главные подгруппы начинаются с элементов первого и второго периодов, побочные – с элементов IV периода.
Главная подгруппа содержит элементы малых и больших периодов. Побочная подгруппа содержит элементы только больших периодов.
Рис. 2. Главная и побочная подгруппа 1 группы
периодической системы

Рис. 3. Некоторые главные подгруппы ПСХЭ

Рис. 4. Некоторые побочные подгруппы ПСХЭ

В периодической системе – 8 главных и 10 побочных подгрупп (I – VII группы делятся на две подгруппы – главную и побочную). VIII группа состоит из одной главной (инертные газы) и трех побочных (подгруппа железа, подгруппа кобальта и подргуппа никеля).
Подгруппы также имеют названия по элементу с наименьшим порядковым номером (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп).
Например:
Номер подгруппы | IA | IВ | VIА | VIIА | VIIIА |
Название | Щелочные металлы | Подгруппа меди | Подгруппа кислорода | Галогены | Инертные элементы или благородные газы |
Элементы одной подгруппы обладают сходными химическими свойствами, т. к. элементы подгрупп сходны между собой по строению внешнего электронного уровня.
Закономерные изменения, наблюдаемые в главных подгруппах.
В каждой главной подгруппе сверху вниз происходит усиление металлических и ослабление неметаллических свойств, также усиливаются восстановительные и ослабевают окислительные свойства элементов и образуемых ими соединений.
Все элементы подочных подгрупп являются металлами.
Вопросы для самопроверки
1. Из каких структурных элементов состоит периодическая система химических элементов.
2. Что такое группа?
3. Сколько групп в периодической системе химических элементов?
4. Элементы каких периодов входят в главную подгруппу?
5. Сколько подгрупп в периодической системе?
6. Элементы каких периодов входят в побочные подгруппы?
7. На сколько подгрупп делится каждая группа?
8. Что общего у элементов одной группы?
9. Что общего у элементов одной подгруппы?
10. Как изменяются свойства элементов главных подгрупп сверху вниз?
11. Какими свойствами обладают элементы побочных подгрупп?
12. Какая группа содержит одну главную и три побочных подгруппы?
Посмотреть ответ
1. Из периодов, рядов, групп и подгрупп.
2. Группа — вертикальный ряд химических элементов, расположенных по возрастанию заряда атомного ядра, которые имеют одинаковую высшую валентность в их соединениях, равную номеру группы.
3. Восемь.
4. Малых и больших. Главная подгруппа начинается элементом малого периода (I или II). См. рис 3.
5. Десять.
6. Только больших. Главная подгруппа начинается с элемента IV периода. См. рис 4.
7. I – VII группы делятся на две подгруппы – главную и побочную. VIII группа состоит из одной главной – инертные газы и трех побочных: подгруппа железа, подгруппа кобальта и подргуппа никеля.
8. Как правило, высшая валентность элементов. Она равна номеру группы, в которой находится элемент.
9. Химические свойства, т. к. элементы подгрупп сходны между собой по строению внешнего электронного уровня.
10. В каждой главной подгруппе сверху вниз происходит усиление металлических и ослабление неметаллических свойств, также усиливаются восстановительные и ослабевают окислительные свойства элементов и образуемых ими соединений.
11. Металлическими.
12. Восьмая.
Задачи для самостоятельного решения.
1. В какой группе и подруппе находятся элементы с порядковыми номерами 6, 40, 26, 53, 80? Укажите их символ, русское название, относительную атомную массу.
2. Напишите символ, название, порядковый номер элемента и относительную атомную массу элемента, который находится: а) в III периоде, главной подгруппе VI группы; б) в V периоде, побочной группе II группы; в) в VI периоде, главной подгруппе IV группы;
г) в IV периоде, побочной группе VII группы.
3. Напишите символы, названия и порядковые номера всех элементов малых периодов, которые находятся в главной подгруппе IV группы.
4. Напишите символы, названия и порядковые номера всех элементов, которые находятся в побочной подгруппе II группы.
5. Какие элементы главной подгруппы V группы являются элементами больших периодов? Напишите их символы, русские названия и порядковые номера.
6. Какой элемент: кальций или барий имеет более выраженные металлические свойства и почему?
7. Какой элемент: сера или кислород имеет более выраженные неметаллические свойства и почему?
8. Какой элемент VII группы главной подгруппы является самым активным неметаллом? Почему?
9. Какой элемент I группы главной подгруппы является самым активным металлом? Почему?
10. В каких группах периодической системы все элементы являются металлами?
11. В какой группе всего один неметалл?
12. В каких группах периодической системы все элементы являются неметаллами?
13. Напишите форм, 25, 48, 13, в которых эти элементы имеют высшую валентность.
14. Напишите формулы оксидов всех элементов IV группы главной подгруппы, в которых эти имеют высшую валентность.
Посмотреть ответ
1. | Порядковый номер | 6 | 40 | 26 | 53 | 80 |
Символ элемента | C | Zr | Fe | I | Hg | |
Номер группы, подгруппа | VIA | IVВ | VIIIВ | VIIА | IIВ | |
Русское название | углерод | цирконий | железо | иод | ртуть | |
Относительная атомная масса | 12 | 91 | 56 | 127 | 201 |
2. | Условия (координаты клетки) | Порядковый номер | Символ | Русское название |
III период, главная подгруппа VI группы | 16 | S | сера | |
V период, побочная группа II группы; | 30 | Zn | цинк | |
VI период, главная подгруппа IV группы | 82 | Pb | свинец | |
IV период, побочная группа VII группы. | 25 | Mn | марганец |
3. Малые периоды I – III. В главную подгруппу IV группы из элементов малых периодов входят углерод C (Z=6) и кремний Si (Z=14).
4. Побочная подгруппа II группы: цинк Zn (Z=30), кадмий Cd (Z=48), ртуть Hg (Z=80) См. рис.4
5. Большие периоды IV – VII. В главную подгруппу V группы из элементов больших периодов входят входят мышьяк As (Z= 33), сурьма Sb (Z= 51), висмут Bi (Z= 83).
6. Барий. Смотрим ПСХЭ. Элементы находятся в одной главной подгруппе, а в главной подгруппе сверху вниз происходит усиление металлических свойств. Барий расположен ниже, чем кальций.
7. Кислород. Смотрим ПСХЭ. Элементы находятся в одной главной подгруппе, а в главной подгруппе сверху вниз происходит ослабление неметаллических свойств. Кислород расположен выше, чем сера.
8. Фтор. Смотрим ПСХЭ. В главной подгруппе сверху вниз происходит ослабление неметаллических свойств. Самый активный неметалл стоит в начале группы.
9. Франций. В главной подгруппе сверху вниз происходит усиливаются металлические свойства. Самый активный металл стоит в конце каждой группы.
10. I (если не считать водород, т. к. его положение неоднозначно) и II.
11. В III.
12. Такой группы нет, потому что все группы содержат побочные подгруппы, а все элементы побочных подгрупп – металлы.
13. | Следует по ПСХЭ определить номер группы. Высшая валентность = номеру группы. | ||||
Порядковый номер | 16 | 14 | 25 | 48 | 13 |
Символ элемента | S | Si | Mn | Cd | Al |
Номер группы, подгруппа | VI | IV | V | II | III |
Валентность | VI | IV | V | II | III |
Формула оксида | SO3 | SiO2 | Mn2O7 | CdO | Al2O3 |
14. Все элементы IV группы главной подгруппы имеют одинаковую валентность, равную номеру группы. Следовательно, общая формула оксидов этих элементов RO2, где R – это любой элемент IVА группы: СO2, SiO2, GeO2, SnO2, PbO2
Источник
Групповое сходство элементов обусловлено наличием 2-х спаренных электронов на внешнем электронном слое и заключается в следующем:
– постоянная валентность II
– постоянная степень окисления +2
– легкость образования 2-зарядных ионов Me+2
С ростом заряда ядра и радиуса атомов свойства элементов закономерно изменяются:
– энергия ионизации Еион уменьшается
– сродство атомов к электрону уменьшается
– электроотрицательность уменьшается
– металлические свойства усиливаются
По важнейшим атомным характеристикам и по физико-химическим свойствам металлов и их соединений наибольшим сходством между собой обладают Са, Sr , Ba , имеющие общее название – щелочноземельные металлы. Эти элементы имеют практически одинаковые значения ЭО, находятся рядом в электрохимическом ряду напряжений; химическая активность в целом от Са к Ва возрастает незначительно; они во многих отношениях сходны со щелочными металлами.
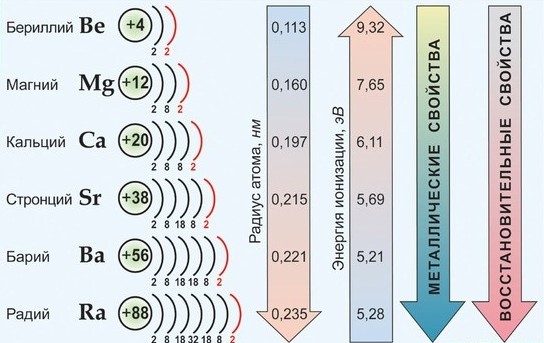
Среди s2-элементов резко выделяется бериллий, который обнаруживает более значительное сходство с алюминием (диагональное сходство). По распространенности в природе и по практической значимости важнейшими элементами являются Са и Mg.
В свободном состоянии в виде простых веществ все s2-элементы – белые твердые вещества с металлическим блеском на срезе, обладающие всеми общими свойствами металлов. Лишь бериллий хрупкий и плохо поддается обработке.
Оксиды | Гидроксиды | ||||
формула | характер | отношение к воде | формула | характер | отношение к воде |
ВеО | амфотерный | не растворимый, не взаимодействует | Ве(ОН)2 | амфотерный | не растворимый |
МgО | основный | не растворимый, не взаимодействует | Mg(ОН)2 | слабое основание | не растворимый |
СаО | основные | хорошо растворимые, взаимодействуют | Са(ОН)2 | сильные основания | мало растворимый |
SrO | Sr(ОН)2 | растворимый | |||
BaO | Bа(ОН)2 | растворимый | |||
Магний
12Mg [Ne]3s2
Ar 24.305
Изотопы 24Mg (78.60 %)
25Mg (10.11 %)
26Mg (11.29 %)
ЭО 1.2
E° -2,37 В
Кларк в земной коре 2,35 % по массе. В свободном виде не встречается. Является одним из самых распространенных породообразующих элементов (более 200 минералов). Основные из них:
– магнезит MgCO3
– доломит СаСО3 • МgСО3
– карналлит КСl • МgСl2 • 6Н2O
– горькая (английская) соль MgS04• 7H2O В виде катионов Mg2+ находится в природных водах (в 1 м3 морской воды содержится около 1 кг Mg2+). Наряду с ионами Са2+обусловливает жесткость воды.
Магний и его соединения играют важную роль в биологических процессах. В качестве комплексообразователя Mg входит в молекулы хлорофилла, а также в другие важные биокомплексы.
Магний – единственный элемент гл. подгр. II группы, применяемый в сравнительно больших количествах в металлическом состоянии (как свободный металл).
В чистом виде магний – блестящий серебристобелый металл, быстро тускнеющий на воздухе вследствие окисления. Это легкий, относительно мягкий и пластичный металл, легкоплавкий и обладающий хорошей электропроводностью. В сплавах с Al является основным конструкционным материалом в авиа-, судо- и ракетостроении.
1. Электролитический (основной). Электролизу подвергают тщательно обезвоженный расплав хлорида магния (t ≈ 800°C):
MgCl2 = Mg + Cl2↑
2. Карботермический (t ˃ 2000°C)
MgO + С = Mg↑(пары) + СО ↑
Mg – химически активный металл, особенно в порошкообразном состоянии или в виде ленты. Во всех реакциях магний ведет себя как очень сильный восстановитель:
Mg – 2e- → Mg2+.
Как и другие активные металлы, Mg взаимодействует с кислотами, растворами солей менее активных металлов, со многими неметаллами. Ниже приведены реакции, в которых проявляются некоторые особенности химического поведения магния.
Реакция сопровождается выделением болышого количества энергии. в т. ч в виде света. При этом ослепительно белое пламя обогащено фотохимически активными лучами (магниевая вспышка).
Происходит одновременное образование оксида и нитрида:
2Мg + О2 = 2МgО
ЗМg + N2 = Mg3N2
При обычной температуре Мg с водой не реагирует, так как сразу покрывается плотной пленкой – нерастворимым в воде Мg(ОН)2
1) Мg активно реагирует с кипящей водой:
Мg+ 2Н2O = Мg(ОН)2 + H2↑
2) особенно активно реагирует с водяным паром (Т > 380°С), поэтому совершенно недопустимо тушить горящий Мg водой – это может привести к взрыву.
3) Мд легко растворяется в воде в присутствии NH4CI:
Mg + 2Н2O+ 2NH4Cl = MgCl2 + H2↑ + 2NH3•Н2O
Протеканию реакции способствует кислая среда, образующаяся в результате гидролиза NH4Cl
Благодаря сильному сродству к кислороду Мg отнимает его у многих оксидов, например, зажженный Мg продолжает гореть в атмосфере CO2 восстанавливая его до свободного углерода:
2Мg + CO2 = 2МgО + С
См. «Основные способы получения металлов. Магнийтермия».
Мg + С2Н5Сl → С2Н5-Мg-Сl этилмагнийхлорид
Мg + С6Н5Br → С6Н5-Мg-Br фенилмагнийбромид
Образующиеся Мg-органические соединения носят общее название реактивов Гриньяра и широко используются в органическом синтезе.
Кальций
20Ca [Ar]4s2
Аr 40.08
Основные изотопы:
40Са (96.94 %)
44Са (2.09 %)
422Са (0.667 %)
ЭО 1.0
Е° -2.86 В
Один из основных породообразующих элементов; входит в состав многочисленных минералов в виде соединений:
– СаСО3 (мел, мрамор, известняк)
– СаСО3 • МgСО3 (доломит)
– CaSO4 (ангидрит)
– CaSO4• 2Н2O (гипс)
Кальций – один из самых активных металлов; во всех реакциях участвует как сильный восстановитель:
Са° – 2e- → Са2+
а) при горении на воздухе образуется преимущественно оксид;
2Са + O2 = 2СаО оксид
б) при Т – 500° частично происходит реакция с азотом:
ЗСа + N2 = Ca3N2 нитрид
Са + Cl2 = CaCI2 хлорид
в) взаимодействие с серой, фосфором, углеродом, кремнием:
Са + S = CaS сульфид
ЗСа + 2Р = Са3Р2 фосфид
Са + 2С = СаС2 карбид
Са + 2Si = CaSi 2 силицид
г) нагревание в струе Н2 сопровождается воспламенением:
Са + Н2 = СаН2 гидрид
(кроме HF и Н3РO4, из-за нерастворимости фторида CaF2 и фосфата Са3(РO4)2)
Са +2Н2O = Са(ОН)2 + Н2;
Са + 2HCl = СаСl2 + Н2
Са + 2СН3СООН → (СН3СОО)2Са+ H2;
4Са +10HNO3(разб) = 4Ca(NO3)2 + NH4NO3 + 3H2O
5Са + 12HNO3(конц) = 5Ca(NO3)2 + N2 + 6Н2O
ЗСа + 4H2SO4(конц) = 3CaSO4 + S + 4Н2O
Источник
