Какие общие физические свойства щелочных металлов
Щелочными металлами называются химические элементы-металлы (IA) группы Периодической системы Д. И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы (IA) характерна степень окисления (+1).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия (NaCl)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 (·) 10H2O,
- сильвин — хлорид калия (KCl),
- сильвинит — двойной хлорид калия-натрия (KCL) (·)(NaCl) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами (IA) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2H2O=2NaOH+H2↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
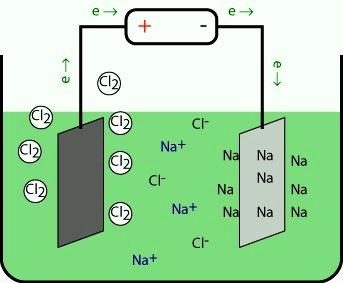
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод ((–)): 2Na++2e=2Na,
анод ((+)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
Источник
Щелочные металлы.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
К щелочным металлам относятся литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
Щелочные металлы
Строение атомов щелочных металлов
Физические свойства щелочных металлов
Химические свойства щелочных металлов
Щелочные металлы:
Щелочные металлы – это химические элементы 1-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации – элементы главной подгруппы I группы):
– литий Li,
– натрий Na,
– калий K,
– рубидий Rb,
– цезий Cs,
– франций Fr.
При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
Строение атомов щелочных металлов:
Особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Щелочные металлы относятся к элементам s-семейства.
Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия – самый низкий) и электроотрицательности. Как следствие, в большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов.
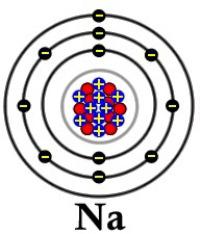
Так, электронная конфигурация атома лития 1s2 2s1. атом лития состоит из положительно заряженного ядра (+3), вокруг которого по атомным оболочкам (двум s-орбиталям) движутся три электрона. Поскольку литий расположен во втором периоде, оболочки всего две, одна из которых является внешней. При этом 2 электрона находятся на внутреннем уровне, а 1 электрон – на внешнем. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома цезия на 2s-орбитали находятся один неспаренный электрон. Электроны, расположенные на внешней оболочке, называются валентными и участвуют в образовании химических связей. В свою очередь ядро атома лития состоит из трех протонов и четырех нейтронов.
Радиус атома лития составляет 145 пм. Потенциал ионизации (первый электрон) атома лития равен 5,39 эВ (519,9 кДж/моль). Электроотрицательность атома лития равна 0,98 (шкала Полинга).
Электронная конфигурация атома натрия 1s2 2s2 2p6 3s1. Атом натрия состоит из положительно заряженного ядра (+11), вокруг которого по трем оболочкам движутся 11 электронов. При этом 10 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку натрий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома натрия – на 3s-орбитали находится один неспаренный электрон. В свою очередь ядро атома натрия состоит из 11 протонов и 12 нейтронов.
Радиус атома натрия составляет 190 пм. Потенциал ионизации атома натрия равен 5,14 эВ (495,6 кДж/моль). Электроотрицательность атома натрия равна 0,93 (шкала Полинга).
Электронная конфигурация атома калия 1s2 2s2 2p6 3s2 3p6 4s1. Атом калия состоит из положительно заряженного ядра (+19), вокруг которого по четырем оболочкам движутся 19 электронов. При этом 18 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку калий расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и третья – внутренние оболочки представлена s- и р-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома калия – на 4s-орбитали находится один неспаренный электрон. В свою очередь ядро атома калия состоит из 19 протонов и 20 нейтронов.
Радиус атома калия составляет 235 пм. Потенциал ионизации атома калия равен 4,34 эВ (418,5 кДж/моль). Электроотрицательность атома калия равна 0,82 (шкала Полинга).
Электронная конфигурация атома рубидия 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s1. Атом рубидия состоит из положительно заряженного ядра (+37), вокруг которого по пяти оболочкам движутся 37 электронов. При этом 36 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку рубидий расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и четвертая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома рубидия на 5s-орбитали находится один неспаренный электрон. В свою очередь ядро атома рубидия состоит из 37 протонов и 48 нейтронов.
Радиус атома рубидия составляет 248 пм. Потенциал ионизации атома рубидия равен 4,17 эВ (402,8 кДж/моль). Электроотрицательность атома рубидия равна 0,82 (шкала Полинга).
Электронная конфигурация атома цезия 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s1. Атом цезия состоит из положительно заряженного ядра (+55), вокруг которого по шести оболочкам движутся 55 электронов. При этом 54 электрона находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку цезий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и пятая – внутренние оболочки представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома цезия на 6s-орбитали находятся один неспаренный электрон. В свою очередь ядро атома цезия состоит из 55 протонов и 78 нейтронов.
Радиус атома цезия составляет 267 пм. Потенциал ионизации атома цезия равен 3,89 эВ (375,5 кДж/моль). Электроотрицательность атома цезия равна 0,79 (шкала Полинга).
С увеличением порядкового номера у щелочных металлов увеличиваются радиус атома, способность отдавать валентные электроны и восстановительная активность, уменьшается электроотрицательность и энергия ионизации.
Физические свойства щелочных металлов:
Все щелочные металлы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень легкие, мягкие и пластичные, их можно резать скальпелем и ножом. Щелочные металлы имеют небольшую плотность. Так, литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней. Щелочные металлы обладают высокой тепло- и электропроводностью. Они имеют низкую температуру плавления и кипения.
С увеличением порядкового номера у щелочных металлов уменьшаются плотность, температура плавления, температура кипения, твердость.
Химические свойства щелочных металлов:
Все щелочные металлы обладают высокой химической активностью. Они проявляют высокую химическую активность при взаимодействии с водой, кислородом, галогенами и другими соединениями. Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. В соединениях щелочные металлы проявляют единственную степень окисления +1. Все соединения щелочных металлов носят ионный характер. Почти все соединения растворимы в воде.
С увеличением порядкового номера у щелочных металлов усиливаются металлические свойства и ослабевают неметаллические свойства, увеличивается восстановительная способность, возрастает химическая активность их щелочей.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
383
Источник
Щелочные металлы — общее название элементов 1-й группы периодической системы химических элементов. Ее состав: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr), и гипотетический элемент — унуненний (Uue). Наименование группы произошло от названия растворимых гидроксидов натрия и калия, обладающих реакцией и вкусом щелочи. Рассмотрим общие черты строения атомов элементов, свойства, получение и применение простых веществ.
Устаревшая и новая нумерация группы
По устаревшей системе нумерации щелочные металлы, занимающие крайний слева вертикальный столбец таблицы Менделеева, относятся к I-А группе. В 1989 году в качестве основного Международный химический союз (IUPAC) предложил иной вариант (длиннопериодный). Щелочные металлы в соответствии с новой классификацией и сплошной нумерацией относятся к 1-й группе. Открывает эту совокупность представитель 2-го периода — литий, завершает ее радиоактивный элемент 7-го периода — франций. У всех металлов 1-й группы во внешней оболочке атомов содержится один s-электрон, который они легко отдают (восстанавливаются).
Строение атомов щелочных металлов
Для элементов 1-й группы характерно наличие второго энергетического уровня, повторяющего строение предшествующего инертного газа. У лития на предпоследнем слое — 2, у остальных — по 8 электронов. В химических реакциях атомы легко отдают внешний s-электрон, приобретая энергетически выгодную конфигурацию благородного газа. Элементы 1-й группы обладают малыми величинами энергии ионизации и электроотрицательности (ЭО). Они легко образуют однозарядные положительные ионы. При переходе от лития к францию возрастает количество протонов и электронов, радиус атома. Рубидий, цезий и франций легче отдают внешний электрон, чем предшествующие им в группе элементы. Следовательно, в группе сверху вниз увеличивается восстановительная способность.
Содержание в земной коре
Легкая окисляемость щелочных металлов приводит к тому, что элементы 1-й группы существуют в природе в виде соединений своих однозарядных катионов. Содержание в земной коре натрия — 2,0%, калия — 1,1%. Другие элементы в ней находятся в малых количествах, например, запасы франция — 340 г. Хлорид натрия растворен в морской воде, рапе соленых озер и лиманов, образует залежи каменной или поваренной соли. Вместе с галитом встречаются сильвинит NaCl • KCl и сильвин KCl. Полевой шпат образован алюмосиликатом калия K2[Al2Si6O16]. В воде ряда озер растворен карбонат натрия, а запасы сульфата элемента сосредоточены в акватории Каспийского моря (Кара-Богаз-Гол). Встречаются залежи нитрата натрия в Чили (чилийская селитра). Существует ограниченное число природных соединений лития. В качестве примесей к соединениям элементов 1-й группы встречаются рубидий и цезий, а франций находят в составе урановых руд.
Последовательность открытия щелочных металлов
Британский химик и физик Г. Дэви в 1807 году провел электролиз расплавов щелочей, впервые получив натрий и калий в свободном виде. В 1817 году шведский ученый Иоганн Арфведсон открыл элемент литий в минералах, а в 1825-м Г. Дэви выделил чистый металл. Рубидий был впервые обнаружен в 1861 году Р. Бунзеном и Г. Кирхгофом. Немецкие исследователи анализировали состав алюмосиликатов и получили в спектре красную линию, соответствующую новому элементу. В 1939 году сотрудница Парижского института радиоактивности Маргарита Пере установила существование изотопа франция. Она же дала название элементу в честь своей родины. Унуненний (эка-франций) — предварительное название нового вида атомов с порядковым номером 119. Временно используется химический символ Uue. Исследователи с 1985 года предпринимают попытки синтеза нового элемента, который станет первым в 8-м периоде, седьмым в 1-й группе.
Физические свойства щелочных металлов

Почти все щелочные металлы обладают серебристо-белым цветом и металлическим блеском на свежем срезе (цезий имеет золотисто-желтую окраску). На воздухе блеск тускнеет, появляется серая пленка, на литии — зеленовато-черная. Этот металл обладает наибольшей твердостью среди соседей по группе, но уступает тальку — самому мягкому минералу, открывающему шкалу Мооса. Натрий и калий легко сгибаются, их можно разрезать. Рубидий, цезий и франций в чистом виде представляют тестообразную массу. Плавление щелочных металлов происходит при относительно низкой температуре. Для лития она достигает 180,54 °С. Натрий плавится при температуре 97,86 °С, калий — при 63,51 °С, рубидий — при 39,32 °С, цезий — при 28,44 °С. Плотность щелочных металлов меньше, чем родственных им веществ. Литий плавает в керосине, поднимается на поверхность воды, калий и натрий также всплывают в нем.
Кристаллическое состояние
Кристаллизация щелочных металлов происходит в кубической сингонии (объемно-центрированной). Атомы в ее составе обладают зоной проводимости, на свободные уровни которой могут переходить электроны. Именно эти активные частицы осуществляет особую химическую связь — металлическую. Общность строения энергетических уровней и природа кристаллических решеток объясняют сходство элементов 1-й группы. При переходе от лития к цезию возрастают массы атомов элементов, что приводит к закономерному увеличению плотности, а также к изменению других свойств.
Химические свойства щелочных металлов
Единственный внешний электрон в атомах щелочных металлов слабо притягивается к ядру, поэтому им свойственна низкая энергия ионизации, отрицательное или близкое к нулю сродство к электрону. Элементы 1-й группы, обладая восстановительной активностью, практически не способны окислять. В группе сверху вниз возрастает активность в химических реакциях:
- Натрий, калий и литий при небольшом нагревании загораются на воздухе. Для первых двух металлов характерно образование в этой реакции пероксидов и надпероксидов, а для лития — оксида Li2O. Рубидий и цезий на воздухе самовоспламеняются.
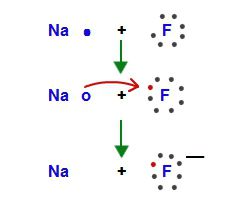
Щелочные металлы способны восстанавливать даже водород. При нагревании взаимодействуют с атомами самого легкого элемента и восстанавливают его до отрицательно заряженного иона H-. В реакции получаются гидриды, например, NaH, KH.
- Простые вещества, соответствующие элементам 1-й группы, взаимодействуют с водой и образуют щелочи, например, LiOH, NaOH, KOH. Процесс сопровождается выделением газообразного водорода, который самовоспламеняется или взрывается. 2Na + 2H2O = 2NaOH + H2↑. Рубидий и цезий вступают в реакцию даже со льдом. Хранение щелочных металлов допускается под слоем минерального масла, в керосине, в запаянных стеклянных сосудах.
- Активно взаимодействуют металлы 1-й группы с галогенами, особенно энергично происходит реакция с фтором и хлором, при нагревании — с серой и фосфором. Большинство получившихся солей обладает хорошей растворимостью.
- Качественная реакция — разложение солей щелочных металлов в огне газовой горелки. Пары окрашивают пламя в определенный цвет.
- При взаимодействии щелочных металлов со спиртами получаются алкоголяты, с карбоновыми кислотами они дают соответствующие соли, например, формиат натрия.
Получение и применение щелочных металлов
Металлы, относящиеся к 1-й группе, в промышленности получают электролизом расплавов их галогенидов и других природных соединений. При разложении под действием электрического тока положительные ионы на катоде присоединяют электроны и восстанавливаются до свободного металла. На противоположном электроде происходит окисление аниона.

При электролизе расплавов гидроксидов на аноде окисляются частицы OH-, выделяется кислород и получается вода. Еще один метод заключается в термическом восстановлении щелочных металлов из расплавов их солей кальцием. Простые вещества и соединения элементов 1-й группы имеют практическое значение. Литий служит сырьем в атомной энергетике, используется в ракетной технике. В металлургии применяется для удаления остатков водорода, азота, кислорода, серы. Гидроксидом дополняют электролит в щелочных аккумуляторах.

Натрий необходим для атомной энергетики, металлургии, органического синтеза. Цезий и рубидий используются при изготовлении фотоэлементов. Широкое применение находят гидроксиды и соли, особенно хлориды, нитраты, сульфаты, карбонаты щелочных металлов. Катионы обладают биологической активностью, особенно важны для организма человека ионы натрия и калия.
Источник
