Какие неорганические вещества содержатся в живых организмах

Вопрос 1. Какие вещества называют неорганическими?
Неорганические вещества — простые вещества и соединения, не являющиеся органическими, т. е. не содержащие углерода, а также некоторые углеродосодержащие соединения (карбиды, цианиды, карбонаты, оксиды углерода и некоторые другие вещества, которые традиционно относят к неорганическим).
Вопрос 2. Какие известные вам организмы содержат много воды?
Алоэ, кактусы, водоросли, медуза, в плодах огурцов и др.
Вопрос 3. Какие неорганические вещества мы употребляем в пищу? Почему?
Воду, минеральные вещества (кальций, магний, йод, фосфор, медь и др.). Они способствуют проникновению веществ в клетки организма, протекание ферментативных и пластических процессов, участвуют в формировании и построении тканей, поддерживают осмотическое давление крови, активируют проведение возбуждения и импульсов, способствуют свертыванию крови и т. д.
Вопрос 4. Какие неорганические вещества содержатся в живых организмах?
Вода, соли минеральных кислот и соответствующие катионы и анионы.
Вопрос 5. Что определяет уникальные физические и химические свойства воды, столь важные для существования живой материи?
Уникальные физические и химические свойства воды определяются особенностями структуры её молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода.
Вопрос 6. Какие химические связи называют водородными?
Водородные связи — это такие связи, которые возникают между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Вопрос 7. Какие физико — химические свойства воды наиболее важны для обеспечения жизнедеятельности клеток и многоклеточных организмов в разных условиях?
Высокая теплоёмкость (способность поглощать тепло при незначительном изменении собственной температуры) воды предохраняет клетку от резких температурных колебаний, а высокая теплопроводность обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна.
Для живых организмов весьма важно ещё и то, что молекулы воды являются диполями. Дипольный характер молекулы воды определяет её способность ориентироваться в электрическом поле. Именно это свойство воды определяет её уникальность как растворителя.
Вопрос 8. В каких растворителях могут растворяться гидрофобные вещества, а в каких — гидрофильные? Какие растворители вам известны?
Гидрофильные вещества легко разрушается в воде, гидрофобные — в бензине или в бензоле.
Вопрос 9. Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.


Вопрос 10. Прочитайте статью «Сахар против льда» и на основе анализа полученной информации предложите свои способы борьбы с гололёдом на дорогах.
При повышении безопасности дорожного движения в снежное время года, мы не должны забывать об экологической обстановке.
Сахар — это интересно, экологично, но скорее всего дорого.
Учитывая все недостатки при использовании соли и солевых растворов, связанных с их негативным воздействием на окружающую среду, наиболее целесообразным является способ предупреждения образования гололеда за счет создания покрытий автомобильных дорог, обладающих противо — гололедными свойствами, что делает возможным механическое удаление снежно — ледяных отложений снегоуборочной техникой и исключения отрицательного воздействия химических реагентов на окружающую среду.
1. К одному из способов образования антигололедных покрытий, разработанному в Словакии, относится «Соленый бетон». Антигололедная добавка с рабочим названием «Соленый бетон» представляет собой обработанные кристаллы против гололедного вещества (NaCl), введенные в минеральную часть асфальтобетона. Минеральная оболочка соли (NaCl) формируется из цемента, мелкозернистого известнякового порошка и дробленого песка. Введение добавки в количестве около 10 % по массе минерального материала является достаточным для достижения желаемого эффекта. При температуре около — 4°С небольшое количество соли (приблизительно 1 %) расплавляет тонкие слои снега. При температуре более низкой (ниже — 4°С) плотность льда нарушается; лед ломается и удаляется с поверхности дороги под действием колес транспортных средств. Если температура особенно низкая ( — 10°С), эффект «Соленого бетона» снижается, но сохраняется возможность достаточно простой очистки поверхности дороги с использованием дорожной щетки и отвала.
2. В Уральском государственном лесотехническом университете (УГЛТУ) для повышения противогололедных свойств асфальтобетона разработан кремнийорганический модификатор МПА — 130, не содержащий хлоридов. Устройство верхнего антигололедного слоя дорожного покрытия на основе гидрофобизирующего модификатора, не содержащего хлоридов, на автомобильных дорогах позволит вести активную борьбу с гололедом, благодаря чему повысится коэффициент сцепления колес автомобилей с дорожным покрытием и будет обеспечена нормальная работа транспорта. Кроме того, применение таких покрытий позволит улучшить экологическую обстановку придорожной полосы за счет отказа от применения хлоридов.
Вопрос 11. Уникальные свойства воды определяются в том числе существованием между её молекулами водородных связей. Возможно ли существование таких связей между молекулами других веществ?
Механизм возникновения водородной связи — частично электростатический и частично донорно — акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15 — 20 раз).
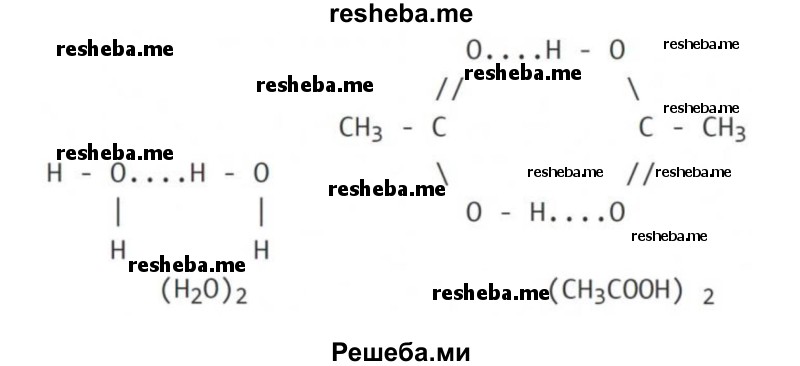
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
Вопрос 12. Что произойдёт с клеткой, если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её?
От концентрации солей внутри и снаружи клетки зависят буферные свойства цитоплазмы клетки. Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет.
Вопрос 13. Используя доступные информационные источники, уточните, какие условия проведения эксперимента в естественных науках (давление, температура и др.) считаются нормальными. Обсудите с учителем и одноклассниками, почему при нормальных условиях вода (Н20) — это жидкость, а сероводород (H2S) — газ.
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии) следующим образом:
Атмосферное давление 101325 Па = 760 мм рт. ст.
Температура воздуха 273,15 K = 0° C.
При нормальных условиях объём 1 моля идеального газа составляет 22,413 996(39) дм³ (молярный объём идеального газа), а количество молекул в 1 см³ составляет 2,686 7774(47)×1019 (постоянная Лошмидта).
Также в справочниках в качестве стандартных условий может указываться температура 298 K, либо +25 °С (298,15 К). Однако такая температура не установлена IUPAC в качестве стандартной, поэтому при использовании справочных данных всякий раз необходимо уточнять, при каких значениях приводятся величины.
Например, Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Вода (Н20) — это жидкость, а сероводород (H2S) — газ. Электроотрицательность кислорода выше, чем серы, электронная плотность в молекуле воды более смещена от водорода к кислороду, чем от водорода к сере, в молекуле сероводорода. Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ.
Или такой ответ, сформулированный иначе: кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Источник
Введение
Биология — наука о жизни. Важнейшая задача биологии — изучение многообразия, строения, жизнедеятельности, индивидуального развития и эволюции живых организмов, их взаимоотношений со средой обитания.
Живые организмы имеют ряд особенностей, отличающих их от неживой природы. По отдельности каждое из отличий достаточно условно, поэтому их следует рассматривать в комплексе.
Признаки, отличающие живую материю от неживой:
- способность к размножению и передаче наследственной информации следующему поколению;
- обмен веществ и энергии;
- возбудимость;
- адаптированность к конкретным условиям обитания;
- строительный материал — биополимеры (важнейшие из них — белки и нуклеиновые кислоты);
- специализация от молекул до органов и высокая степень их организации;
- рост;
- старение;
- смерть.
Уровни организации живой материи:
- молекулярный,
- клеточный,
- тканевой,
- органный,
- организменный,
- популяционно-видовой,
- биогеоценотический,
- биосферный.
Многообразие жизни
Живые организмы, имеющие клеточное строение, подразделяются на две группы: 1) прокариоты (отсутствует структурно оформленное ядро), 2) эукариоты (имеется структурно оформленное ядро). К прокариотам относятся бактерии, к эукариотам — растения, животные, грибы. Кроме выше перечисленных, существует группа организмов, не имеющих клеточного строения, — вирусы, которые могут размножаться, только паразитируя или в прокариотических, или в эукариотических клетках.
Первыми на нашей планете появились безъядерные клетки. Большинством ученых принимается, что ядерные организмы появились в результате симбиоза древних архебактерий с синезелеными водорослями и бактериями-окислителями (теория симбиогенеза).
Цитология
Цитология — наука о клетке. Изучает строение и функции клеток одноклеточных и многоклеточных организмов. Клетка является элементарной единицей строения, функционирования, роста и развития всех живых существ. Поэтому процессы и закономерности, характерные для цитологии, лежат в основе процессов, изучаемых многими другими науками (анатомия, генетика, эмбриология, биохимия и др.).
Химические элементы клетки
Химический элемент — определенный вид атомов с одинаковым положительным зарядом ядра. В клетках обнаружено около 80 химических элементов. Их можно разделить на четыре группы:
1 группа — углерод, водород, кислород, азот (98% от содержимого клетки),
2 группа — калий, натрий, кальций, магний, сера, фосфор, хлор, железо (1,9%),
3 группа — цинк, медь, фтор, йод, кобальт, молибден и др. (меньше 0,01%),
4 группа — золото, уран, радий и др. (меньше 0,00001%).
Элементы первой и второй групп в большинстве пособий называют макроэлементами, элементы третьей группы — микроэлементами, элементы четвертой группы — ультрамикроэлементами. Для макро- и микроэлементов выяснены процессы и функции, в которых они участвуют. Для большинства ультрамикроэлементов биологическая роль не выявлена.
| Химический элемент | Вещества, в которых химический элемент содержится | Процессы, в которых химический элемент участвует |
|---|---|---|
| Углерод, водород, кислород, азот | Белки, нуклеиновые кислоты, липиды, углеводы и др. органические вещества | Синтез органических веществ и весь комплекс функций, осуществляемых этими органическими веществами |
| Калий, натрий | Na+ и K+ | Обеспечивание функции мембран, в частности, поддержание электрического потенциала клеточной мембраны, работы Na+/Ka+-насоса, проведение нервных импульсов, анионный, катионный и осмотический балансы |
| Кальций | Са+2 | Участие в процессе свертывания крови |
| Фосфат кальция, карбонат кальция | Костная ткань, зубная эмаль, раковины моллюсков | |
| Пектат кальция | Формирование срединной пластинки и клеточной стенки у растений | |
| Магний | Хлорофилл | Фотосинтез |
| Сера | Белки | Формирование пространственной структуры белка за счет образования дисульфидных мостиков |
| Фосфор | Нуклеиновые кислоты, АТФ | Синтез нуклеиновых кислот |
| Хлор | Cl- | Поддержание электрического потенциала клеточной мембраны, работы Na+/Ka+-насоса, проведение нервных импульсов, анионный, катионный и осмотический балансы |
| HCl | Активизация пищеварительных ферментов желудочного сока | |
| Железо | Гемоглобин | Транспорт кислорода |
| Цитохромы | Перенос электронов при фотосинтезе и дыхании | |
| Марганец | Декарбоксилазы, дегидрогеназы | Окисление жирных кислот, участие в процессах дыхания и фотосинтеза |
| Медь | Гемоцианин | Транспорт кислорода у некоторых беспозвоночных |
| Тирозиназа | Образование меланина | |
| Кобальт | Витамин В12 | Формирование эритроцитов |
| Цинк | Алькогольдегидрогеназа | Анаэробное дыхание у растений |
| Карбоангидраза | Транспорт СО2 у позвоночных | |
| Фтор | Фторид кальция | Костная ткань, зубная эмаль |
| Йод | Тироксин | Регуляция основного обмена |
| Молибден | Нитрогеназа | Фиксация азота |
Атомы химических элементов в живых организмах образуют неорганические (вода, соли) и органические соединения (белки, нуклеиновые кислоты, липиды, углеводы). На атомном уровне различий между живой и неживой материей нет, различия появятся на следующих, более высоких, уровнях организации живой материи.
Вода
Вода — самое распространенное неорганическое соединение. Содержание воды составляет от 10% (зубная эмаль) до 90% массы клетки (развивающийся эмбрион). Без воды жизнь невозможна, биологическое значение воды определяется ее химическими и физическими свойствами.
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Та часть молекулы, где находится водород, заряжена положительно, часть, где находится кислород, — отрицательно, в связи с этим молекула воды является диполем. Между диполями воды образуются водородные связи. Физические свойства воды: прозрачна, максимальная плотность — при 4 °С, высокая теплоемкость, практически не сжимается; чистая вода плохо проводит тепло и электричество, замерзает при 0 °С, кипит при 100 °С и т.д. Химические свойства воды: хороший растворитель, образует гидраты, вступает в реакции гидролитического разложения, взаимодействует со многими оксидами и т.д. По отношению к способности растворяться в воде различают: гидрофильные вещества — хорошо растворимые, гидрофобные вещества — практически нерастворимые в воде.
Биологическое значение воды:
- является основой внутренней и внутриклеточной среды,
- обеспечивает поддержание пространственной структуры,
- обеспечивает транспорт веществ,
- гидратирует полярные молекулы,
- служит растворителем и средой для диффузии,
- участвует в реакциях фотосинтеза и гидролиза,
- способствует охлаждению организма,
- является средой обитания для многих организмов,
- способствует миграциям и распространению семян, плодов, личиночных стадий,
- является средой, в которой происходит оплодотворение,
- у растений обеспечивает транспирацию и прорастание семян,
- способствует равномерному распределению тепла в организме и мн. др.
Купить проверочные работы
по биологии




Другие неорганические соединения клетки
Другие неорганические соединения представлены в основном солями, которые могут содержаться или в растворенном виде (диссоциированными на катионы и анионы), или твердом. Важное значение для жизнедеятельности клетки имеют катионы K+, Na+, Ca2+, Mg2+ (см. таблицу выше) и анионы HPO42—, Cl—, HCO3—, обеспечивающие буферные свойства клетки. Буферность — способность поддерживать рН на определенном уровне (рН — десятичный логарифм величины, обратной концентрации водородных ионов). Величина рН, равная 7,0, соответствует нейтральному, ниже 7,0 — кислому, выше 7,0 — щелочному раствору. Для клеток и тканей характерна слабощелочная среда. За поддержание этой слабощелочной реакции отвечают фосфатная (1) и бикарбонатная (2) буферные системы:
| Низкий рН | ⇔ | Высокий рН | (1) |
| НРО42— + Н+ | Н2РО4— | ||
| Гидрофосфат | Дигидрофосфат | ||
| Низкий рН | ⇔ | Высокий рН | (2) |
| НCО3— + Н+ | Н2CО3 | ||
| Гидрокарбонат | Угольная кислота | ||
В твердом нерастворенном состоянии находятся в костной ткани, в раковинах моллюсков карбонаты и фосфаты кальция и магния, в зубной эмали — фторид кальция и т.д.
Перейти к лекции №2 «Строение и функции углеводов и липидов»
Смотреть оглавление (лекции №1-25)
Источник
Вспомните вещества, необходимые организмам для их жизнедеятельности. Какую роль играют водные растворы в природе и в жизни человека? Какой тип химической связи существует в молекуле воды? Что такое ионы и как они образуются?
Химические элементы живых организмов
В состав растительных и животных клеток входит более 70 химических элементов. Но в клетке нет каких-либо особенных элементов, характерных только для живой природы. Те же элементы встречаются и в неживой природе.
Все химические элементы по содержанию в живой клетке разделяют на три группы: макроэлементы, микроэлементы и ультрамикроэлементы.
Содержание химических элементов в живых клетках

Элементы O, C, H, N иногда рассматривают как отдельную группу органогенных элементов ввиду того, что они входят в состав всех органических веществ и составляют до 98 % массы живой клетки.
Неорганические вещества живых организмов
Изучая химию, вы узнали о таких группах веществ, как кислоты, соли, оксиды и др. Все они распространены в неживой природе, вне живых организмов. Поэтому их и называют неорганическими веществами. Но это не означает, что в живых организмах их вообще нет. Они есть и играют очень важную роль в процессах жизнедеятельности.
Неорганические вещества обычно попадают в живые организмы из внешней среды с пищей (у животных) или с раствором воды через поверхность организма (у растений, грибов и бактерий). Но в некоторых случаях живые организмы могут синтезировать их самостоятельно. Например, клетки желудка у позвоночных синтезируют хлоридную кислоту. Это позволяет более эффективно переваривать пищу, так как многие пищеварительные ферменты работают в кислой среде. Также самостоятельно вырабатывают сульфатную кислоту многие хищные моллюски в своих слюнных железах. Эта кислота может разрушать раковины и внешние покровы их жертв.
Функции неорганических веществ в клетке
Неорганические вещества | Функции в клетке |
Катионы Гидрогена (H+) | Обеспечивают кислотно-щелочной баланс (поддерживают постоянство внутриклеточной среды) |
Катионы и анионы растворимых солей (Na+, K+, Cl) | Создают разность потенциалов между содержимым клетки и внеклеточной средой, обеспечивая проведение нервного импульса |
Слаборастворимые соли Кальция и Фосфора | Образуют опорные структуры (например, в костях позвоночных) |
Ионы металлических элементов | Являются компонентами многих гормонов, ферментов и витаминов или участвуют в их активации |
Сложные неорганические соединения Нитрогена, Кальция и Фосфора | Участвуют в синтезе органических молекул |
Неорганические соединения могут находиться в живых организмах как в растворенном (в виде ионов), так и в нерастворенном виде. Растворенными формами представлены многие соли.
Нерастворимые неорганические соединения также важны для живых организмов. Например, соли Кальция и Фосфора входят в состав скелета животных и обеспечивают его прочность (рис. 2.1, с. 10). Без таких веществ невозможно формирование здоровых зубов у человека.

Из неорганических веществ также могут быть образованы различные структуры организмов животных (рис. 2.2).
Свойства воды
Свойства воды обусловлены особенностями строения ее молекулы, а также связями молекул друг с другом.
Как вы уже знаете, в молекуле воды (химическая формула — H2O) между атомами Гидрогена и Оксигена существует ковалентная полярная связь (рис. 2.3). Это значит, что на атоме Оксигена формируется частичный отрицательный заряд (S-), а на атомах Гидрогена — положительный (S+). Положительно заряженный атом Гидрогена одной молекулы воды притягивается к отрицательно заряженному атому Оксигена другой молекулы воды. Такая связь называется водородной.
Водородная связь примерно в 15-20 раз слабее ковалентной. Поэтому водородная связь относительно легко разрывается, что происходит, например, при испарении воды. В жидком состоянии водородные связи между молекулами воды все время то разрываются, то образуются заново.

Биологическая роль воды
В живых организмах вода выполняет много функций: среды-растворителя, транспортную, метаболическую, терморегуляторную, структурную.
Вода является универсальным растворителем. Вещества, участвующие в большинстве биологических реакций, находятся в организме в водном растворе.
Транспортная роль воды очень важна для клеток и организмов в целом. Растворенные вещества вместе с водой могут переноситься из одних частей клетки в другие. А между различными частями многоклеточных организмов они переносятся в составе специальных жидкостей (например, в составе крови). Испарение воды листьями растений вызывает ее движение от корней вверх. При этом перемещаются и вещества, растворенные в воде.
Молекулы воды выполняют метаболическую функцию, когда участвуют в реакциях обмена веществ (их называют биохимическими реакциями). Терморегуляторная функция воды чрезвычайно важна для поддержания температуры тела организмов. Когда, например, человек потеет, то вода испаряется, снижая температуру его тела.
Структурная функция воды хорошо видна на примере растений и некоторых беспозвоночных животных. Растения поддерживают форму листьев и травянистых стеблей благодаря повышенному давлению в клетках, наполненных водой. А у многих червей форма тела поддерживается повышенным давлением воды в полостях тела.
В живых организмах содержатся как органические, так и неорганические вещества. Неорганические вещества — это вода, соли, кислоты и другие соединения. Они играют важную роль в жизнедеятельности живых организмов. Вода создает среду, в которой происходят реакции обмена веществ. Другие неорганические вещества участвуют в формировании скелета, работе нервной, пищеварительной и других систем организма.
Проверьте свои знания
1. Какие неорганические вещества встречаются в живых организмах? 2. Докажите на примерах, что свойства воды имеют большое значение для живых клеток. 3. Какие функции могут выполнять кислоты в живых организмах? 4*. К каким последствиям для организма человека может привести потеря солей Na?
Это материал учебника Биология 9 класс Задорожный
Источник

