Какие неорганические соединения проявляют амфотерные свойства
Амфотерность (от др.-греч. амфотеро — «двойственный»,
«обоюдный») — способность некоторых соединений проявлять в зависимости от
условий как кислотные, так и основные свойства.
Понятие амфотерность как характеристика
двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л.
Тенаром.
Амфотерными называются
оксиды и гидроксиды, которые проявляют и основные и кислотные свойства в
зависимости от условий.
Наиболее
часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды):
ZnO,
Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO,
Sn(OH)2, Al2O3, Al(OH)3, Fe2O3,
Fe(OH)3, Cr2O3, Cr(OH)3
Свойства амфотерных соединений
запомнить не сложно: они взаимодействуют с
ОСНОВНЫЕ СВОЙСТВА
При взаимодействии с кислотами все просто. Амфотерные соединения ведут себя как основания:
Оксиды:
Al2O3 + 6HCl =
2AlCl3 + 3H2O;
ZnO + H2SO4 = ZnSO4 +
H2O;
BeO + HNO3 = Be(NO3)2 +
H2O
Гидроксиды:
Fe(OH)3 + 3HCl = FeCl3 +
3H2O;
Pb(OH)2 + 2HCl = PbCl2 +
2H2O
Таким образом, при описании основных свойств записывают хорошо знакомые уравнения реакций обмена.
КИСЛОТНЫЕ СВОЙСТВА
Сложней для понимания реакция со щелочью. Рассмотрим на примере взаимодействия гидроксида цинка с гидроксидом калия при сплавлении. Амфотерные соединения взаимодействуя с основаниями, ведут себя как кислоты. Вот и запишем гидроксид
цинка Zn(OH)2 как
кислоту. У кислоты водород спереди, вынесем его: H2ZnO2. И реакция щелочи с гидроксидом будет протекать как будто он –
кислота. «Кислотный остаток» ZnO22- двухвалентный:
2KOH(тв.) + H2ZnO2(тв.) = K2ZnO2 + 2H2O
Полученное
вещество K2ZnO2 называется метацинкат калия (или просто
цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» H2ZnO2 (солями такие соединения называть не совсем правильно, но
для собственного удобства мы про это забудем).
Гидроксид цинка записывать в виде H2ZnO2 не принято. Пишем как обычно Zn(OH)2,
но подразумеваем (для собственного удобства), что это кислота H2ZnO2:
2KOH(тв.) + Zn(OH)2(тв.)
= K2ZnO2 + 2H2O
С гидроксидами при сплавлении, в которых
2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) =Na2BeO2 + 2H2O (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) = Na2PbO2 + 2H2O (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя OH– группами (Al(OH)3, Cr(OH)3, Fe(OH)3) немного
иначе.
Разберем
на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: H3AlO3, но в таком виде не оставляем, а выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH = H2O + KAlO2
(метаалюминат калия, или просто алюминат)
Но гидроксид алюминия HAlO2 записывать нельзя, записываем как обычно, но подразумеваем кислоту HAlO2:
Al(OH)3(тв.) + KOH(тв.) = 2H2O + KAlO2 (метаалюминат калия)
То
же самое и с гидроксидом хрома (при сплавлении):
Cr(OH)3 → H3CrO3 → HCrO2;
Cr(OH)3(тв.) + KOH(тв.) = 2H2O + KCrO2
(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли
хромовой кислоты).
*С гидроксидами содержащими четыре группы
ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → H4SnO4 → H2SnO3;
Pb(OH)4 → H4PbO4 → H2PbO3
Следует
помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью
окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4,Pb(OH)4).
Оксид | Гидроксид | Гидроксид в виде | Кислотный остаток | Соль | Название соли |
BeO | Be(OH)2 | H2BeO2 | BeO22- | K2BeO2 | Метабериллат (бериллат) |
ZnO | Zn(OH)2 | H2ZnO2 | ZnO22- | K2ZnO2 | Метацинкат (цинкат) |
Al2O3 | Al(OH)3 | HAlO2 | AlO2— | KAlO2 | Метаалюминат (алюминат) |
Fe2O3 | Fe(OH)3 | HFeO2 | FeO2— | KFeO2 | Метаферрат (НО НЕ ФЕРРАТ) |
SnO | Sn(OH)2 | H2SnO2 | SnO22- | K2SnO2 | СтаннИТ |
PbO | Pb(OH)2 | H2PbO2 | PbO22- | K2PbO2 | БлюмбИТ |
SnO2 | Sn(OH)4 | H2SnO3 | SnO32- | K2SnO3 | МетастаннАТ (станнат) |
PbO2 | Pb(OH)4 | H2PbO3 | PbO32- | K2PbO3 | МетаблюмбАТ (плюмбат) |
Cr2O3 | Cr(OH)3 | HCrO2 | CrO2— | KCrO2 | Метахромат (НО НЕ ХРОМАТ |
* Выше было рассмотрено взаимодействие амфотерных соединений с твердыми щелочами при сплавлении, т.е. в отсутствии воды. При взаимодействии с растворами щелочей образуются комплексные соединения:
Al(OH)3 + KOH → K[Al(OH)4]
(тетрагидроксоалюминат калия);
Al(OH)3 + 3KOH → K3[Al(OH)6]
(гексагидроксоалюминат калия).
С растворами щелочей реагируют и амфотерные оксиды. Следует обратить внимание, что в уравнении реакции вода записывается, как исходное вещество, т.е. в левой части уравнения:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4];
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6].
Продукты реакций относятся к классу солей и являются растворимыми. Следовательно, при диссоциации распадаются на катион металла и анионы кислотных остатков
[Al(OH)4]- или [Al(OH)6]3-.
Какой продукт писать, не имеет значения. Главное чтобы все индексы были верно проставлены и сумма всех зарядов равнялась нулю.
ПЕРЕХОДНЫЕ МЕТАЛЛЫ
Элементы, образующие амфотерные оксиды и гидроксиды, относятся к металлам. Они как все металлы реагируют с разбавленными кислотами:
2Al + 6HCl = 2AlCl3 + 3H2;
Zn + H2SO4 = ZnSO4 + H2
Наиболее активные металлы, образующие амфотерные оксиды и гидроксиды (алюминий, берилий, цинк), реагируют со щелочами:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
ТРЕНИРУМСЯ!!!
Амфотерные гидроксиды
Амфотерные оксиды
Химические свойства амфотерных гидроксидов
Химические свойства амфотерных оксидов
Источник
Амфотерность – это очень важная тема школьного курса химии, которая очень часто бывает недопонята учениками старших классов. Если так происходит, в дальнейшем, это может привести к серьезным проблемам на уроках, так как в химии все новые темы базируются на предыдущих.
Сегодня, я хочу поговорить об амфотерности, наиболее простым и доступным языком. Надеюсь, что эта статья сможет стать полезна учащимся школ, проходящим эту тему, учителям при ее объяснение и всем, кто просто хочет разобраться в химии по каким либо причинам.
Начнем мы вот с чего. Есть такие версии Таблицы Менделеева, в которых химические элементы разделены по цветам. Например, периодическая система из школьных учебников по химии от автора О.С. Габриеляна выглядит так:
В ней, черным цветом обозначены знаки металлов, образующих основные оксиды и основания, красным – знаки неметаллов, зеленым – знаки металлов, обладающих амфотерными свойствами.
Теперь вспоминаем другое, когда мы проходили основания, мы должны были заметить, что их образует метал, которому соответствует основный оксид, например:
Na – Na2O – NaOH
K – K2O – KOH
Ca – CaO – Ca(OH)2
Все эти металлы, в периодической системе Д,И. Менделеева обозначены черным цветом.
Так же мы должны были заметить, что в основе кислот лежат неметаллы, которым соответствуют кислотные оксиды, например:
S – SO3 – H2SO4
N – N2O5 – HNO3
P – P2O5 – H3PO4
Cl – Cl2O7 – HCLO4
Все они обозначены в Таблице красным цветом.
Однако, у нас остаются еще и зеленые элементы, которые являются металлами, образующими амфотерные оксиды и гидроксиды. Что же это значит? Давайте начнем с определения амфотерных веществ.
Амфотерные вещества (от греч. Амфотеро – и тот, и другой) – это вещества, которые в зависимости от условий реакций проявляют основные или кислотные свойства.
Чтобы это понять, в школах часто предлагают провести такой эксперимент (или подобный). Возьмем любую водорастворимую соль цинка и добавим в нее немного щелочи, в результате реакции образуется осадок:
ZnCl2 + NaOH = NaCl + Zn(OH)2 (осадок)
Помимо прочего, этот осадок амфотерный гидроксид и сейчас мы это докажем.
Отфильтруем осадок и поместим небольшое его количество в две пробирки. В пробирку №1 добавим несколько миллилитров раствора серной кислоты. При этом осадок растворится, значит реакция будет идти:
Zn(OH)2 + H2SO4 (p-p) = ZnSO4 + 2H2O
В пробирку №2 с высушенным гидроксидом цинка добавим кристаллический гидроксид натрия и нагреем смесь. При этом мы будем наблюдать протекание химической реакции, которая записывается согласно следующей схеме:
Zn(OH)2 + 2NaOH =(сплавление)= Na2ZnO2(цинкат натрия) + H2O
При этом гидроксид цинка проявил свои кислотные свойства, поэтому реакция прошла так. Для простоты написания реакций мы даже можем представить амфотерные гидроксиды в их кислотной форме, например:
Zn(OH)2 – H2ZnO2
H2ZnO2 + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Кстати оксид цинка в точно таких же условиях, поведет себя как кислотный оксид:
ZnO + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Так же точно, дело будет обстоять и с другими амфотерными гидроксидами, например гидроксид алюминия можно представить в форме двух кислот:
Реакция гидроксида алюминия с кислотой будет протекать стандартно:
Al(OH)3 + 3HCL = AlCl3 + 3H20
Реакция гидроксида алюминия со щелочью, будет протекать по схеме:
Al(OH)3 + NaOH =(сплавление)= NaAlO2 + H2O
В данном случае берем остаток метаалюминиевой кислоты, так как очевидно, что при сплавление будет удаляться вода.
Стоит учесть, что в расплаве и растворе данные реакции будут протекать по разному.
Амфотерный гидроксид + Раствор щелочи = Комплексная соль
Al(OH)3 + NaOH → Na[Al(OH)4]
Реакция оксида алюминия и самого алюминия с раствором щелочи будет протекать по следующей схеме:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Точно такие же реакции будут давать другие амфотерные металы, их оксиды и гидроксиды с растворами щелочей, например цинк:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Все очень просто 🙂
Однако, не стоит забывать еще одно очень важное правило. Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
Похожем образом дело обстоит и с другими элементами. Например, то же железо может проявлять степени окисления 2+, 3+ и 6+. Но зная правило, мы не растеряемся и отнесем гидроксид железа (II) к основаниям, а гидроксид железа (III) к амфотерным гидроксидам.
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Так как эти элементы могут проявляться в разных степенях окисления, их называют переходными элементами или переходными металлами.
Вот собственно и все.
До новых встреч, уважаемые читатели!
Источник
ОТВЕТЫ НА ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ ПО ХИМИИ
БИЛЕТ №1
Вопрос 1. Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете теории строения атома. Значение периодического закона для развития науки.
Ответ. В 1869 г. Д. И. Менделеев сформулировал периодический закон. Современная формулировка этого закона звучит так: «Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от зарядов ядер их атомов (величины атомных масс элементов)».
Периодическая система химических элементов – это графическое изображение пародического закона. Она представлена в виде таблицы, содержащей 7 периодов, 10 рядов и 8 групп элементов. Каждая группа состоит из двух подгрупп – главной и побочной.
Для элементов, объединенных в одну группу, характерны следующие закономерности:
1. Высшая валентность элементов в соединениях с кислородом соответствует номеру группы (исключение: медь может быть и двухвалентной).
2. В главных подгруппах с увеличением относительных атомных масс (при движении сверху вниз) усиливаются металлические свойства элементов и ослабевают неметаллические.
3. При движении по периоду слева направо усиливаются неметаллические свойства и ослабевают металлические.
Порядковый номер химического элемента (Z) совпадают с зарядом ядра его атома.
Для атома 1939K (А – массовое число): Z = 19 (число протонов) и N=A-Z=39-19=20 (число нейтронов).
Сущность периодичности состоит в том, что при возрастании положительных зарядов ядер атомов химических элементов наблюдается периодическое повторение химических элементов с одинаковым числом валентных (внешних) электронов. Этим объясняется периодическая повторяемость свойств элементов и их соединений.
Значение периодического закона
1. Закон сыграл большую роль в создании современной теории строения атома, которая подтвердила его положения.
2. Явление периодичности в изменении свойств химических элементов было объяснено электронными структурами атомов.
3. Возрастание числа химических элементов в периодах (2-8, 18-32) привело ученых к мысли о заполнении энергетических уровне соответствующим числом электронов.
4. На основе периодического закона удалось предсказать и открыть заурановые элементы.
5. Периодический закон и периодическая система химических элементов имели большое значение для открытия радиоактивных изотопов и областей их применении.
6. В периодическом законе и периодической системе химических элементов ярко проявляются общие законы развития природы:
• закон перехода количества в качество,
• закон единства и борьбы противоположностей,
• закон отрицания отрицания.
Вопрос 2. Амфотерность неорганических и органических соединений.
Ответ. Амфотерные элементы – элементы, оксиды и гидроксиды которые проявляют амфотерные свойства.
К амфотерным элементам относятся: алюминий, цинк, хром, желез, марганец и др.
Амфотерные оксиды – это оксиды элементов, проявляющие свойства, характерные и для основных оксидов
Al2O3 + 2NaOH сплавление2NaAlO2 + H2O,
(твердый) алюминат натрия
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Амфотерные гидроксиды – гидроксиды, проявляющие свойства, характерные и для кислот, и для оснований:
Al(OH)3 + 3HCl = AlCl3 +3H2O (Al(OH)3 как основание),
Al(OH)3 +NaOH + 2H 2O = Na[Al(OH) 4(H 2O) 2) ] (Al(OH)3 как кислота).
Чем выше степень окисления элемента, тем более сильные кислотные свойства проявляют его оксиды (например, хром).
Среди органических соединений амфотерными свойствами обладают аминокислоты благодаря наличию двух функциональных групп:NH2 (аминогруппа) и СООH (карбоксильная группа).
Для аминокислот характерны свойства, присущие аминам и карбоновым кислотам.
1. Свойства кислоты:
а) взаимодействие с металлом:
2NH2CH2COOH + 2Na = 2NH2CH2COONa + H2 ↑;
б) взаимодействие с оксидом металла:
2NH2CH2COOH + MgO = (NH2CH2COO)2 Mg + H2O;
в) взаимодействие с основанием:
NH2CH2COOH + NaOH = NH2CH2COONa + H2O;
г) взаимодействие с солью:
2NH2CH2COOH + Na2CO3 = 2NH2CH2COONa + H2O + CO2↑;
д) реакция этерификации:
t
NH2CH2COOH + HOC2H5 = NH2CH2COOC2H5 + H2O.
2. Свойства (как амин):
NH2CH2COOH + HCl = Cl- [+NH2CH2COOH] .
3. Поликонденсация(взаимодействие друг с другом):
NH2CH2COOH + H2NCH2COOH = NH2CH2 CONH CH2COOH + H2O;
пептидная группа
дипептид ɑ- аминоуксусной кислоты
Вопрос 3. Получите углекислый газ и докажите его наличие.
Ответ.
Получение
CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑,
мрамор
CaCO3 + 2H+ + Сl- = Ca2+ + 2Cl- + H2O + CO2 ↑,
CaCO3 + 2H+ = Ca2+ + H2O + CO2 ↑,
Доказательство
Сa(OH)2 +CO2 = CaCO3↓ + H2O
(осадок белого цвета)
При длительном пропускании углекислого газа через известковую воду осадок CaCO3 растворяется вследствие образования хорошо растворимой соли – гидрокарбоната кальция Ca(HCO3)2:
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Оборудование и реактивы: мрамор, прибор для получения газов, соляная кислота (раствор), известковая вода, штатив с пробирками.
БИЛЕТ № 2
Вопрос 1. Многоатомные спирты, их строение свойства и применение.
Ответ.Многоатомные спирты – органические соединения, содержащие несколько гидроксильных групп, соединенных углеводородным радикалом.
CH2(OH) – CH2(OH) – этандиол-1,2, или этиленгликоль (двухатомный спирт),
CH2(OH)–CH(OH)–CH2(OH) – пропантриол-1,2,3, или пропиленгликоль, или глицерин (трехатомный спирт).
Физические свойства
Вязкие, сиропоподобные жидкости, без цвета и запаха, сладковатого вкуса, хорошо растворимые в воде. Температура кипения этиленгликоля – 197,6 ̊С, глицерина – 290 ̊С. Этиленгликоль – яд!
Химические свойства
1. Взаимодействие со щелочными металлами:
CH2(OH)CH2(OH) + 2Na = CH2(ONa)CH2(ONa) + H2↑.
2. Взаимодействие с галогеноводородами:
CH2(OH)CH2(OH) + 2HCl = CH2ClCH2Cl + 2H2O.
дихлорэтан
3. Нитрование:
CH2(OH)CH(OH)СH2(OH) + 3HNO3 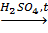 CH2(ONO2)CH(ONO2)CH2(ONO2) + 3H2O. нитроглицерин
CH2(ONO2)CH(ONO2)CH2(ONO2) + 3H2O. нитроглицерин
4. Качественная реакция на глицерин:
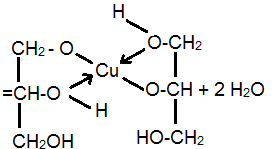
2CH2 (OH)CH(OH)CH2(OH) + Cu(OH)2

глицерат меди(II)
(раствор ярко-синего цвета)
Получение
1. 3С2H4 + 2KMnO4 + 4H2O = 3CH2(OH)CH2(OH) + 2MnO2 + 2KOH.
2. CH2ClCH2Cl + 2NaOH = CH2(OH)CH2(OH) + 2NaCl.
3. 2C2H4 + O2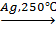 2H2C – CH2,
2H2C – CH2,
/
O
этиленоксид
H2C – CH2 + H2O = CH2(OH)CH2(OH)
/
O
4. CH3CHCH2 + O2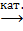 CH2CHCHO + H2O,
CH2CHCHO + H2O,
акролен
CH2CHCHO + H2 = CH2CHCH2OH,
аллиловыйспирт
CH2CHCH2OH + H2O2 = CH2(OH)CH(OH)CH2(OH).
Применение
1. В производстве антифризов (веществ, понижающих температуру замерзания растворов).
2. В производстве лекарств (глицерин).
3. В производстве искусственного волокна.
4. В производстве взрывчатых веществ (глицерин).
5. В производстве алкогольных напитков.
6. В парфюмерии (глицерин).
7. Как смягчитель кожи и тканей (глицерин).
Источник
Амфоте́рность (от др.-греч. ἀμφότεροι «двоякий, двойственный; обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бериллий, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер[2].
Амфотерность как химическое свойство[править | править код]
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+ ), так и по механизму оснований (отщепление гидроксид-ионов, OH– ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами[3]. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
Идеальным амфолитом будет вода:
Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы[2].
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может быть описано как реакции ионного обмена ионов среды с лигандами H2O и OH–. Например, для Al(OH)3 ионные равновесия могут быть записаны следующим образом:
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Ссылки[править | править код]
- Амфотерный // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература[править | править код]
- Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. – М.: Просвещение, 1982. – 271 с.
- Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с
Примечания[править | править код]
- ↑ Танганов Б.Б. Химические методы анализа. – Улан-Удэ, 2005.- 550 с.
- ↑ 1 2 3 Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. – М.: Просвещение, 1982. – 271 с.
- ↑ 1 2 Угай Я. А. Общая и неорганическая химия. – М.: Высшая школа, 1997. – 527 с.
- ↑ Автопротолиз воды / Жуков С. Т. Химия. 8-9 класс
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. – М.: Химия, 2000. – 480 с.: ил.
- ↑ Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с .
Источник
