Какие кислоты за счет аниона проявляют только восстановительные свойства
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки
. Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
Источник
Глава 4. Обобщение знаний по химии за курс основной школы. Подготовка к ГИА
Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления элементов, образующих реагирующие вещества.
Окислитель — вещество (элемент в составе этого вещества), принимающее электроны. Само оно при этом восстанавливается.
Восстановитель — вещество (элемент в составе этого вещества), отдающее электроны. Само оно при этом окисляется.
Примеры тестовых заданий и рекомендации к их выполнению
1. Веществом, которое за счёт аниона проявляет только восстановительные свойства, является
1)H2SO4 2) SO2 3) Na2SO3 4) H2S
Восстановителем является та частица, в которой элемент имеет наименьшее значение степени окисления. Так как все анионы веществ, данных в вариантах ответов, образованы серой, то наименьшее значение степени окисления равно -2 (сера — элемент VI группы, и её атому недостаёт до завершения внешнего слоя именно двух электронов). Это значение степени окисления имеет сера в сероводороде. Ответ: 4.
2. Хлор проявляет только восстановительные свойства в соединении, формула которого
1)КСlO 2) КСlO4 3)Сl2O7 4) НСl
Данное задание выполняется по аналогии с предыдущим. Ответ: 4.
3. Процессу восстановления соответствует схема

Достаточно сложное задание, однако эту сложность легко преодолеть, используя логику. Так как процесс восстановления — это понижение степени окисления, то сразу следует исключить ответ 3 и обратить внимание на ответ 4, поскольку сера изменила степень окисления. Определив значение этого изменения с 0 до -2, можно сделать вывод, что именно ответ 4 является верным. В этом случае не нужно будет испытывать затруднений и тратить время для определения степеней окисления в катионе аммония и в сульфит-анионе. Ответ: 4.
4. Элемент бром является восстановителем в реакции, уравнение которой
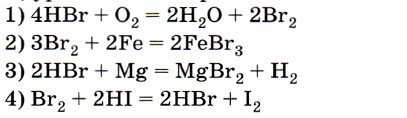
Ответы 2 и 3 из претендентов на верный ответ следует сразу исключить, так как металлы (простые вещества) проявляют только восстановительные свойства. Анализ изменения степени окисления брома для первого уравнения (от -1 до 0) позволяет сделать вывод, что этот ответ является верным. Ответ: 1.
5. Азот в аммиаке проявляет восстановительные свойства в реакции, уравнение которой
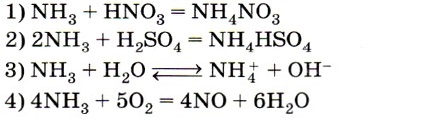
Следует знать, что в аммиаке и ионе аммония азот имеет одинаковую степень окисления -3, поэтому из числа возможных верных ответов исключаются ответы 1,2 и 3. В ответе 4 азот повышает свою степень окисления с -3 в аммиаке до +2 в оксиде азота (II). Ответ: 4.
6. Схеме превращения  соответствует схема
соответствует схема
реакции
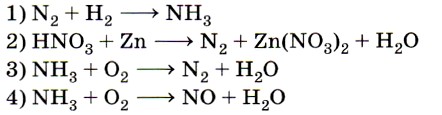
Отправной точкой для нахождения верного ответа служит  в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
7. Изменению степени окисления
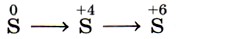
соответствует схема превращений

Так как во всех четырёх вариантах первое звено представлено простым веществом — серой, все они соответствуют первому звену искомой схемы. Следовательно, анализируются вторые звенья на предмет нахождения соединений серы в степени окисления +4. Это варианты 1 и 4. Третье звено (сера в степени окисления +6) содержится в варианте 4. Это и есть верный ответ. Ответ: 4.
Возможный равноценный вариант поиска верного ответа мог быть основан на определении последних звеньев, в которых записаны соединения серы в степени окисления +6. Это варианты ответов 2 и 4. Анализ вторых звеньев данных вариантов на предмет нахождения соединений серы в степени окисления +4 также позволяет определить верный ответ. Ответ: 4.
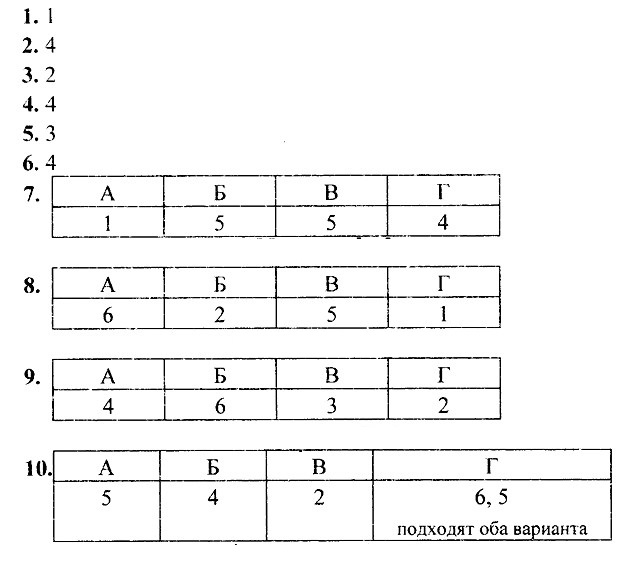
8. Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
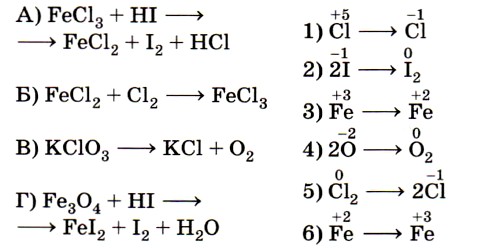
Ключевыми словами для выполнения этого задания являются «изменение степени окисления окислителя», т. е. элемента, понижающего значение степени окисления. Это позволит исключить из правого столбика процессы с участием восстановителей (отдачи электронов) — 2, 4 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степени окисления окислителей. Схеме А, в которой степень окисления железа +3, соответствует процесс 3; схеме Б, в которой хлор имеет степень окисления 0, соответствует процесс 5; схеме В, в которой хлор имеет степень окисления +5, соответствует процесс 1.
Некоторые сложности вызовет схема Г, так как железо в железной окалине (Fe3O4) имеет два значения степени окисления: +2 и +3 (FeO • Fe2O3) и именно железо в степени окисления +3 является окислителем (соответствие Г — 3). Ответ: 3513.
9. Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).

Ключевыми словами для выполнения этого задания являются «изменение степени окисления восстановителя», т. е. элемента, отдающего электроны и соответственно повышающего свою степень окисления. Это позволит исключить из правого столбика процессы с участием окислителей (принятия электронов)— 1, 5 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степеней окисления восстановителей. Схеме А, в которой степень окисления иода 0, соответствует процесс 2; схеме Б, в которой азот катиона аммония имеет степень окисления -3, соответствует процесс 3.
Некоторые сложности вызовут схемы В и Г, так как это реакции диспропорционирования, в которых один и тот же элемент выступает как в роли окислителя, так и в роли восстановителя. Однако выполнение этого задания ограничено рамками его условия. Для схемы В из двух вариантов происходящих изменений степени окисления иода выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие В— 2). Аналогично для схемы Г из двух вариантов происходящих изменений степени окисления азота выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие Г —4). Ответ: 2324.
10. Установите соответствие между схемой превращения элемента (левый столбец) и уравнением ОВР (правый столбец).
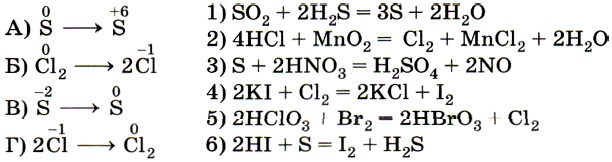
Превращению А в качестве продуктов реакции соответствуют соединения серы в форме сульфат-иона 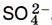 . Следовательно, этому превращению соответствует уравнение 3.
. Следовательно, этому превращению соответствует уравнение 3.
Превращению Б в качестве продуктов реакции соответствуют соединения хлора в форме хлорид-иона — Сl-. Следовательно, этому превращению соответствует уравнение 4.
Легко установить соответствие В — 1, так как свободная сера указана только в одном из приведённых уравнений.
Аналогично устанавливается соответствие Г — 2, так как хлор в степени окисления -1 указан в левой части только одного из приведённых уравнений. Ответ: 3412.

1. Не является окислительно-восстановительной реакция, схема которой
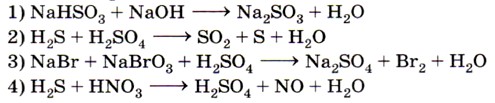
2. Только восстановительные свойства проявляет вещество, формула которого
1)SO2 2) НСl 3)Н2 4) Na2S
3. Только окислительные свойства проявляет вещество, формула которого
1)I2 2) F2 3)Н2 4)N2
4. Соляная кислота выполняет роль восстановителя в реакции, уравнение которой
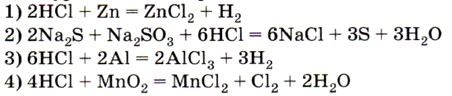
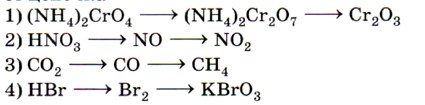
5. Процессу последовательного восстановления соответствует цепочка
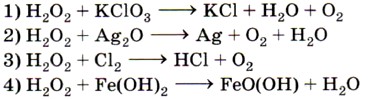
6. Пероксид водорода проявляет окислительные свойства в реакции, схема которой
7. Установите соответствие между формулой вещества (левый столбец) и степенью окисления фосфора в нём (правый столбец).
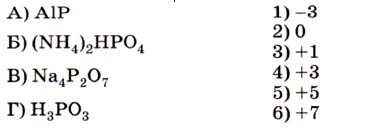
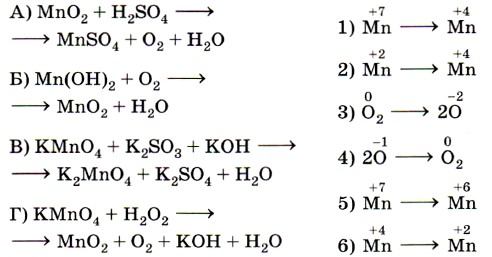
8. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
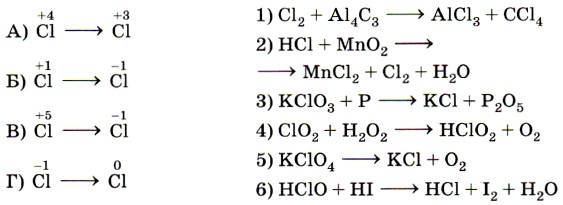
9. Установите соответствие между изменением степени окисления хлора (левый столбец) и схемой реакции (правый столбец).
10. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).
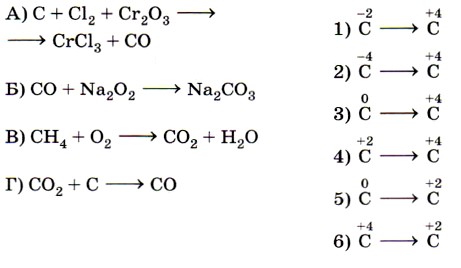
Окислительно-восстановительные реакции. Ответы
Источник
Химия
9 класс
Обязательный минимум знаний
Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления элементов, образующих реагирующие вещества.
Окислитель — вещество (элемент в составе этого вещества), принимающее электроны. Само оно при этом восстанавливается.
Восстановитель — вещество (элемент в составе этого вещества), отдающее электроны. Само оно при этом окисляется.
Примеры тестовых заданий и рекомендации к их выполнению
- Веществом, которое за счёт аниона проявляет только восстановительные свойства, является
- H2SO4
- SO2
- Na2SO3
- H2S
Восстановителем является та частица, в которой элемент имеет наименьшее значение степени окисления. Так как все анионы веществ, данных в вариантах ответов, образованы серой, то наименьшее значение степени окисления равно -2 (сера — элемент VI группы, и её атому недостаёт до завершения внешнего слоя именно двух электронов). Это значение степени окисления имеет сера в сероводороде. Ответ: 4.
- Хлор проявляет только восстановительные свойства в соединении, формула которого
- КСlO
- КСlO4
- Сl2O7
- НСl
Данное задание выполняется по аналогии с предыдущим. Ответ: 4.
- Процессу восстановления соответствует схема
- SO2 → SO2-3
- NH3 → NH+4
- Zn0 → Zn2+
- S → H2S
Достаточно сложное задание, однако эту сложность легко преодолеть, используя логику. Так как процесс восстановления — это понижение степени окисления, то сразу следует исключить ответ 3 и обратить внимание на ответ 4, поскольку сера изменила степень окисления. Определив значение этого изменения с 0 до -2, можно сделать вывод, что именно ответ 4 является верным. В этом случае не нужно будет испытывать затруднений и тратить время для определения степеней окисления в катионе аммония и в сульфит-анионе. Ответ: 4.
- Элемент бром является восстановителем в реакции, уравнение которой
- 4НВr + O2 = 2Н2O + 2Вr2
- 3Br2 + 2Fe = 2FeBr3
- 2HBr + Mg = MgBr2 + H2
- Br2 + 2HI = 2HBr + I2
Ответы 2 и 3 из претендентов на верный ответ следует сразу исключить, так как металлы (простые вещества) проявляют только восстановительные свойства. Анализ изменения степени окисления брома для первого уравнения (от -1 до 0) позволяет сделать вывод, что этот ответ является верным. Ответ: 1.
- Азот в аммиаке проявляет восстановительные свойства в реакции, уравнение которой


Следует знать, что в аммиаке и ионе аммония азот имеет одинаковую степень окисления -3, поэтому из числа возможных верных ответов исключаются ответы 1, 2 и 3. В ответе 4 азот повышает свою степень окисления с -3 в аммиаке до +2 в оксиде азота (II). Ответ: 4.
- Схеме превращения
 соответствует схема реакции
соответствует схема реакции
Отправной точкой для нахождения верного ответа служит
 в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3. - Изменению степени окисления

соответствует схема превращений

Так как во всех четырёх вариантах первое звено представлено простым веществом — серой, все они соответствуют первому звену искомой схемы. Следовательно, анализируются вторые звенья на предмет нахождения соединений серы в степени окисления +4. Это варианты 1 и 4. Третье звено (сера в степени окисления +6) содержится в варианте 4. Это и есть верный ответ. Ответ: 4.
Возможный равноценный вариант поиска верного ответа мог быть основан на определении последних звеньев, в которых записаны соединения серы в степени окисления +6. Это варианты ответов 2 и 4. Анализ вторых звеньев данных вариантов на предмет нахождения соединений серы в степени окисления +4 также позволяет определить верный ответ. Ответ: 4.
- Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).

«изменение степени окисления окислителя», т. е. элемента, понижающего значение степени окисления. Это позволит исключить из правого столбика процессы с участием восстановителей (отдачи электронов) — 2, 4 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степени окисления окислителей. Схеме А, в которой степень окисления железа +3, соответствует процесс 3; схеме Б, в которой хлор имеет степень окисления 0, соответствует процесс 5; схеме В, в которой хлор имеет степень окисления +5, соответствует процесс 1.
Некоторые сложности вызовет схема Г, так как железо в железной окалине (Fe3O4) имеет два значения степени окисления: +2 и +3 (FeO • Fe2O3) и именно железо в степени окисления +3 является окислителем (соответствие Г — 3). Ответ: 3513.
- Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).

Ключевыми словами для выполнения этого задания являются «изменение степени окисления восстановителя», т. е. элемента, отдающего электроны и соответственно повышающего свою степень окисления. Это позволит исключить из правого столбика процессы с участием окислителей (принятия электронов) — 1, 5 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степеней окисления восстановителей. Схеме А, в которой степень окисления иода 0, соответствует процесс 2; схеме Б, в которой азот катиона аммония имеет степень окисления -3, соответствует процесс 3.
Некоторые сложности вызовут схемы В и Г, так как это реакции диспропорционирования, в которых один и тот же элемент выступает как в роли окислителя, так и в роли восстановителя. Однако выполнение этого задания ограничено рамками его условия. Для схемы В из двух вариантов происходящих изменений степени окисления иода выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие В — 2). Аналогично для схемы Г из двух вариантов происходящих изменений степени окисления азота выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие Г —4). Ответ: 2324.
- Установите соответствие между схемой превращения элемента (левый столбец) и уравнением ОВР (правый столбец).

Превращению А в качестве продуктов реакции соответствуют соединения серы в форме сульфат-иона
 . Следовательно, этому превращению соответствует уравнение 3.
. Следовательно, этому превращению соответствует уравнение 3.Превращению Б в качестве продуктов реакции соответствуют соединения хлора в форме хлорид-иона — Сl-. Следовательно, этому превращению соответствует уравнение 4.
Легко установить соответствие В — 1, так как свободная сера указана только в одном из приведённых уравнений.
Аналогично устанавливается соответствие Г — 2, так как хлор в степени окисления -1 указан в левой части только одного из приведённых уравнений. Ответ: 3412.
Задания для самостоятельной работы
- Не является окислительно-восстановительной реакция, схема которой

- Только восстановительные свойства проявляет вещество, формула которого
- SO2
- НСl
- Н2
- Na2S
- Только окислительные свойства проявляет вещество, фор-мула которого
- I2
- F2
- Н2
- N2
- Соляная кислота выполняет роль восстановителя в реакции, уравнение которой

- Процессу последовательного восстановления соответствует цепочка

- Пероксид водорода проявляет окислительные свойства в реакции, схема которой

- Установите соответствие между формулой вещества (левый столбец) и степенью окисления фосфора в нём (правый столбец).

- Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).

- Установите соответствие между изменением степени окисления хлора (левый столбец) и схемой реакции (правый столбец).

- Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).

Источник
