Какие кислоты могут содержаться в дождевой воде
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 июля 2018;
проверки требуют 14 правок.
Скульптура, пострадавшая от кислотного дождя
Кисло́тный дождь — все виды метеорологических осадков — снег, дождь, град, туман, дождь со снегом, — при которых наблюдается понижение водородного показателя (pH) дождевых осадков из-за загрязнений воздуха кислотными оксидами, обычно оксидами серы и оксидами азота[1].
История термина[править | править код]
Впервые термин «кислотный дождь» был введен в 1872 году английским учёным Робертом Смитом в книге «Воздух и дождь: начало химической климатологии». Его внимание привлёк смог в Манчестере. Кислотные дожди являются одной из причин гибели лесов, урожаев и растительности, а также одной из причин разрушения зданий и памятников культуры, трубопроводов, приводят в негодность автомобили, понижают плодородие почвы и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Вода обычного дождя тоже представляет собой слабокислый раствор. Это происходит вследствие того, что природные вещества атмосферы, такие как углекислый газ, вступают в реакцию с дождевой водой. При этом образуется слабая угольная кислота, тогда как в идеале pH дождевой воды равняется 5,6—5,7. В реальной жизни показатель кислотности дождевой воды в одной местности может отличаться от показателя кислотности дождевой воды в другой местности. Это прежде всего зависит от состава газов, содержащихся в атмосфере той или иной местности, таких как оксид серы и оксиды азота.
В 1883 году шведский учёный Сванте Август Аррениус ввел в обращение два термина — кислота и основание. Он назвал кислотами вещества, которые при растворении в воде образуют свободные положительно заряженные ионы водорода. Основаниями он назвал вещества, которые при растворении в воде образуют свободные отрицательно заряженные гидроксид-ионы. Водородный показатель является взятым с обратным знаком десятичным логарифмом активности ионов водорода в растворе и его используют в качестве показателя кислотности воды.
Химические реакции[править | править код]
Даже нормальная дождевая вода имеет слабокислую реакцию из-за наличия в воздухе диоксида углерода. Кислотный дождь образуется в результате реакции между водой и такими загрязняющими веществами, как диоксиды серы (SO2 и SO3) и различными оксидами азота. Эти вещества выбрасываются в атмосферу автомобильным транспортом, в результате деятельности металлургических предприятий, тепловых электростанций, а в естественных условиях – вулканами.
Соединения серы, сульфиды, самородная сера и другие содержатся: в углях и в руде (особенно много сульфидов в бурых углях, при сжигании или обжиге которых образуются летучие соединения — оксид серы(IV) (сернистый ангидрид), оксид серы(VI) (серный ангидрид), сероводород — (образуется в малых количествах при недостаточном обжиге или неполном сгорании, при низкой температуре). Различные соединения азота содержатся в углях, и особенно в торфе (так как азот, как и сера, входит в состав биологических структур, из которых образовались эти полезные ископаемые).
При сжигании таких ископаемых образуются оксиды азота (например, оксид азота, вступая в реакцию с водой атмосферы, под воздействием солнечного излучения, или так называемых «фотохимических реакций»), которые превращаются в растворы кислот — серной, сернистой, азотистой и азотной. Затем, вместе со снегом или дождем, они выпадают на землю.
Кислоты реагируют с карбонатом кальция (CaCO3), из которого построены многие известные достопримечательности, например, великая пирамида Гизы (Египет), в связи с чем они разрушаются.
Экологические и экономические последствия[править | править код]
Лес после кислотного дождя
Последствия выпадения кислотных дождей наблюдаются во многих странах земного шара.
Кислотный дождь оказывает отрицательное воздействие на водоёмы — озера, реки, заливы, пруды — повышая их кислотность до такого уровня, что в них погибает флора и фауна.
Выделяют три стадии воздействия кислотных дождей на водоёмы:
| Первая стадия | с увеличением кислотности воды (показатели рН меньше 7) водяные растения начинают погибать, лишая других животных водоёма пищи, уменьшается количество кислорода в воде, начинают бурно развиваться водоросли (буро-зеленые). Первая стадия эутрофикации (заболачивания) водоема. При кислотности рН 6 погибают пресноводные креветки. |
| Вторая стадия | кислотность повышается до рН 5,5, погибают донные бактерии, которые разлагают органические вещества и листья, и органический мусор начинает скапливаться на дне. Затем гибнет планктон — крошечное животное, которое составляет основу пищевой цепи водоема и питается веществами, образующимися при разложении бактериями органических веществ. |
| Третья стадия | кислотность достигает рН 4,5, погибает вся рыба, большинство лягушек и насекомых. |
Первая и вторая стадии обратимы при прекращении воздействия кислотных дождей на водоем.
По мере накопления органических веществ на дне водоёмов из них начинают выщелачиваться токсичные металлы. Повышенная кислотность воды способствует более высокой растворимости таких опасных металлов, как кадмий, ртуть и свинец из донных отложений и почв.
Эти токсичные металлы представляют опасность для здоровья человека. Люди, пьющие воду с высоким содержанием свинца или принимающие в пищу рыбу с высоким содержанием ртути, могут приобрести серьёзные заболевания.
Кислотный дождь наносит вред не только водной флоре и фауне. Он также уничтожает растительность на суше. Учёные считают, что хотя до сегодняшнего дня механизм до конца ещё не изучен, «сложная смесь загрязняющих веществ, включающая кислотные осадки, озон и тяжёлые металлы, в совокупности приводит к деградации лесов»[2].
Экономические потери от кислотных дождей в США, по оценкам одного исследования[какого?], составляют ежегодно на восточном побережье 13 миллионов долларов и к концу века убытки достигнут 1,7 миллиардов долларов от потери лесов; 8,3 миллиардов долларов от потери урожаев (только в бассейне реки Огайо) и только в штате Миннесота 40 миллионов долларов на медицинские расходы.
Примечания[править | править код]
Источник
 Ñêîëüêî êèñëîòû â êàïëå äîæäÿ?
Ñêîëüêî êèñëîòû â êàïëå äîæäÿ?
äîêòîð õèìè÷åñêèõ íàóê À.Ï.Ïóðìàëü
Âïåðâûå î êèñëîòíûõ äîæäÿõ çàãîâîðèëè â 1852
ãîäó. ×åëîâåê ñ îðèãèíàëüíîé àíãëèéñêîé ôàìèëèåé
Ñìèò, ïðîæèâàâøèé â Ìàí÷åñòåðå, ñîáðàë â
ôîòîãðàôè÷åñêóþ êþâåòó äîæäåâóþ âîäó è ïî÷åìó-òî
äîáàâèë òóäà ðàñòâîð ñîëè áàðèÿ. Âîäà ñòàëà
ìóòíîé. Ïîñêîëüêó ýòî èçâåñòíàÿ êà÷åñòâåííàÿ
ðåàêöèÿ íà ñóëüôàò-èîí (SÎ42- ), òî ñòàëî
ïîíÿòíî, ÷òî â äîæäåâîé êàïëå åñòü ñåðíàÿ
êèñëîòà. Ïðàâäà, çàäîëãî äî Ñìèòà, â 1696 ãîäó,
Ð.Áîéëü òîæå îáíàðóæèë êèñëóþ ðåàêöèþ äîæäåâîé
âîäû, íî òàê è íå îïðåäåëèë, ïî÷åìó ýòî
ïðîèñõîäèò. Ïîýòîìó, äîëãîå âðåìÿ ïîëàãàëè, ÷òî â
êàïåëüêàõ äîæäÿ ïðîñòî ðàñòâîðÿåòñÿ ÑÎ2, è
îáðàçóåòñÿ ñëàáàÿ óãîëüíàÿ êèñëîòà (ïðè òîì
ñîäåðæàíèè óãëåêèñëîãî ãàçà, êîòîðîå õàðàêòåðíî
äëÿ àòìîñôåðû, ðÍ äîëæåí áûòü îêîëî 5,6). Êîãäà Ñìèò
îáíàðóæèë ñåðíóþ êèñëîòó, åìó íå ñðàçó ïîâåðèëè,
è ìíîãèå áðîñèëèñü ïåðåïðîâåðÿòü åãî ðåçóëüòàò.
Îêàçàëîñü, ÷òî, ïîìèìî ñåðíîé, â äîæäåâîé êàïëå
åñòü åùå è àçîòíàÿ êèñëîòà, ïîòîì íàøëè
ìóðàâüèíóþ, à âïîñëåäñòâèè – ùàâåëåâóþ è
óêñóñíóþ.
Ïî÷åìó æå èìåííî â ñåðåäèíå ÕIÕ âåêà óäàëîñü
îáíàðóæèòü öåëûé íàáîð êèñëîò â äîæäåâûõ êàïëÿõ,
ïðè ÷åì ñàìûìè ïðîñòûìè ñïîñîáàìè? Äåëî â òîì, ÷òî
ýòî áûëî íà÷àëî òåõíîëîãè÷åñêîé è
èíäóñòðèàëüíîé ðåâîëþöèè: â Àíãëèè ïîÿâèëèñü
ïåðâûå ìàñòåðñêèå è ïðåäïðèÿòèÿ, çàðàáîòàëè
òîïêè, ãäå â áîëüøîì êîëè÷åñòâå ñæèãàëè óãîëü. À
ñæèãàíèå ëþáîãî èñêîïàåìîãî òîïëèâà, òâåðäîãî
èëè æèäêîãî, äàåò íå òîëüêî óãëåêèñëûé (ÑÎ2,),
íî è ñåðíèñòûé ãàç (SO2). Ñíà÷àëà äóìàëè, ÷òî
ìåõàíèçì îáðàçîâàíèÿ ñåðíîé êèñëîòû ïðåäåëüíî
ïðîñò – ýòî îáû÷íîå ðàñòâîðåíèå ñåðíèñòîãî ãàçà â
äîæäåâîé êàïëå, íî, êàê ìû óâèäèì äàëüøå, ýòîò
ìåõàíèçì îêàçàëñÿ çíà÷èòåëüíî ñëîæíåå. Ïîíà÷àëó
ó÷åíûå äàæå îáðàäîâàëèñü êèñëîòíûì äîæäÿì, âåäü
êàæäîå îáëàêî ïðèíîñèëî íà ïîëÿ íå òîëüêî âëàãó
äëÿ ïî÷âû, íî è óäîáðåíèå – ñåðó è àçîò. Íî ðàäîñòü
áûëà íåäîëãîé. Âñêîðå ñòàëî ÿñíî, ÷òî âðåäà îò
êèñëîòíûõ äîæäåé áîëüøå, ÷åì ïîëüçû. È ýòî íå
òîëüêî çàêèñëåíèå ïî÷â. Åñëè ðàñïîëîæèòü
íåïðèÿòíîñòè, ñâÿçàííûå ñ êèñëîòíûìè äîæäÿìè, ïî
ìåðå óáûâàíèÿ èõ âðåäíîñòè, òî ïîëó÷èòñÿ òàêîé
ðÿä:
1) Ñíèæåíèå óðîæàéíîñòè îñíîâíûõ
ñåëüñêîõîçÿéñòâåííûõ êóëüòóð (ïøåíèöû, ðæè,
êóêóðóçû è ò.ä.),ïîñêîëüêó â çàêèñëåííûõ ïî÷âàõ
ãèáíåò ïî÷âåííàÿ áèîòà. Òîëüêî íåêîòîðûå
ðàñòåíèÿ (êðàïèâà, ùàâåëü, âèíîãðàä) ëþáÿò êèñëóþ
ïî÷âó. Çàùèòèòü ïî÷âó îò êèñëîòíûõ äîæäåé î÷åíü
òðóäíî, õîòÿ ýòî ïûòàþòñÿ ñäåëàòü, âíîñÿ â íåå
èçâåñòíÿê. Íî ìàñøòàá ïðèðîäíûõ ÿâëåíèé è
÷åëîâå÷åñêèõ äåéñòâèé íåñîïîñòàâèìû.
2) Ãèáåëü ëåñîâ. Èç-çà êèñëîòíûõ äîæäåé äåðåâüÿ
òåðÿþò èììóíèòåò, çàáîëåâàþò ðàçíûìè áîëåçíÿìè,
ó íèõ ñíèæàåòñÿ ôîòîñèíòåç, è îíè ïîãèáàþò.
Ñåãîäíÿ ïîðàæåíà çíà÷èòåëüíàÿ ÷àñòü ëåñîâ
Åâðîïû, à â ÑØÀ è Êàíàäå ìàñøòàáû áåäñòâèÿ åùå
áîëüøå. Òàêèå ëåñà âûãëÿäÿò êàê ïîñëå ïîæàðà:
ãîëûå ñòâîëû è íè îäíîãî ëèñòî÷êà. Êàðòèíà, íàäî
ïðèçíàòüñÿ, ñòðàøíàÿ.
3) Ãèáåëü çàêðûòûõ âîäîåìîâ (îçåð). Îò êèñëîòíûõ
äîæäåé ïîãèáàåò âîäíàÿ áèîòà. Íå îñòàåòñÿ íè ðûá,
íè óëèòîê, íè ÷åðâÿêîâ. Ïðîèñõîäèò ýòî
ïîñòåïåííî, è ìåõàíèçì çäåñü òàêîâ: ïîä äåéñòâèåì
êèñëîòû ðàñòâîðÿþòñÿ àëþìîñèëèêàòíûå ïîðîäû
(òàì, ãäå îíè åñòü), à àëþìèíèé òîêñè÷åí. Ãèáåëü
âñåé æèâíîñòè ó÷åíûå íàáëþäàþò èìåííî ïðè òàêîì
ðÍ, ïðè êîòîðîì êîíöåíòðàöèÿ àëþìèíèÿ â
âîäîåìå äîñòèãàåò ëåòàëüíîé äîçû. Â ïðîøëûå ãîäû
ïîãèáëè óæå òûñÿ÷è îçåð â ÑØÀ, Êàíàäå è Øâåöèè
(ïðàâäà, åñòü íàäåæäà, ÷òî íà ýòîì ïðîöåññ
çàêîí÷èòñÿ).
4) Êîððîçèÿ è ðàçðóøåíèå èçâåñòêîâûõ, êàìåííûõ
çäàíèé, ìåòàëëè÷åñêèõ êðûø è ðàçíûõ ñîîðóæåíèé. Â
ÕIÕ âåêå â Åâðîïå èìåííî ïî ýòîé ïðè÷èíå ñòàëè
ïîêðûâàòü êðûøè ÷åðåïèöåé – îíà ñëóæèëà ãîðàçäî
äîëüøå.
Äëÿ äîæäåâîé êàïëè íóæíà ñîëü èëè ïûëü
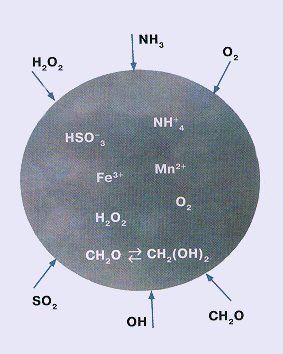
Èòàê, äîæäåâàÿ êàïëÿ ñîäåðæèò öåëûé íàáîð
êèñëîò, à òàêæå èîíû àììîíèÿ, æåëåçà, íàòðèÿ,
êàëüöèÿ, ìàðãàíöà, ìàãíèÿ. ×òîáû ïîíÿòü, êàê
ñîáèðàåòñÿ òàêîé õèìè÷åñêèé áóêåò, íàäî
âñïîìíèòü, êàê îáðàçóåòñÿ îáëàêî. Âîîáùå íåáî
Çåìëè ïîñòîÿííî áîëåå ÷åì íàïîëîâèíó çàêðûòî
îáëàêàìè. Âñå îíè æèâóò ïðèìåðíî ÷àñ, ïîòîì 85%
îáëàêîâ ðàññàñûâàåòñÿ, à îñòàëüíûå âûïàäàþò â
âèäå Åñëè îáëàêî ïîïàäàåò â çîíó ñ ìåíüøåé
âëàæíîñòüþ èëè áîëåå âûñîêîé òåìïåðàòóðîé, òî
íèêàêîãî äîæäÿ íå áóäåò: êàïëè èñïàðÿòñÿ è
îáëàêî, òåïåðü óæå ãàçîâîå, áóäåò äâèãàòüñÿ
äàëüøå. Òàê, èñïàðÿÿñü è êîíäåíñèðóÿñü ñíîâà,
îáëàêî ìîæåò ïåðåìåùàòüñÿ íà î÷åíü áîëüøèå
ðàññòîÿíèÿ, äî 2000 êì. Ïîýòîìó îáëàêî, ðîäèâøååñÿ â
îäíîé ñòðàíå, ìîæåò âûïàñòü êèñëîòíûì äîæäåì â
äðóãîé, êîòîðàÿ äîñòàòî÷íî äàëåêà îò ìåñòà
çàãðÿçíåíèÿ. Ýòî è íàçûâàåòñÿ òðàíñãðàíè÷íûì
ïåðåíîñîì: îáëàêî îáðàçóåòñÿ ãäå-íèáóäü â
Ãåðìàíèè, à âûïàäàåò íà Øâåöèþ èëè Äàíèþ,
îáðàçóåòñÿ â ÑØÀ, à îçåðà ãèáíóò â Êàíàäå…
Íî âåðíåìñÿ ê òîìó, êàê îáðàçóåòñÿ îáëàêî
(îñíîâíàÿ ÷àñòü îáëàêîâ ðàñïîëîæåíà â
òðîïîñôåðå, íà âûñîòå 1 – 5 êì). Ïàðû âîäû
ïîäíèìàþòñÿ ââåðõ, â îáëàñòü âñå áîëåå íèçêèõ
òåìïåðàòóð (òåìïåðàòóðà ñ âûñîòîé óìåíüøàåòñÿ 6îÑ
íà êèëîìåòð), è ïîíà÷àëó íåíàñûùåííûé âîäÿíîé ïàð
íàâåðõó ñòàíîâèòñÿ íàñûùåííûì. Â ýòîì ñîñòîÿíèè
îí äîëæåí ñêîíäåíñèðîâàòüñÿ, òî åñòü
ïðåâðàòèòüñÿ â êàïëþ, íî ýòîãî íå ïðîèñõîäèò,
ïîñêîëüêó êàïëå íóæåí öåíòð êîíäåíñàöèè. Íàä
ïîâåðõíîñòüþ îêåàíà, òàì, ãäå áîëüøå âñåãî è
îáðàçóåòñÿ îáëàêîâ, öåíòðàìè êîíäåíñàöèè ñëóæàò
êðèñòàëëèêè ñîëè (NàÑL). Îíè ïîÿâëÿþòñÿ èç-çà òîãî,
÷òî âåòåð ïîäõâàòûâàåò ñ ïîâåðõíîñòè êàïëè
ìîðñêîé âîäû, âûñóøèâàåò èõ, è îáðàçîâàâøèåñÿ
êðèñòàëëèêè ñîëè ïîäíèìàþòñÿ ââåðõ. À ñîëü –
ãèäðîôèëüíîå ñîåäèíåíèå, íà êîòîðîì îõîòíî
îñåäàåò âîäà, òî åñòü êîíäåíñèðóåòñÿ. Êàïåëüêà
áûñòðî ðàñòåò è ÷åðåç ïÿòü ìèíóò óæå äîñòèãàåò
ðàçìåðà 10 ìèêðîí. Ýòî óñòîé÷èâûé ðàçìåð
ñóùåñòâîâàíèÿ âîäÿíîé êàïëè, è èìåííî â ýòîì
ñîñòîÿíèè îíà æèâåò îêîëî ÷àñà. Òàê ïðîèñõîäèò
íàä îêåàíîì, â ìîðñêîé, èëè òàê íàçûâàåìîé
ôîíîâîé, àòìîñôåðå.
À åñëè îáëàêà îáðàçóþòñÿ íàä
èíäóñòðèàëüíîé çîíîé, òî êàïëÿ îáðàçóåòñÿ òàêæå,
òîëüêî öåíòðàìè êîíäåíñàöèè ñëóæàò äðóãèå
àýðîçîëüíûå ÷àñòè÷êè, íàïðèìåð îêñèäû æåëåçà è
ìàðãàíöà. Èõ âûáðàñûâàþò â âîçäóõ ïðîìûøëåííûå
ïðåäïðèÿòèÿ, íàïðèìåð òåïëîâûå ýëåêòðîñòàíöèè,
ðàáîòàþùèå íà óãëå èëè ìàçóòå. Â òîïêå
æåëåçîîðãàíè÷åñêèå è ìàðãàíåöîðãàíè÷åñêèå
ñîåäèíåíèÿ, ñîäåðæàëèñü â óãëå èëè íåôòè, ñãîðàþò
è âûëåòàþò â àòìîñôåðó â âèäå ïðîêàëåííûõ,
ïîëíîñòüþ îáåçâîæåííûõ îêñèäîâ. Òàêèå
ïðîêàëåííûå îêñèäû òîæå ãèäðîôèëüíû è ïîýòîìó
ñëóæàò öåíòðàìè êîíäåíñàöèè äëÿ îáëà÷íûõ êàïåëü.
Âîò ïî÷åìó â äîæäå íàõîäÿò èîíû æåëåçà è
ìàðãàíöà, â äîñòàòî÷íî áîëüøèõ êîíöåíòðàöèÿõ (äî
10-4 ìîëü/ë è 10-6 ìîëü/ë
ñîîòâåòñòâåííî). À åùå – èîíû êàëüöèÿ, ìàãíèÿ,
àììîíèÿ. Ñ àììîíèåì ïîíÿòíî: ðàñòâîðÿåòñÿ
àòìîñôåðíûé àììèàê, è òåì áûñòðåå, ÷åì êèñëåå
êàïëÿ (àììèàê ïðè ýòîì ïðåâðàùàåòñÿ â NH+4
), à êàëüöèé, ìàãíèé, êðåìíèé – ÷àñòè÷êè ïûëè
îò÷àñòè ïðèðîäíîãî, à îò÷àñòè àíòðîïîãåííîãî
ïðîèñõîæäåíèÿ (íàïðèìåð, âûáðîñû öåìåíòíûõ
çàâîäîâ).
Õèìè÷åñêèé ðåàêòîð â êàæäîé êàïëå
Åñëè ðàñïîëîæèòü êèñëîòû ïî ìåðå óìåíüøåíèÿ èõ
ñîäåðæàíèÿ â äîæäåâîé êàïëå, òî ìû ïîëó÷èì òàêîé
ðÿä: ñåðíàÿ, àçîòíàÿ, ìóðàâüèíàÿ, ùàâåëåâàÿ è
óêñóñíàÿ. Èõ êîíöåíòðàöèè îòëè÷àþòñÿ ïðèìåðíî â
äåñÿòü ðàç ïðè ïåðåõîäå îò îäíîé êèñëîòû ê
äðóãîé. Áîëüøå âñåãî â äîæäåâîé êàïëå ñåðíîé
êèñëîòû. Îòêóäà æå îíà òàì áåðåòñÿ, åñëè, êàê ìû
óïîìÿíóëè âûøå, ýòî íå ïðîñòîå ðàñòâîðåíèå
ñåðíèñòîãî ãàçà?
Íàä ïîâåðõíîñòüþ îêåàíà, â ôîíîâîé àòìîñôåðå,
ðåàëèçóþòñÿ öåëûõ òðè ìåõàíèçìà. Îñíîâíîé
ìåõàíèçì, ïî êîòîðîìó íàä îêåàíîì îáðàçóåòñÿ
ñåðíàÿ êèñëîòà, çàêëþ÷àåòñÿ â îêèñëåíèè
ñåðíèñòîé êèñëîòû ïåðåêèñüþ âîäîðîäà. Ñåðíèñòàÿ
êèñëîòà ïîëó÷àåòñÿ èç SO2, à îí â ñâîþ
î÷åðåäü èç äèìåòèëñóëüôèäà (ÑÍ3)2S,
êîòîðûé âûäåëÿåòñÿ ïðè æèçíåäåÿòåëüíîñòè
îðãàíèçìîâ. Ïåðåêèñè âîäîðîäà íàä îêåàíîì òîæå
õâàòàåò, ïîñêîëüêó îíà ïîëó÷àåòñÿ ïðè îêèñëåíèè
ìåòàíà (îí ïîäíèìàåòñÿ èç áîëîò è ðèñîâûõ ïîëåé, à
ïîòîì ðàâíîìåðíî ðàñïðåäåëÿåòñÿ ïî âñåé
àòìîñôåðå). Ñåðíèñòûé ãàç è ïåðåêèñü
ðàñòâîðÿþòñÿ â êàïëå, è â ðåçóëüòàòå ïðîèñõîäèò
ñëåäóþùåå:
SO2 + Í2Îàòì Í+ + ÍSO3-
Í2Î2 + ÍSO3- + Í+ Í2Î
+ SÎ42- + 2Í+
Ýòî àâòîêàòàëèòè÷åñêèé ïðîöåññ, òàê êàê äëÿ åãî
ïðîòåêàíèÿ íóæåí Í+, êîòîðûé ïîëó÷àåòñÿ â
ýòîé æå ðåàêöèè.
Íî ñåðíàÿ êèñëîòà ìîæåò îáðàçîâûâàòüñÿ è â
ãàçîâîé ôàçå.  ýòîé ðåàêöèè ó÷àñòâóåò ãëàâíûé
÷èñòèëüùèê àòìîñôåðû, ñâîáîäíûé ãèäðîêñèë (åãî â àòìîñôåðå ïðèìåðíî 106
øòóê/ñì3, è îáðàçóåòñÿ îí áëàãîäàðÿ îçîíó
(ñì. “Õèìèþ è æèçíü”, 2000, N7):
Ãàçîâûå ìîëåêóëû ñîåäèíÿþòñÿ, è îáðàçóþòñÿ
ìèêðîêàïåëüêè êîíöåíòðèðîâàííîé ñåðíîé êèñëîòû.
Ýòà êàïåëüêà ìîæåò ñòàòü öåíòðîì êîíäåíñàöèè,
ñëèòüñÿ ñ îáëà÷íîé êàïëåé èëè ïðîðåàãèðîâàòü ñ
àììèàêîì è äàòü êèñëûé ñåðíîêèñëûé àììîíèé (NÍ4ÍSO4),
êîòîðûé òîæå ìîæåò áûòü öåíòðîì êîíäåíñàöèè.
Íî ñåðíàÿ êèñëîòà ìîæåò ïîëó÷àòüñÿ åùå è
òðåòüèì ñïîñîáîì – â ðàñòâîðå, íî îïÿòü æå ñ
ïîìîùüþ ÎÍ ðàäèêàëà:
Ðåàêöèÿ öåïíàÿ, òàê êàê îáðàçóåòñÿ ðàäèêàë SO3-
, êîòîðûé ìîæåò ñíîâà ðåàãèðîâàòü ñ êèñëîðîäîì, è
ò.ä. Ïðàâäà, äëèííîé öåïè íå ïîëó÷àåòñÿ, ïîñêîëüêó
êîíöåíòðàöèÿ ñåðíèñòîé êèñ ëîòû â êàïëå íàä
îêåàíîì íåáîëüøàÿ.
Ïîìèìî SO2, â ìîðñêîé êàïëå ðàñòâîðÿåòñÿ è
ôîðìàëüäåãèä, êîòîðûé ïîëó÷àåòñÿ ïîñëå
îêèñëåíèÿ ìåòàíà â àòìîñôåðå. Îáðàçóåòñÿ
ãèäðàòèðîâàííàÿ ôîðìà ôîðìàëüäåãèäà; åãî
êîíöåíòðàöèÿ â êàïëå äàæå âûøå, ÷åì ñåðíèñòîé
êèñëîòû, è îí òîæå ðåàãèðóåò ñ ÎÍ-ðàäèêàëîì. Â
ðåçóëüòàòå ðÿäà ðåàêöèé ïîëó÷àåòñÿ ìóðàâüèíàÿ
êèñëîòà ÍÑÎÎÍ. Îêèñëÿÿñü, îíà äàåò ùàâåëåâóþ.
Îäíàêî, íåñìîòðÿ íà âåñü ýòîò áóêåò ðåàêöèé,
êèñëîòíîñòü îáëàêîâ ìîðñêîé àòìîñôåðû íåáîëüøàÿ
(ðÍ ðåäêî îïóñêàåòñÿ íèæå 5).
À ÷òî æå ïðîèñõîäèò íàä ïðîìûøëåííûìè ðàéîíàìè?
Âî-ïåðâûõ, òàì íàìíîãî áîëüøå SO2,. Åñëè íàä
ïîâåðõ íîñòüþ îêåàíà, â ôîíîâîé àòìîñôåðå, åãî
êîëè÷åñòâà èçìåðÿþòñÿ äîëÿìè ððÜ (ppb – ÷èñëî
ìîëåêóë íà ìèëëèàðä ìîëåêóë âîçäóõà), òî â
èíäóñòðèàëüíûõ ðàéîíàõ ñîäåðæàíèå SO2 ìîæåò
äîñòèãàòü 100 ppb è äàæå áîëüøå, òî åñòü â òûñÿ÷è ðàç
áîëüøå, ÷åì íàä îêåàíîì. Íî ñàìîå íåïðèÿòíîå òî,
÷òî íàä èíäóñòðèàëüíûìè ðàéîíàìè ðàáîòàåò
ñîâñåì äðóãîé ìåõàíèçì îáðàçîâàíèÿ ñåðíîé
êèñëîòû, êîòîðûé ìàëî çàâèñèò îò ñîäåðæàíèÿ
ÎÍ-ðàäèêàëà. Ìû óæå ãîâîðèëè, ÷òî â êàïëÿõ äîæäÿ
íàõîäÿò òàêæå èîíû æåëåçà è ìàðãàíöà. È âîò
îêàçàëîñü (ñîãëàñíî ïîñëåäíèì ðàáîòàì ó÷åíûõ,
çàíèìàþùèõñÿ õèìèåé àòìîñôåðû), ÷òî íàä
ïðîìûøëåííûìè ðàéîíàìè ïðîòåêàåò íå òîëüêî
öåïíîé ïðîöåññ îêèñëåíèÿ ñåðíèñòîé êèñëîòû â
ñåðíóþ, íî è êàòàëèòè÷åñêèé. Òî åñòü èîíû æåëåçà
ðàáîòàþò êàòàëèçàòîðîì îêèñëåíèÿ ñóëüôèòà, à Mn
åùå è ìíîãîêðàòíî óñêîðÿåò ýòîò ïðîöåññ. Ïðè÷åì
ýòè êàòàëèçàòîðû íàñòîëüêî àêòèâíû, ÷òî ðîëü
ÎÍ-ðàäèêàëà ñòàíîâèòñÿ ìàëî çíà÷èìîé:
Ïîëó÷àåòñÿ ñî÷åòàíèå êàòàëèòè÷åñêîãî è
öåïíîãî ïðîöåññîâ – öåïíî êàòàëèòè÷åñêàÿ
ðåàêöèÿ. È åñëè íàä îêåàíîì îêèñëåíèå ïðîèñõîäèò
â îñíîâíîì äíåì, êîãäà ÎÍ-ðàäèêàëîâ ìíîãî, òî íàä
çàãðÿçíåííûìè ðàéîíàìè êàòàëèòè÷åñêîå
îêèñëåíèå ñåðíèñòîãî ãàçà èäåò ñ òîé æå
ñêîðîñòüþ è äíåì è íî÷üþ.
Îáëàêà, êîòîðûå îáðàçóþòñÿ â èíäóñòðèàëüíîé
àòìîñôåðå, ìîãóò èìåòü ðÍ=3. Êñòàòè, ïî÷åìó ðÍ
äîæäåâîé êàïëè òîëüêî 3, à íå 2 è íå 1?
Ðàñòâîðèìîñòü ðàçíûõ âåùåñòâ â âîäå ñâÿçàíà ñ
òåì, ðåàãèðóþò îíè ñ âîäîé èëè íåò. Íàïðèìåð, Í2Î2
ïðîñòî ðàñòâîðÿåòñÿ â êàïëå, íå ïðåòåðïåâàÿ
èçìåíåíèé. À âîò SO2, ðàñòâîðÿåòñÿ è
ïðåâðàùàåòñÿ â Í2SO3, êîòîðàÿ
äèññîöèèðóåò íà Í+ è ÍSO3- . À òàê
êàê âåùåñòâî ïåðåõîäèò â äðóãèå õèìè÷åñêèå
ôîðìû, åãî ðàñòâîðèìîñòü ðåçêî âîçðàñòàåò
(ðàñòâîðèìîñòü àììèàêà òîæå ðåçêî âîçðàñòàåò,
ïîòîìó ÷òî îí ïåðåõîäèò â NÍ4+).
Ïîíÿòíî, ÷òî ÷åì áîëüøå êîíöåíòðàöèÿ èîíîâ
âîäîðîäà â âîäå, òåì ìåíüøå áóäåò ðàñòâîðÿòüñÿ SO2
òàê êàê ðàâíîâåñèå äèññîöèàöèè è ðàñòâîðåíèÿ
áóäåò ñäâèíóòî âëåâî. Òî åñòü êàïëÿ îáðàçîâàëàñü,
íàáðàëà SO2, êîòîðûé ñîäåðæèòñÿ â âèäå ÍSO3-,
íà÷àëàñü õèìè÷åñêàÿ ðåàêöèÿ, ðÍ ñòàë
óìåíüøàòüñÿ, è ðàñòâîðèìîñòü SO2, ñòàëà
ïàäàòü. Ïîëó÷àåòñÿ, ÷òî ýòà ðåàêöèÿ –
ñàìîòîðìîçÿùàÿñÿ: îíà íà÷èíàåòñÿ ñ îäíîé
ñêîðîñòüþ è èäåò ïîòîì âñå ìåäëåííåå è ìåäëåííåå.
Ïîýòîìó çà îäèí ÷àñ, òî åñòü çà âñþ ñâîþ æèçíü,
êàïëÿ óñïåâàåò ñíèçèòü ñâîé ðÍ òîëüêî äî 3.
 Ñ àçîòíîé êèñëîòîé, êîòîðóþ
Ñ àçîòíîé êèñëîòîé, êîòîðóþ
íàõîäÿò â äîæäå, âñå ãîðàçäî ïðîùå, òàê êàê îíà
îáðàçóåòñÿ â ðåçóëüòàòå ïðîñòîãî ðàñòâîðåíèÿ. Â
àòìîñôåðå åñòü ïðàêòè÷åñêè âñå îêèñëû àçîòà: NÎ,
NÎ2, N2Î5 , èç êîòîðûõ è ïîëó÷àþòñÿ
àçîòíàÿ è àçîòèñòàÿ êèñëîòû. Àçîòíûå îêèñëû
ïîïàäàþò â àòìîñôåðó â ðåçóëüòàòå ñæèãàíèÿ óãëÿ,
íåôòè, ãàçà, ìàçóòà è áåíçèíà â äâèãàòåëÿõ
âíóòðåííåãî ñãîðàíèÿ.
Êàê áîðîòüñÿ ñ êèñëîòîé â àòìîñôåðå
Äàâíî óæå ÿñíî, ÷òî åñëè ìû íå õîòèì ïîãóáèòü
îêðóæàþùóþ ñðåäó, òî íàäî áîðîòüñÿ ñ âûáðîñàìè SO2.
Êàæäûé ãîä â àòìîñôåðó ïîïàäàåò îêîëî 100 ìëí. òîíí
SO2 ïðè÷åì òîëüêî òðåòü ïðèõîäèòñÿ íà äîëþ
ïðèðîäû (7-8 ìëí. òîíí/ãîä – èç âóëêàíîâ; 6 ìëí.
òîíí/ãîä – èç ñåðîâîäîðîäà, ïðîäóêòà ãíèåíèÿ
îðãàíè÷åñêèõ ìàññ; 15-30 ìëí. òîíí/ãîä – èç
äèìåòèëñóëüôèäà), à îñòàëüíûå äâå òðåòè – ýòî
âûáðîñû ìåòàëëóðãè÷åñêèõ ïðåäïðèÿòèé è,
ðàáîòàþùèõ íà óãëå è ìàçóòå,
òåïëîýëåêòðîñòàíöèé.
Ñ âûáðîñàìè äåéñòâèòåëüíî íà÷àëè áîðîòüñÿ â
ðàçâèòûõ èíäóñòðèàëüíûõ ñòðàíàõ. Äëÿ ýòîãî
ýëåêòðîñòàíöèè îñíàùàþò ñêðóááåðàìè: ïðåæäå ÷åì
âûáðîñèòü ãàç â àòìîñôåðó, â ñêðóááåðå åãî
îðîøàþò ùåëî÷íîé âîäîé, ñîäåðæàùåé èîíû æåëåçà,
÷òî áû ïðîèñõîäèëî óæå èçâåñòíîå íàì
êàòàëèòè÷åñêîå îêèñëåíèå. Ïðàâäà, òàêèå
óñòàíîâêè äîñòàòî÷íî äîðîãè – ñòîèìîñòü ýíåðãèè
íà ýëåêòðîñòàíöèÿõ, îñíàùåííûõ òàêèìè
î÷èñòèòåëÿìè, âîçðîñëà íà 30%. Ïîýòîìó â Ðîññèè,
Êèòàå è â ñòðàíàõ òðåòüåãî ìèðà ñêðóááåðíûå
óñòàíîâêè ïîêà íå ïðèìåíÿþò.
Âîîáùå, äëÿ Ðîññèè ìàñøòàáû ýòîãî áåäñòâèÿ
âñåãäà áûëè íå ñòîëü âåëèêè, âî âñÿêîì ñëó÷àå, äî
íåäàâíåãî âðåìåíè. Âî-ïåðâûõ, ó íàñ îãðîìíàÿ
òåððèòîðèÿ, âî-âòîðûõ, íà äóøó íàñåëåíèÿ ìû
ïðîèçâîäèì ãî ðàçäî ìåíüøå ýíåðãèè, ÷åì ÑØÀ,
Àíãëèÿ èëè Ãåðìàíèÿ, è â-òðåòüèõ, áîëüøèíñòâî
íàøèõ ýëåêòðîñòàíöèé ðàáîòàëî íà ãàçå, à ãàç íå
ñîäåðæèò ñîåäèíåíèé ñåðû. Íî âñêîðå ñèòóàöèÿ
ìîæåò èçìåíèòüñÿ êîðåííûì îáðàçîì. Ïîñêîëüêó
ïðîäàâàòü ãàç ÷ðåçâû÷àéíî âûãîäíî, Ãàçïðîì ðåøèë
íå òðàòèòü åãî çðÿ è ïåðåâåñòè òåïëîâûå ñòàíöèè
Ðîññèè ñ ãàçà íà óãîëü. Âïðî÷åì, ðàíî èëè ïîçäíî
ýòî âñå ðàâíî ïðèøëîñü áû ñäåëàòü, òàê êàê ïðè
ñîâðåìåííîì ðàñõîäå çàïàñîâ ãàçà õâàòèò âñåãî íà
60 ëåò, à óãëÿ íà 600. Êàçàëîñü áû, çàòåÿ ïåðåâåñòè
âñå ñòàíöèè íà óãîëü è ìàçóò íå òàê óæ è ïðîñòà –
âåäü îáîðóäîâàíèå ïðèñïîñîáëåíî èìåííî ïîä ãàç.
Íî âñïîìíèëè, ÷òî â ñâîå âðåìÿ ó÷åíûé È.À.Õèíò
ðàçðàáîòàë äåçèíòåãðàöèîííûé è î÷åíü
ýêîíîìè÷íûé ìåòîä äðîáëåíèÿ. Ó÷åíîãî ïîñàäèëè, à
ìåòîä îñòàëñÿ. Âîò è ñîáèðàþòñÿ ïî ýòîìó ìåòîäó
äðîáèòü óãîëü è ñ âîäÿíîé ïóëüïîé ïðÿìî ïî òåì æå
ãàçîâûì òðóáàì ïîäàâàòü â ãîðåëêó. Êîíå÷íî,
òåïëîòâîðíàÿ ñïîñîáíîñòü áóäåò íèæå, íî çàòî
áîëüøèõ ïåðåäåëîê íå ïîòðåáóåòñÿ. È âîò òîãäà î
êèñëîòíûõ äîæäÿõ â Ðîññèè ïðèäåòñÿ çàäóìàòüñÿ
âñåðüåç, âåäü ïåðåä ãëàçàìè ïðèìåð Êèòàÿ, â
êîòîðîì óæå èíîãäà ñòàíîâèòñÿ òðóäíî äûøàòü.
Åñòü åùå îäèí ñïîñîá áîðüáû ñ âûáðîñàìè
ñåðíèñòîãî ãàçà: óñîâåðøåíñòâîâàòü ñòîÿùèå íà
êàæäîé ýëåêòðîñòàíöèè ýëåêòðîñòàòè÷åñêèå
ôèëüòðû, êîòîðûå óëàâëèâàþò ïûëü èç âûáðîñîâ.
Ýòî, êîíå÷íî, òîæå ñòîèò äåíåã, íî çíà÷èòåëüíî
ìåíüøèõ, ÷åì ñòðîèòåëüñòâî ñêðóááåðíîé
óñòàíîâêè. Ñòàíöèè áóäóò âûáðàñûâàòü ìåíüøå
ïûëè, ñîäåðæàùåé îêñèäû æåëåçà è ìàðãàíöà, à
çíà÷èò, ïðîöåññ îêèñëåíèÿ â êàïëå ïîéäåò
ìåäëåííåå, è äîæäü íå áóäåò òàê çàêèñëÿòüñÿ. Íî
ðàíî èëè ïîçäíî ñêðóááåðíûå óñòàíîâêè âñå ðàâíî
ïðèäåòñÿ ñòðîèòü. È çäåñü åñòü íåáîëüøàÿ íàäåæäà
íà ïîìîùü ñîñåäåé. Âñïîìíèòå ïðî òðàíñãðàíè÷íûé
ïåðåíîñ, è âàì ñòàíåò ÿñíî, ÷òî ïðîáëåìà ýòî âîâñå
íå îäíîé ñòðàíû.
Источник
