Какие из веществ могут проявлять только окислительные свойства

Задача 619.
На основе электронного строения атомов указать, могут ли быть окислителями: атомы натрия, катионы натрия, кислород в степени окисленности -2, йод в степени окисленности 0, фторид-ионы, катионы водорода, нитрит-ионы и, гидрид-ионы.
Решение:
Вещества, содержащие атомы элементов, которые уменьшают свою степень окисленности, называются окислителями.
Атомы натрия Na содержат по одному электрону на внешней электронной оболочке, поэтому они могут только отдавать электроны, т.е. натрий – восстановитель.
В катионе натрия атом натрия имеет степень окисленности +1, т.е. он может уменьшать свою степень окисленности, проявляя свойства окислителя.
Кислород в степени окисленности -2 может увеличивать свою степень окисленности, проявляя свойства восстановителя.
Иод в степени окисленности 0 может, как понижать, так и повышать свою степень окисленности, т.е. может быть окислителем.
Атом фтора в фторид-ионе имеет степень окисленности -1, поэтому может увеличивать свою степень окисленности, проявляя свойства окислителя.
Атомы водорода в катионах водорода находятся в степени окисленности +1, т.е. могут уменьшать свою степень окисленности, проявляя свойства окислителя.
В нитрит-ионе атомы азота находятся в своей промежуточной степени окисленности +4, поэтому могут как уменьшать, так и увеличивать степень окисленности, проявляя свойства и восстановителя, и окислителя.
Атомы водорода в гидрид-ионе находятся в своей наименьшей степени окисленности, значит, они могут увеличивать свою степень окисленности, проявляя свойства окислителя.
Задача 620.
Какие из перечисленных ионов могут служить восстановителями, а какие не могут и почему: Cu2+, Sn2+, Cl-, VO3-, S2-, ,Fe2+ WO42-, IO4-, Al3+, Hg2+, Hg22+?
Решение:
Окислители – частицы, которые способны понижать степень окисленности элемента.
В ионе Cu2+ атом меди находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, т.е. проявлять свойства окислителя.
В ионе Sn2+ атомы олова находятся в промежуточной степени окисленности, поэтому олово в данном ионе может, как понижать, так и повышать свою степень окисленности, проявляя свойства или окислителя, или восстановителя.
Хлор в ионе Cl- имеет самую низшую степень окисленности, поэтому может только повышать свою степень окисленности, проявляя свойства восстановителя.
Атом ванадия в ионе VO3- находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Сера в ионе S2+ находится в своей низшей степени окисленности, поэтому может только повышать свою степень окисленности, проявляя свойства восстановителя.
Атом железа в ионе Fe2+ находится в промежуточной степени окисленности, поэтому может, как повышать, так и понижать свою степень окисленности, т. е. проявлять свойства или окислителя, или восстановителя.
Атом вольфрама в ионе WO42- находится в своей высшей степени окисленности (+6), поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Иод в ионе IO3- находится в своей высшей степени окисленности (+7), поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Алюминий в ионе Al3+ находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Ртуть в ионе Hg2+ находится в своей высшей степени окисленности, поэтому может только понижать степень окисленности, проявляя свойства окислителя.
Ртуть в ионе Hg22+ находится в промежуточной степени окисленности (+1), поэтому может, как понижать, так и повышать свою степень окисленности, проявляя свойства или окислителя, или восстановителя.
Задача 621.
Какие из перечисленных веществ и за счет, каких элементов проявляют обычно окислительные свойства, и какие – восстановительные? Указать те из них, которые обладают окислительно-восстановительной двойственностью: H2S, SO2, CO, Zn, F2, NaNO2, KMnO4, HOCl, H3SbO3.
Решение:
а) В H2S сера находится в низшей степени окисления (-2), поэтому может только увеличивать свою степень окисления, проявляя свойства восстановителя.
б) В SO2 сера находится в промежуточной степени окисления (+4), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
в) В СО атом углерода находится в промежуточной степени окисления (+2), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
г) В Zn атом находится в своей низшей степени окисления (0), поэтому может только увеличивать свою степень окисления, проявляя свойства восстановителя.
д) В молекуле F2 атом фтора имеет степень окисления равную 0, а также, обладая самой высокой степенью окисления среди всех элементов, может только присоединять недостающий до полного завершения внешнего электронного слоя один электрон, проявляя свойства окислителя.
е) В NaNO2 атом азота находится в промежуточной степени окисления равной +4, поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
ж) В KMnO4 находится в высшей степени окисления (+7), поэтому может только уменьшать свою степень окисления, проявляя свойства окислителя.
з) В НOCl атом хлора находится в степени окисления равной +1, поэтому может как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
к) В H3SbO3 атом сурьмы находится в промежуточной степени окисления (+3), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
Источник
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (п) понимают условный заряд атома, который вычисляют исходя из предположения, что молекула состоит только из ионов. Иными словами: степень окисления — это условный заряд, который приобрел бы атом элемента, если предположить, что они принял или отдал то или иное число электронов.
Окисление-восстановление — это единый, взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя, а восстановление — к ее понижению у окислителя.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях: окислитель принимает электроны, а восстановитель их отдает. При этом не имеет значения, переходят ли электроны от одного атома к другому полностью, и образуются ионные связи, или электроны только оттягиваются к более электроотрицательному атому, и возникает полярная связь. О способности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов окислителя и восстановителя.
Атом того или иного элемента в своей высшей степени окисления не может ее повысить (отдать электроны) и проявляет только окислительные свойства, а в своей низшей степени окисления не может ее понизить (принять электроны) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства. Например:
| N5+(HNO3) | S6+(H2SO4) | Проявляют только окислительные свойства |
| N4+(NO2) | S4+(SO2) | Проявляют окислительные и восстановительные свойства |
| N3+(NH2) | ||
| N2+(NO) | S2+(SO) | |
| N+(N2O) | ||
| N0(N2) | S0(S2; S8) | |
| N-(NH2OH) | S-1(H2S2) | |
| N2-(N2H4) | ||
| N3-(NH3) | S2-(H2S) | Проявляют только восстановительные свойства |
При окислительно-восстановительных реакциях валентность атомов может и не меняться. Например, в окислительно-восстановительной реакции Н°2 + С1°2= 2Н+Сl- валентность атомов водорода и хлора до и после реакции равна единице. Изменилась их степень окисления. Валентность определяет число связей, образованных данным атомом, и поэтому знака заряда не имеет. Степень же окисления имеет знак плюс или минус.
Пример 1.Определение окислительной и восстановительной способности веществ.
Исходя из степени окисления (п) азота, серы и марганца в соединениях NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2 и KMnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение.Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S) соответственно равна: -2 (низшая), +4 (промежуточная), +6 (высшая); л(Мп) соответственно равна: + 4 (промежуточная), +7 (высшая). Отсюда: NH3, H2S — только восстановители; HNO3, H2SO4, КМпОд — только окислители; HNO2, H2SO3, MnO2 — окислители и восстановители.
Пример 2.Определение возможности протекания окислительно-восстановительных реакций
Могут ли происходит окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и H2SO3; в) H2SO3 и НС1О4?
Решение:а) степень окисления в H2S w(S) = -2; в HI и(1) = -1. Так как и сера, и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут; б) в H2S n(S) = -2 (низшая), в H2SO3 n(S) = +4 (промежуточная).Следовательно, взаимодействие этих веществ возможно, причем H2SO3 является окислителем; в) в H2SO3 n(S) = +4 (промежуточная); в НС1О4 n(С1) = +7 (высшая). Взятые вещества могут взаимодействовать, H2SO3 в этом случае будет проявлять восстановительные свойства.
Пример 3.Методы составления уравнений окислительно-восстановительных реакций
Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
+7 +3 +2 +5
KMnO4+H3PO3+H2SO4→MnSO4+ Н3РО4+ K2SO4 + Н2О
Решение.Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
восстановитель 5 Р3+ — 2е- = Р5+ процесс окисления
окислитель 2 Мn7+ + 5е-= Мn2+ процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид
2КМпО4 + 5Н3РО3 + 3H2SO4 = 2MnSO4 + 5Н3РО4 + K2SO4 + ЗН2О
Пример 4.Составление уравнений окислительно-восстановительных реакций с учетом степени окисленности
Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение.Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительная функция принадлежит сере (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p-элемента VIA-группы равна -2. Цинк как металл IIВ-группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
восстановитель Zn — 2e–= Zn2+ процесс окисления
окислитель S6+ + 8е- = S2-процесс восстановления
Составляем уравнение реакции:
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыремолекулы H2SO4 идут на связывание четырех ионов Zn2+.
Источник
Кремний – твёрдый неметалл, входящий в состав горных пород. При обычных условиях инертен, но при нагревании проявляет окислительные и восстановительные свойства. Химические свойства кремния использует силикатная промышленность для изготовления стекла, зеркал, электроники, строительного материала.
Общее описание элемента
Кремний расположен в четвёртой группе и третьем периоде таблицы Менделеева. Ядро атома кремния имеет положительный заряд +14. Вокруг ядра движется 14 отрицательно заряженных электронов.
Атом может переходить в возбуждённое состояние за счёт свободного d-подуровня. Поэтому элемент проявляет две положительные степени окисления (+2 и +4) и одну отрицательную (-4). Электронная конфигурация – 1s22s22p63s23p2.
Рис. 1. Строение атома кремния.
Кремний – хрупкий полупроводник с высокими температурами правления и кипения. Относительно лёгкий неметалл: плотность составляет 2,33 г/см3.
В чистом виде кремний не встречается. Входит в состав песка, кварца, агата, аметиста и других пород.
Рис. 2. Агат.
Реакции с неметаллами
При взаимодействии с неметаллами кремний проявляет восстановительные свойства – отдаёт электроны. Реакции возможны только при сильном нагревании. При нормальных условиях кремний реагирует только с фтором. Реакции с основными неметаллами приведены в таблице.
Элемент | Описание | Реакция |
Фтор | При обычных условиях | Si + 2F2 → SiF4 |
Кислород | Взаимодействует при 600°C с образованием диоксида (песка) | Si + O2 → SiO2 |
Хлор | Реагирует при 400°C | Si + 2Cl2 → SiCl4 |
Углерод | Реагирует при 2000°C с образованием карборунда | Si + C → SiC |
Азот | Протекает при 1000°C | 3Si + 2N2 → Si3N4 |
Сера | Реагирует при 1000°C | Si + 2S → SiS2 |
Бор | Взаимодействует при 2000°C | Si + 3B → B3Si |
Гидрид кремния – силан (SiH4) – можно получить путём разложения силицидов кислотой. Например, Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Взаимодействие с металлами
Окислительные свойства кремний проявляет только в реакциях с металлами. При сплавлении образуются соли – силициды:
- Si + 2Mg → Mg2Si;
- Si + 2Ca → Ca2Si;
- Si + Na → NaSi;
- 2Si + Fe → FeSi2.
Силициды используются в промышленности для производства сплавов и материалов. В качестве сверхпроводника используется силицид ванадия (V3Si), полупроводника – силицид рения (ReSi).
Реакции со сложными веществами
Помимо простых веществ кремний реагирует со сложными соединениями – кислотами и щелочами. Основные реакции описаны в таблице.
Реакция | Описание | Уравнение |
С галогеноводородами | Реагирует с плавиковой кислотой при обычных условиях, с соляной кислотой – при 300°С, с бромоводородом – при 500°С | – Si + 4HF → SiF4 + 2H2; – Si + 4HCl → SiCl4 + 2H2; – Si + 4HBr → SiBr4 + 2H2 |
С кислотами | Является устойчивым по отношению к кислотам, покрываясь оксидной плёнкой. Реакция идёт только со смесью азотной и плавиковой кислот | 3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O |
Со щелочами | В водных растворах растворяется, образуя силикаты и водород | Si + 2KOH + H2O → K2SiO3 + H2 |
При 1200°C кремний реагирует с диоксидом, образуя монооксид: Si + SiO2 → SiO.
Рис. 3. Применение кремния.
Что мы узнали?
Кремний – хрупкий неметалл, взаимодействующий с металлами, неметаллами и сложными веществами. В реакциях с металлами проявляет свойства окислителя, с неметаллами – восстановителя. Реагирует при нормальных условиях только с фтором, плавиковой кислотой (в том числе вместе с азотной кислотой), со щелочами. Остальные реакции протекают при повышенных температурах.
Предыдущая
ХимияХимические свойства алканов – применение, формулы (химия, 9 класс)
Следующая
ХимияХимические свойства неметаллов, с чем реагируют – таблица (химия, 9 класс)
Источник
Кремний – твёрдый неметалл, входящий в состав горных пород. При обычных условиях инертен, но при нагревании проявляет окислительные и восстановительные свойства. Химические свойства кремния использует силикатная промышленность для изготовления стекла, зеркал, электроники, строительного материала.

Общее описание элемента
Кремний расположен в четвёртой группе и третьем периоде таблицы Менделеева. Ядро атома кремния имеет положительный заряд +14. Вокруг ядра движется 14 отрицательно заряженных электронов.
Атом может переходить в возбуждённое состояние за счёт свободного d-подуровня. Поэтому элемент проявляет две положительные степени окисления (+2 и +4) и одну отрицательную (-4). Электронная конфигурация – 1s22s22p63s23p2.
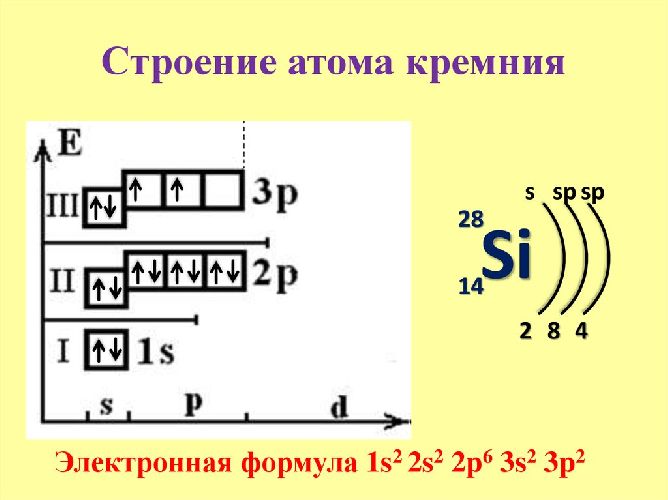
Рис. 1. Строение атома кремния.
Кремний – хрупкий полупроводник с высокими температурами правления и кипения. Относительно лёгкий неметалл: плотность составляет 2,33 г/см3.
В чистом виде кремний не встречается. Входит в состав песка, кварца, агата, аметиста и других пород.

Рис. 2. Агат.
Реакции с неметаллами
При взаимодействии с неметаллами кремний проявляет восстановительные свойства – отдаёт электроны. Реакции возможны только при сильном нагревании. При нормальных условиях кремний реагирует только с фтором. Реакции с основными неметаллами приведены в таблице.
Элемент | Описание | Реакция |
Фтор | При обычных условиях | Si + 2F2 → SiF4 |
Кислород | Взаимодействует при 600°C с образованием диоксида (песка) | Si + O2 → SiO2 |
Хлор | Реагирует при 400°C | Si + 2Cl2 → SiCl4 |
Углерод | Реагирует при 2000°C с образованием карборунда | Si + C → SiC |
Азот | Протекает при 1000°C | 3Si + 2N2 → Si3N4 |
Сера | Реагирует при 1000°C | Si + 2S → SiS2 |
Бор | Взаимодействует при 2000°C | Si + 3B → B3Si |
Гидрид кремния – силан (SiH4) – можно получить путём разложения силицидов кислотой. Например, Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Взаимодействие с металлами
Окислительные свойства кремний проявляет только в реакциях с металлами. При сплавлении образуются соли – силициды:
- Si + 2Mg → Mg2Si;
- Si + 2Ca → Ca2Si;
- Si + Na → NaSi;
- 2Si + Fe → FeSi2.
Силициды используются в промышленности для производства сплавов и материалов. В качестве сверхпроводника используется силицид ванадия (V3Si), полупроводника – силицид рения (ReSi).
Реакции со сложными веществами
Помимо простых веществ кремний реагирует со сложными соединениями – кислотами и щелочами. Основные реакции описаны в таблице.
Реакция | Описание | Уравнение |
С галогеноводородами | Реагирует с плавиковой кислотой при обычных условиях, с соляной кислотой – при 300°С, с бромоводородом – при 500°С | – Si + 4HF → SiF4 + 2H2; – Si + 4HCl → SiCl4 + 2H2; – Si + 4HBr → SiBr4 + 2H2 |
С кислотами | Является устойчивым по отношению к кислотам, покрываясь оксидной плёнкой. Реакция идёт только со смесью азотной и плавиковой кислот | 3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O |
Со щелочами | В водных растворах растворяется, образуя силикаты и водород | Si + 2KOH + H2O → K2SiO3 + H2 |
При 1200°C кремний реагирует с диоксидом, образуя монооксид: Si + SiO2 → SiO.
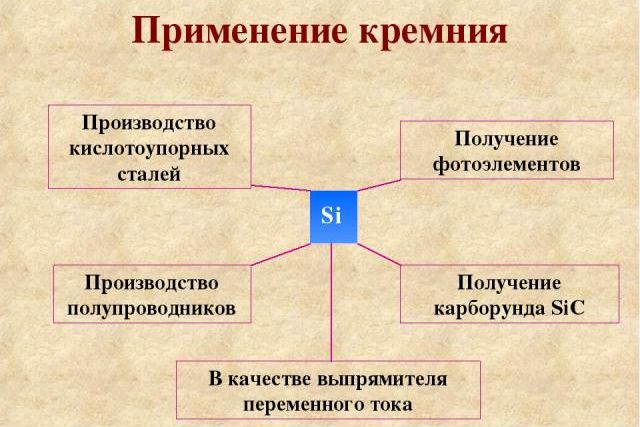
Рис. 3. Применение кремния.
Что мы узнали?
Кремний – хрупкий неметалл, взаимодействующий с металлами, неметаллами и сложными веществами. В реакциях с металлами проявляет свойства окислителя, с неметаллами – восстановителя. Реагирует при нормальных условиях только с фтором, плавиковой кислотой (в том числе вместе с азотной кислотой), со щелочами. Остальные реакции протекают при повышенных температурах.
Тест по теме
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 104.
Источник
