Какие из веществ могут проявлять окислительные свойства

Окислительно-восстановительные реакции могут проходить только при условии, что исходные компоненты содержат атомы, молекулы или ионы, обладающие противоположными способностями принимать или отдавать электроны.
5KCl+5O3+6P0 = 5KCl-1+3P2+5O5
В приведенной реакции хлор и фосфор изменяют свои степени окисления:
- P0-5e- → P+5, фосфор (P0) является восстановителем, окисляясь до P+5 (степень окисления фосфора повышается на 5 единиц от 0 до +5).
- Cl+5+6e- → Cl-1, хлор (Cl+5) является окислителем, восстанавливаясь до Cl-1 (степень окисления хлора понижается на 6 единиц – от +5 до -1).
В периодической таблице Менделеева четко прослеживается закономерность изменения окислительно-восстановительных свойств элементов:
- В периодах с увеличением порядкового номера элемента (слева-направо) нарастают окислительные свойства и убывают восстановительные – натрий самый сильный восстановитель в третьем периоде, а хлор – самый сильный окислитель.
- В главных подгруппах, в пределах одной главной подгруппы с повышением порядкового номера (по направлению сверху-вниз) нарастают восстановительные свойства элементов и убывают окислительные – в VIIа группе фтор является сильным окислителем, а астат в некоторых соединениях проявляет восстановительные свойства.
На рисунке ниже показана примерная принадлежность элементов к восстановителям (голубой цвет) и окислителям (красный цвет).

С окислительно-восстановительными свойствами элементов в периодической таблице в общем чертах понятно. Теперь скажем пару слов о ионах.
- Элементарные катионы металлов (Na+, Cu2+, Ca2+) являются окислителями и не проявляют восстановительных свойств, окислительные свойства снижаются по мере роста активности металла.
- Ионы металлов с промежуточными степенями окисления могут проявлять, как восстановительные, так и окислительные свойства (Fe2+ – восстановитель; Fe3+ – окислитель).
- Элементарные анионы (Cl-, Br-, I-) являются восстановителями.
- Сложные ионы являются окислителями, если содержат атомы элементов с высокой степенью окисления (Cr2O72-, ClO3-,NO3-), при этом окислительные свойства обусловлены всем анионом, но не конкретным атомом, имеющим высокую степень окисления.
А что же с окислительно-восстановительными свойствами сложных веществ?
При взаимодействии сложных веществ следует обращать внимание на те элементы, которые в ходе реакции меняют свою степень окисления (если таковых нет, то и реакция не является окислительно-восстановительной).
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в максимальной степени окисления – такое вещество может быть только окислителем, например перманганат калия, в котором марганец имеет максимальную степень окисления, т.е., может только принимать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в низшей степени окисления – такое вещество может быть только восстановителем, например, сульфат марганца (II), в котором марганец имеет низшую степень окисления, т.е., может только отдавать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в промежуточной степени окисления, – такое вещество может быть как окислителем, так и восстановителем – все зависит от других реагирующих веществ и условий протекания реакции.
Рассмотрим вкратце вещества, которые могут проявлять и восстановительные, и окислительные свойства, в зависимости от условий реакции и других взаимодействующих веществ.
Оксид серы (IV) в некоторых случаях играет роль восстановителя, например, окисляясь кислородом, но в металлургии оксид серы используют в реакции извлечения серы из отходящих газов, где оксид серы проявляет свойства окислителя:
2SO2+O2 = 2SO3
2CO+SO2 = S+2SO2
Пероксид водорода H2O2, как восстановитель применяется для дезинфекции, травления германиевых пластинок при изготовлении полупроводниковых приборов. Окислительные свойства пероксида водорода используют при отбеливании пуха, пера, мехов, тюли, волос.
Сернистая кислота в реакции с сероводородом играет роль окислителя, поскольку в молекуле H2S сера имеет степень окисления -2:
H2S+4O3+2H2S-2 = 3S0+3H2O
В реакции с кислородом сернистая кислота выступает восстановителем, поскольку кислород является более сильным окислителем:
2H2S+4O3+O20 = 2H2SO4
Не последнюю роль на окислительно-восстановительные свойства веществ оказывает среда, в которой протекает химическая реакция:
- I2+5H2O2 → 2HIO3+4H2O – при pH=1 пероксид водорода является окислителем;
- 2HIO3+5H2O2 → I2+6H2O+5O2 – при pH=2 пероксид водорода является восстановителем.
Оксид марганца (IV) является окислителем только в кислотной среде:
MnO2+4H++2e- → Mn2++2H2O
Перманганат калия KMnO4 является окислителем в любой среде:
- кислая среда: MnO4-+8H++5e- → Mn2++4H2O
- щелочная среда: MnO4-+1e- → MnO42-
- нейтральная среда: MnO4-+2H2O+3e- → MnO2+4OH-
См. далее:
- Типичные восстановители
- Типичные окислители
Окислители и восстановители любят “свою” среду – в кислотной среде сила окислителей увеличивается, а в щелочной – увеличивается сила восстановителей.
См. далее Элементы-восстановители
Источник
Все химические реакции можно разделить на два типа:
1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
Реакции второго типа называются окислительно-восстановительными.
Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg0 = Mg+2 + 2ē (или: Mg0 — 2ē = Mg+2) (4.1.4)
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
O2 + 4ē = 2O-2 (4.1.5)
В реакции 4.1.3 атомы хлора, которые в молекулах HCl имеют степень окисления —1 , отдают по одному электрону и превращаются в нейтральные атомы хлора, которые соединяются попарно и образуют молекулы хлора Сl2:
Cl-1 = Cl0 + 1ē; Cl0 + Cl0 = Cl2
или суммарно:
2Cl-1 = Cl2 + 2ē (4.1.6)
Атом марганца, который в исходном веществе (KМnО4) имеет степень окисления +7, присоединяет 5 электронов и превращается в атом марганца со степенью окисления +2 (такую степень окисления он имеет в молекуле продукта реакции MnCl2):
Mn+7 + 5ē = Mn+2 (4.1.7)
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электронов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса электронов. Таким образом, любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления алгебраическая величи на степени окисления элемента повышается.
В рассмотренных примерах процессы 4.1.4 и 4.1.6 являются процессами окисления.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления алгебраическая величина степени окисления понижается.
Процессы 4.1.5 и 4.1.7 являются примерами процессов восстановления.
Частицы (атомы, молекулы, ионы), которые отдают электроны, называются восстановителями.
В реакциях 4.1.2 и 4.1.3 восстановителями являются соответственно Mg и НCl.
Частицы, которые присоединяют электроны, называются окислителями.
В реакциях 4.1.2 и 4.1.3 окислителями являются соответственно O2 и KМnО4.
Следовательно, в общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
Восстановитель + Окислитель = Продукты реакции
Восстановитель участвует в процессе окисления, т. е. окисляется. А окислитель участвует в процессе восстановления, т. е. восстанавливается.
Важнейшие окислители и восстановители
Какие же вещества могут быть окислителями и какие восстановителями? Это зависит от величины степеней окисления элементов, которые входят в состав данных веществ. Как известно, некоторые элементы имеют постоянные степени окисления во всех или в большинстве сложных веществ. Для таких элементов изменение степеней окисления нехарактерно. Поэтому свойства веществ обычно не зависят от присутствия этих элементов. Элементы с переменной степенью окисления, как правило, легко ее изменяют, т. е. могут участвовать в процессах отдачи или присоединения электронов. Поэтому свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя.
Например, свойства перманганата калия KМnО4 определяются степенью окисления марганца (калий и кислород — элементы с постоянной степенью окисления). Марганец в KМnО4 имеет высшую степень окисления +7, поэтому KМnО4 может быть только окислителем.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя.
Например, свойства аммиака NH3 определяются степенью окисления азота (для водорода степень окисления +1 является практически постоянной). Азот в NH3 имеет низшую степень окисления —3, поэтому NH3 может быть только восстановителем.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. может участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем, и восстановителем. Это зависит от второго участника реакции.
Например, свойства сульфита натрия Na2SО3 определяются степенью окисления серы, которая имеет промежуточную степень окисления +4. Поэтому Na2SО3 проявляет окислительно-восстановительную двойственность. В реакции с перманганатом калия:
сульфит натрия окисляется до сульфата натрия, т. е. выступает в роли восстановителя. Это обусловлено тем, что KМnО4 может быть только окислителем (см. выше). А в реакции с сероводородом:
сульфит натрия восстанавливается до свободной серы, т. е. выступает в роли окислителя, так как H2S может быть только восстановителем (сера в H2S находится в низшей степени окисления).
Важнейшими окислителями являются:
а) простые вещества-неметаллы с наибольшими значениями электроотрицательности — фтор F2, кислород О2;
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия KМnО4, хроматы и дихроматы (например, дихромат калия K2СrО7), азотная кислота HNO3 и ее соли — нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) РbО2, хлорная кислота HClO4 и ее соли — перхлорат и др.
Важнейшими восстановителями являются:
а) все простые вещества-металлы. Наиболее активными восстановителями являются щелочные и щелочноземельные металлы, магний Mg, алюминий Аl, цинк Zn;
б) сложные вещества, молекулы которых содержат элементы в низшей степени окисления — метан силан SiH4, аммиак NH3, фосфин PН3, нитриды и фосфиды металлов (например, Na3N, Са3Р2), сероводород Н2S и сульфиды металлов, гaлогеноводороды HI, НВr НСl и галогениды металлов, гидриды металлов (например, NaH, СаН2) и др.
Среди веществ, содержащих элементы в промежуточных степенях окисления, есть вещества, для которых более характерными являются или окислительные, или восстановительные свойства. Обычно являются окислителями галогены Сl2 и Br2, хлорноватистая кислота НClО и ее соли — гипохлориты, хлораты (KСlO3 и др.), оксид марганца (IV) МnO2, соли трехвалентного железа (FeCl3 и др.). Как правило, в роли восстановителей выступают водород Н2, углерод С, оксид углерода (II) СО, сульфиты металлов (Na2SO3 и др.), соли двухвалентного железа (FeSO4 и др.).
Типы окислительно-восстановительных реакций
Различают 3 типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ. Примерами данного типа реакций являются
2) Внутримолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества. Например:
К этому типу ОВР относятся многие реакции термического разложения веществ.
З) Реакции самоокисления-самовосстановления, называемые также реакциями диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента. Например:

Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:![]()
а) Определим степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции:
в) Составим уравнения процессов окисления и восстановления:
Обратите внимание, что в левой части уравнения процесса окисления взято два атома брома, так как продуктом окисления является двухатомная молекула брома Br2.
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и присоединенных электронов будут равны. Так как наименьшим общим кратным чисел «5» и «2» является «10», то уравнение процесса восстановления нужно умножить на «2», а уравнение процесса окисления — на «5»:
Два атома Мn+7 присоединяют 10 электронов, а 10 атомов Br-1 отдают 10 электронов, т. е. выполняется основное правило метода электронного баланса.
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие в процессах окисления и восстановления:![]()
е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.![]()
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и в правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно (в составленном уравнении 40 атомов кислорода и в левой, и в правой частях).
Рассмотрим некоторые более сложные примеры составления уравнений ОВР.
Составим уравнение реакции, которая протекает по следующей схеме:![]()
Определим степени окисления всех элементов и подчеркнем символы элементов, которые изменяют свои степени окисления: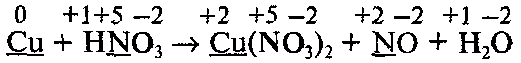
Составим уравнения процессов окисления и восстановления и найдем множители, на которые нужно умножить эти уравнения:

Обратите внимание, что не все атомы азота, которые входят в состав HNО3, изменяют свою степень окисления: часть атомов азота без изменения степени окисления переходит в молекулы Cu(NO3)2 Поэтому найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Сu и N, кроме формулы HNO3:![]()
Коэффициент перед формулой HNO3 равен общему числу атомов азота в правой части уравнения, т. е. равен 8 (из них 6 атомов, которые не изменяют степень окисления):![]()
В последнюю очередь уравниваем числа атомов водорода и кислорода:![]()
В некоторых ОВР более двух элементов изменяют свои степени окисления. В качестве примера рассмотрим следующую реакцию:
Два элемента — фосфор и сера — в ходе этой реакции окисляются, один элемент — азот — восстанавливается:

Общее число электронов, которые участвуют в процессах окисления, равно 22; в процессе восстановления участвует 1 электрон. Поэтому общий множитель для двух уравнений процессов окисления равен 1, а множитель для уравнения процесса восстановления равен 22. Запишем эти множители в качестве коэффициентов перед формулами соответствующих веществ:![]()
В заключение уравняем числа атомов водорода и кислорода:![]()
Источник
Задача 619.
На основе электронного строения атомов указать, могут ли быть окислителями: атомы натрия, катионы натрия, кислород в степени окисленности -2, йод в степени окисленности 0, фторид-ионы, катионы водорода, нитрит-ионы и, гидрид-ионы.
Решение:
Вещества, содержащие атомы элементов, которые уменьшают свою степень окисленности, называются окислителями.
Атомы натрия Na содержат по одному электрону на внешней электронной оболочке, поэтому они могут только отдавать электроны, т.е. натрий – восстановитель.
В катионе натрия атом натрия имеет степень окисленности +1, т.е. он может уменьшать свою степень окисленности, проявляя свойства окислителя.
Кислород в степени окисленности -2 может увеличивать свою степень окисленности, проявляя свойства восстановителя.
Иод в степени окисленности 0 может, как понижать, так и повышать свою степень окисленности, т.е. может быть окислителем.
Атом фтора в фторид-ионе имеет степень окисленности -1, поэтому может увеличивать свою степень окисленности, проявляя свойства окислителя.
Атомы водорода в катионах водорода находятся в степени окисленности +1, т.е. могут уменьшать свою степень окисленности, проявляя свойства окислителя.
В нитрит-ионе атомы азота находятся в своей промежуточной степени окисленности +4, поэтому могут как уменьшать, так и увеличивать степень окисленности, проявляя свойства и восстановителя, и окислителя.
Атомы водорода в гидрид-ионе находятся в своей наименьшей степени окисленности, значит, они могут увеличивать свою степень окисленности, проявляя свойства окислителя.
Задача 620.
Какие из перечисленных ионов могут служить восстановителями, а какие не могут и почему: Cu2+, Sn2+, Cl-, VO3-, S2-, ,Fe2+ WO42-, IO4-, Al3+, Hg2+, Hg22+?
Решение:
Окислители – частицы, которые способны понижать степень окисленности элемента.
В ионе Cu2+ атом меди находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, т.е. проявлять свойства окислителя.
В ионе Sn2+ атомы олова находятся в промежуточной степени окисленности, поэтому олово в данном ионе может, как понижать, так и повышать свою степень окисленности, проявляя свойства или окислителя, или восстановителя.
Хлор в ионе Cl- имеет самую низшую степень окисленности, поэтому может только повышать свою степень окисленности, проявляя свойства восстановителя.
Атом ванадия в ионе VO3- находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Сера в ионе S2+ находится в своей низшей степени окисленности, поэтому может только повышать свою степень окисленности, проявляя свойства восстановителя.
Атом железа в ионе Fe2+ находится в промежуточной степени окисленности, поэтому может, как повышать, так и понижать свою степень окисленности, т. е. проявлять свойства или окислителя, или восстановителя.
Атом вольфрама в ионе WO42- находится в своей высшей степени окисленности (+6), поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Иод в ионе IO3- находится в своей высшей степени окисленности (+7), поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Алюминий в ионе Al3+ находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Ртуть в ионе Hg2+ находится в своей высшей степени окисленности, поэтому может только понижать степень окисленности, проявляя свойства окислителя.
Ртуть в ионе Hg22+ находится в промежуточной степени окисленности (+1), поэтому может, как понижать, так и повышать свою степень окисленности, проявляя свойства или окислителя, или восстановителя.
Задача 621.
Какие из перечисленных веществ и за счет, каких элементов проявляют обычно окислительные свойства, и какие – восстановительные? Указать те из них, которые обладают окислительно-восстановительной двойственностью: H2S, SO2, CO, Zn, F2, NaNO2, KMnO4, HOCl, H3SbO3.
Решение:
а) В H2S сера находится в низшей степени окисления (-2), поэтому может только увеличивать свою степень окисления, проявляя свойства восстановителя.
б) В SO2 сера находится в промежуточной степени окисления (+4), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
в) В СО атом углерода находится в промежуточной степени окисления (+2), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
г) В Zn атом находится в своей низшей степени окисления (0), поэтому может только увеличивать свою степень окисления, проявляя свойства восстановителя.
д) В молекуле F2 атом фтора имеет степень окисления равную 0, а также, обладая самой высокой степенью окисления среди всех элементов, может только присоединять недостающий до полного завершения внешнего электронного слоя один электрон, проявляя свойства окислителя.
е) В NaNO2 атом азота находится в промежуточной степени окисления равной +4, поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
ж) В KMnO4 находится в высшей степени окисления (+7), поэтому может только уменьшать свою степень окисления, проявляя свойства окислителя.
з) В НOCl атом хлора находится в степени окисления равной +1, поэтому может как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
к) В H3SbO3 атом сурьмы находится в промежуточной степени окисления (+3), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
Источник
