Какие ионы содержатся в водных растворах следующих веществ
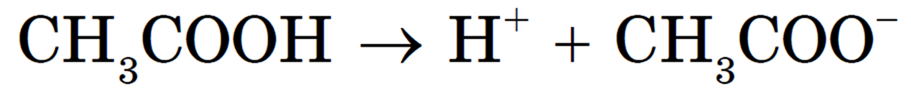
В уроке 9 «Ионы в водном растворе» из курса «Химия для чайников» рассмотрим растворение соли в воде, а также электролиз растворов и расплавов солей; познакомимся с законами Фарадея для электролиза и научимся находить продукты электролиза. Базой знаний для данного урока послужит материал из урока 8 «строение солей».
Растворение соли в воде
Из прошлого урока нам известно, что соли трудно расплавить и еще сложнее довести ее до кипения, однако, полярные жидкости, такие как вода, способны растворять соли без особых усилий, поскольку неполные положительные и отрицательные заряды на атомах полярных молекул воды в какой-то мере заменяют собой положительные и отрицательные ионы в кристаллической решетке соли. Другими словами, молекулы воды помогают разрушить кристалл соли.
Из рисунка видно, что происходит с положительными и отрицательными ионами при растворении в воде кристалла поваренной соли NaCl. Каждый ион Na+ окружается молекулами воды, которые обращены к нему отрицательно заряженными атомами кислорода. То же самое происходит с ионами Cl—, которые окружаются молекулами воды, обращенными к нему своими положительно заряженными атомами водорода. Ионы из кристалла соли оказываются гидратированными, а сам процесс присоединения молекул воды к ионам получил название — гидратация. Если в результате процесса гидратации устойчивость ионов, переходящих в раствор, становится больше их устойчивости в кристаллической решетке, то происходит растворение соли в воде. Хлорид натрия является отличным примером растворимой соли. И, наоборот, если энергия гидратации слишком мала, то кристалл является более устойчивой формой и не растворяется в воде. Примером таких нерастворимых солей является сульфат бария (BaSO4) и хлорид серебра (AgCl). Когда кристалл растворяется, он не просто распадается на ионы, а разъединяется на ионы молекулами жидкости, в которой происходит растворение. Неполярные жидкости (например, бензин С8H18) НЕ способны разъединять ионы в кристаллической решетке солей.
Электролиз растворов и расплавов солей
Металлы хорошо проводят ток — это знает каждый школьник. Электропроводность в металлах вызвана перемещением электронов в них, но ионы металла остаются неподвижными. Хотя кристаллы солей не проводят ток, зато растворы и расплавы солей это умеют и практикуют, так как анионы (отрицательные ионы) и катионы (положительные ионы) могут направленно перемещаться в противоположные направления, если приложить напряжение. Подвижность ионов соли оказывается еще большей, если она подверглась процессу гидратации.
Давным-давно английский ученый Майкл Фарадей расплавил соль (нагрев ее выше 801ºС), затем погрузил в расплав два электрода (катод и анод), а после взял и пропустил электрический ток через расплавленную соль. После этих манипуляций он обратил внимание что на электродах начали протекать химические реакции: ионы натрия начали мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия
- Na+ + e— (с катода) → Na
Хлорид-ионы мигрируют в другом направлении-в сторону анода, отдают ему свои избыточные электроны и окисляются до газообразного хлора
- Cl— → ½Cl2 + e—
Все это можно изобразить с помощью полной реакции, которая представляет собой разделение NaCl на составляющие его элементы:
- Na+ + Cl— → Na + ½Cl2
Весь процесс получил название электролиз, что означает «разрыв на части при помощи электричества». Для электролиза не обязательно расплавлять соль, можно также использовать обычный водный раствор соли, ведь подвижность ионов оказывается еще большей, если соль подверглась процессу гидратации. Но тогда полная реакция будет выглядеть иначе, и на катоде будет выделяться не металлический натрий, а газообразный водород:
- Na+ + Cl— + H2O → Na+ + ½Cl2 + ½H2 + OH—
Надеюсь, что вам стало интересно, почему продуктом электролиза водного раствора является не Na (как это было в расплавленной соли), а ½H2. Объясняется просто: часть молекул H2O диссоциируют на ионы H+ и OH—. Поскольку ион H+ обладает большим сродством к электрону (то есть сильнее его притягивает), нежели ион Na+, то ионы H+ первыми достигают катода, где незамедлительно восстанавливают недостающий электрон и превращаются из иона в полноценный газ H2, а ионы Na+ так и остаются в растворе.
Вот вам плюшка с продуктами электролиза водного раствора солей, может пригодится — может нет, но лучше законспектируйте:
А Фарадей тем временем не сидел без дела, а наблюдал, проводил опыты, использовал другие электролиты, увеличивал-уменьшал заряд и опять наблюдал. В конце концов он заметил взаимосвязь между количеством подаваемого электричества и количеством получаемых веществ. Установленные им закономерности называются законы Фарадея для электролиза. Сформулируем их:
- Пропускание одного и того же электрического заряда через электролитическую ячейку всегда приводит к количественно одинаковому химическому превращению в данной реакции. Масса элемента, выделяемого на электроде, пропорциональна количеству заряда, пропущенному через электролитическую ячейку.
- Для выделения на электроде 1 моля вещества, которое в процессе электрохимической реакции приобретает или теряет 1 электрон, необходимо пропустить через ячейку 96485 кулонов (Кл) электричества. Если в реакции принимает участие N электронов, для выделения моля продукта необходимо N·96485 Кл электричества.
Количество электричества, равное 96485 Кл, получило название 1 фарадей и обозначается символом F. Законы Фарадея становятся очевидными, если принять во внимание, что 1 F — это просто заряд 1 моля электронов, т.е. 6,022 1023 электронов. Множитель 6,022-1023, позволяющий переходить от индивидуальных молекул к молям вещества, одновременно позволяет перейти и от 1 электронного заряда к 1 F электрического заряда. Разумеется, в свое время Фарадей ничего не знал ни о числе Авогадро, ни о заряде электрона. Однако из проведенных экспериментов он смог сделать вывод, что заряды на ионах кратны некоторой элементарной единице заряда, так что 96485 Кл электричества соответствуют 1 молю таких единиц. Термин электрон впервые появился в 1881 г.; его ввел английский физик Дж.Стоней для обозначения элементарной единицы ионного заряда. Применять термин «электрон» к реальной отрицательно заряженной частице начали спустя еще 10 лет.
1 пример. Запишите уравнения реакций, протекающих при пропускании электрического тока через расплавленную соль NaCl. Сколько граммов натрия и хлора выделится при пропускании 1 F электричества через электролитическую ячейку?
Решение: Уравнение реакции, протекающей на катоде: Na+ + е— → Na, а уравнение 1 анодной реакции: Сl— → Cl2 + е—. Когда через расплавленную соль NaCl проходит 1 моль электронов (1 F), каждый электрон восстанавливает 1 ион натрия, в результате чего образуется 1 моль атомов натрия. Следовательно, на катоде выделяется 22,990 г Na. На аноде происходит удаление 1 моля электронов от 1 моля хлорид-ионов, после чего остается 1 моль атомов хлора, которые попарно соединяются, образуя 1/2 моля молекул Сl2. Следовательно, масса газообразного хлора, выделяющегося на аноде, должна быть равна 35,453 г (что равно атомной массе Сl, или половине молекулярной массы Сl).
Пример 2. Сколько граммов металлического магния и газообразного хлора выделяется при пропускании 1 F электричества через электролитическую ячейку с расплавленным хлоридом магния, MgCl2?
Решение: На катоде происходит реакция Mg2+ + 2е— → Mg, а на аноде — реакция 2Сl— → Сl2 + 2е—. Поскольку для восстановления каждого иона Mg2+ необходимо 2 электрона, 1 моля электронов хватит только для восстановления половины моля ионов магния, таким образом на катоде должно выделиться 12,153 г магния. (Атомная масса магния равна 24,305 г/моль.) Как и в примере 1, на аноде окислится 1 моль ионов Сl— и выделится половина моля, т.е. 35,453 г, газообразного Сl2.
Пример 3. Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы Аl3 +. Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг металла.
Решение: 1 кг алюминия содержит 1000 г / 26,98 г·моль-1 = 37,06 моля атомов. Поскольку на выделение каждого атома алюминия необходимо 3 электрона, на 37,06 моля атомов потребуется 3·37,06 = 111,2 моля электронов. Это количество электричества эквивалентно 111,2F, или 10 730 000 Кл.
Надеюсь урок 9 «Ионы в водном растворе» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к уроку 10 «Ионы в газе».
Источник
Оглавление
- Электролиты и неэлектролиты
- Электролитические диссоциация и ассоциация
- Степень электролитической диссоциации
- Сильные и слабые электролиты
- Константа диссоциации
- Основные положения теории электролитической диссоциации
- Реакции ионного обмена
- Шпаргалка
- Задания для самопроверки
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами. Например растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый С. Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяков- ский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т. е. «одетые в шубку» из молекул воды.
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
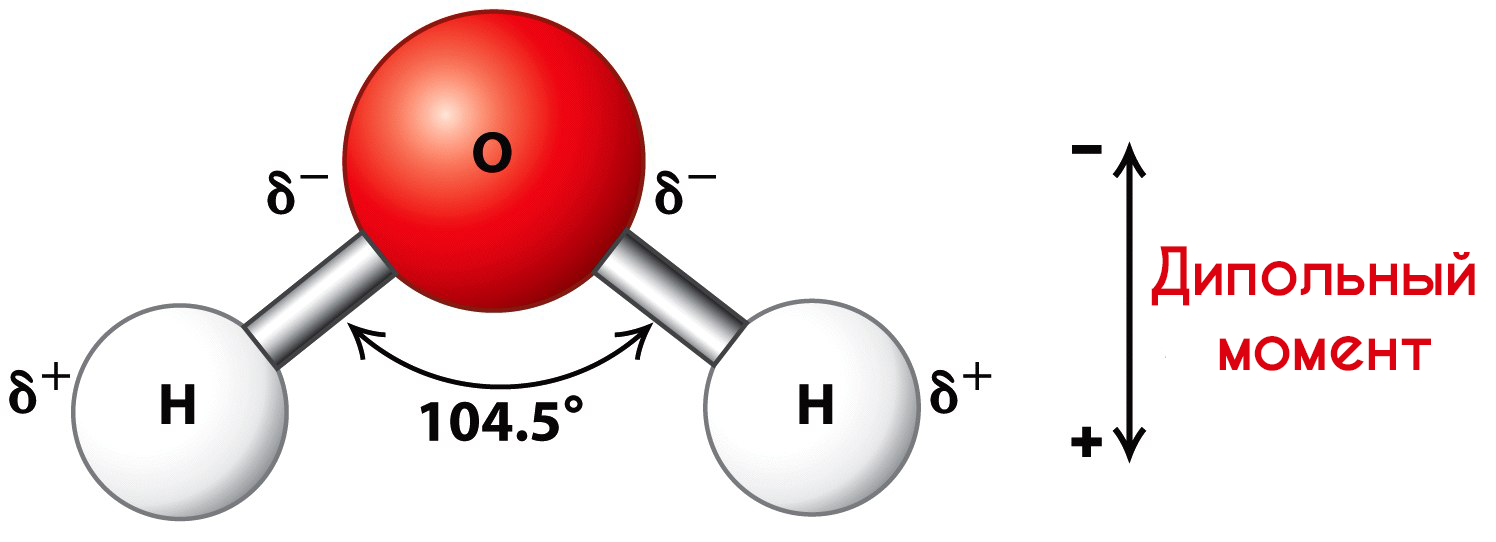
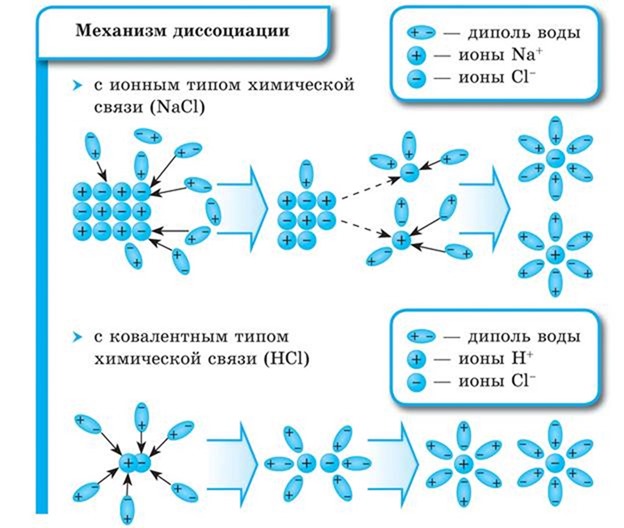
Как правило, легче всего диссоциируют вещества с ионной связью и, соответственно, с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
1) ориентация молекул (диполей) воды около ионов кристалла;
2) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с помощью следующего уравнения:
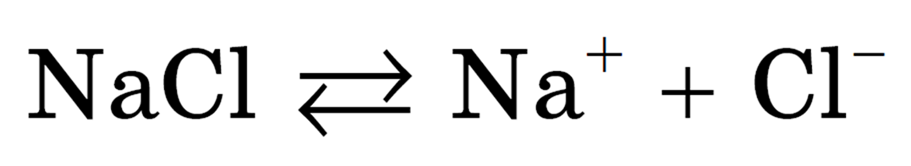
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная связь (например, молекулы хлороводорода HCl, смотри ниже); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную; последовательность процессов, происходящих при этом, будет такой:
1) ориентация молекул воды вокруг полюсов молекул электролита;
2) гидратация (взаимодействие) молекул воды с молекулами электролита;
3) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
4) диссоциация (распад) молекул электролита на гидратированные ионы.
Схема электролитической диссоциации хлорида натрия на гидратированные ионы
Упрощенно процесс диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
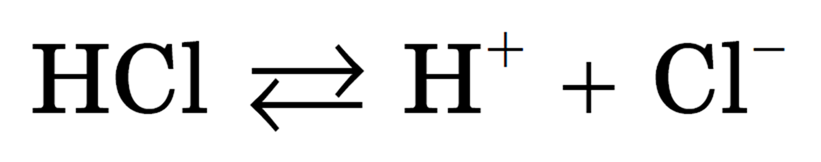
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Ассоциация в растворах происходит параллельно с диссоциацией, поэтому в уравнениях реакций ставят знак обратимости.
Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди Cu2+ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Cu2+ • nH2O. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой а («альфа»).
Степень диссоциации — это отношение числа частиц, распавшихся на ионы (Ng), к общему числу растворенных частиц (Np).
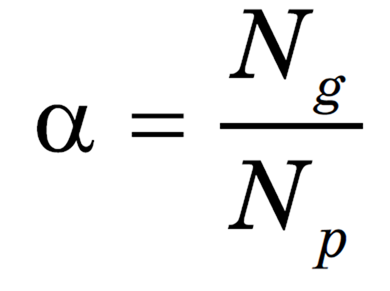
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если а = 0, то диссоциация отсутствует, а если а = 1, или 100 %, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
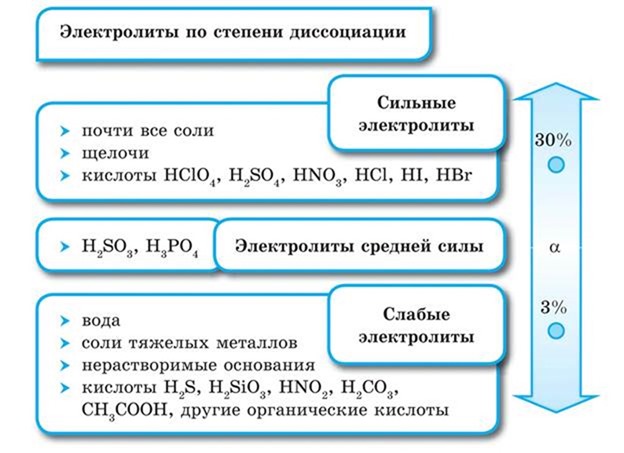
По степени электролитической диссоциации электролиты делятся на сильные и слабые.


Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: H2SO4, HCl, HNO3;
3) все щелочи, например: NaOH, KOH.
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты — H2S, H2CO3, HNO2;
2) водный раствор аммиака NH3 • H2O;
3) вода;
4) некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
![]()
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
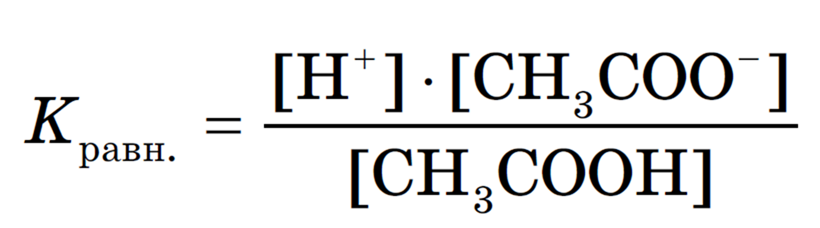
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
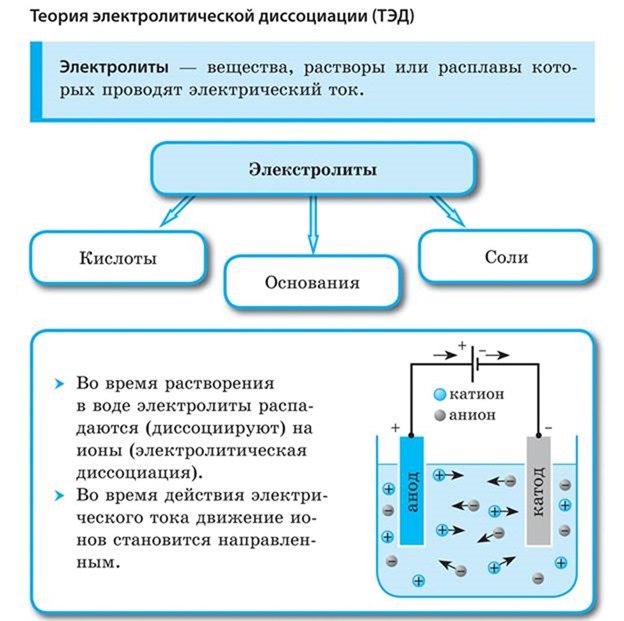
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это одна из форм существования химического элемента. Например, атомы металла натрия Na0 энергично взаимодействуют с водой, образуя при этом щелочь (NaOH) и водород Н2, в то время как ионы натрия Na+ таких продуктов не образуют. Хлор Cl2 имеет желтозеленый цвет и резкий запах, ядовит, а ионы хлора Cl— бесцветны, не ядовиты, лишены запаха.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
По составу ионы делятся на простые — Cl—, Na+ и сложные — NH4+, SO2—.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы. Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в раствоpax и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда.
Сумма зарядов катионов (Н+, Na+, NH4+, Cu2+) равна сумме зарядов анионов (Cl—, OH—, SO42-), вследствие чего растворы электролитов (HCl, (NH4)2SO4, NaOH, CuSO4) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
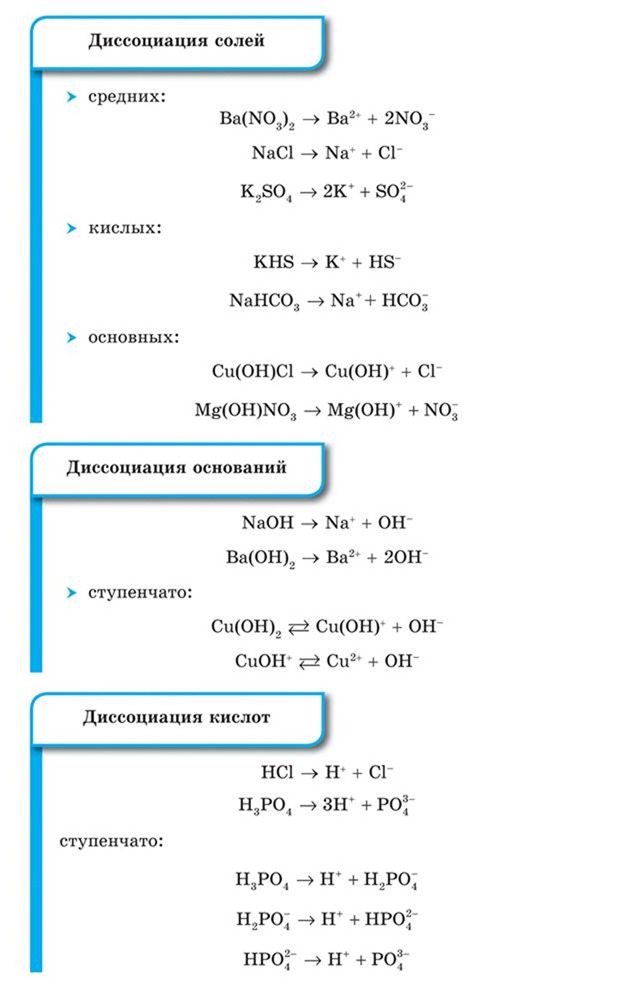
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
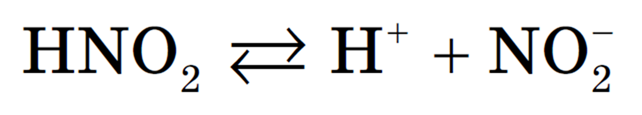
5. Не все электролиты в одинаковой мере диссоциируют на ионы.
Степень диссоциации зависит от природы электролита и его концентрации. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул CH3COOH, кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов H+.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
Например, общие свойства кислот, такие как кислый вкус, изменение окраски индикаторов и др., обусловлены наличием в их растворах катионов водорода (точнее, ионов оксония H3O+). Общие свойства щелочей, такие как мылкость на ощупь, изменение окраски индикаторов и др. связаны с присутствием в их растворах гидроксид-ионов OH—, а свойства солей — с распадом их в растворе на катионы металла (или аммония) и анионы кислотных остатков.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Этим обусловлена высокая скорость многих химических реакций в растворах электролитов.
Реакции, протекающие между ионами, называют ионными реакциями, а уравнения этих реакций — ионными уравнениями.

Реакции ионного обмена в водных растворах могут протекать:
1. Необратимо, до конца.
2. Обратимо, то есть протекать одновременно в двух противоположных направлениях. Реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
а) нерастворимые;
б) малодиссоциирующие (слабые электролиты);
в) газообразные.
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:
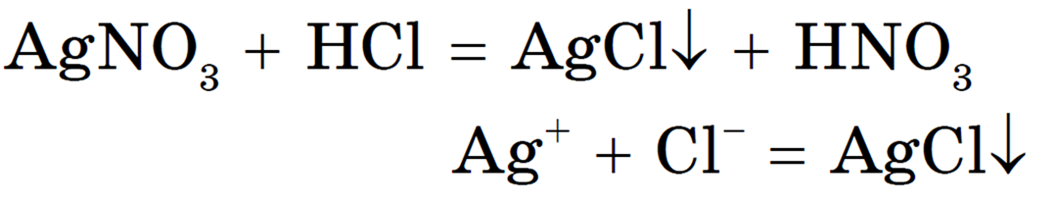
Реакция необратима, т. к. один из ее продуктов — нерастворимое вещество.
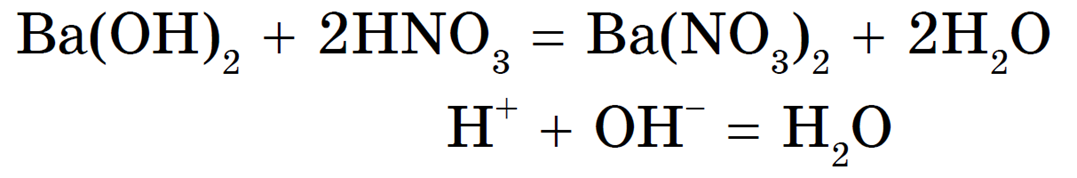
Реакция нейтрализации необратима, т. к. образуется малодиссоциирующее вещество — вода.
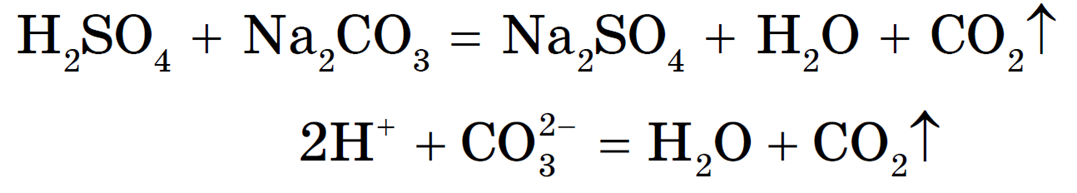
Реакция необратима, т. к. образуется газ CO2 и малодиссоциирующее вещество — вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают.
В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Например:
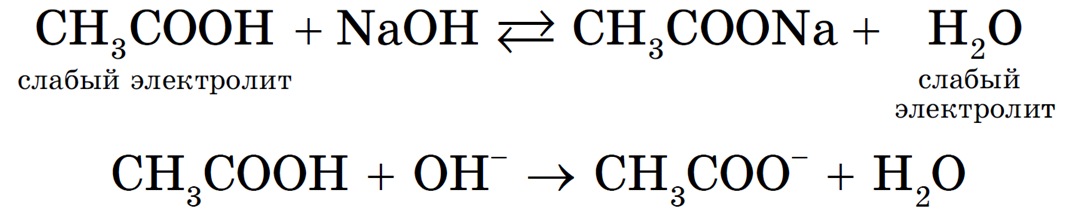
Равновесие смещается в сторону образования более слабого электролита — H2O. Однако до конца такая реакция протекать не будет: в растворе остаются недиссоциированные молекулы уксусной кислоты и гидроксид-ионы.
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.
Шпаргалка
Справочный материал для прохождения тестирования:

Таблица Менделеева

Таблица растворимости
Источник
