Какие ионы содержатся в водных растворах гидроксида бария

Гидроксид бария, характеристика, свойства и получение, химические реакции.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Гидроксид бария – неорганическое вещество, имеет химическую формулу Ba(OH)2.
Краткая характеристика гидроксида бария
Физические свойства гидроксида бария
Получение гидроксида бария
Химические свойства гидроксида бария
Химические реакции гидроксида бария
Применение и использование гидроксида бария
Краткая характеристика гидроксида бария:
Гидроксид бария – неорганическое вещество белого цвета.
Химическая формула гидроксида бария Ba(OH)2.
Обладает гигроскопичностью, но меньшей чем у гидроксида натрия.
Хорошо растворяется в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. В результате растворения в воде образуется сильнощелочной раствор. Насыщенный водный раствор гидроксида бария называется баритовой водой.
Растворим в этаноле. Не растворим в жидком аммиаке, диэтиловом эфире. Мало растворим в ацетоне.
Гидроксид бария – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Не горит, не взрывается.
Физические свойства гидроксида бария:
| Наименование параметра: | Значение: |
| Химическая формула | Ba(OH)2 |
| Синонимы и названия иностранном языке | barium hydroxide (англ.) бария гидроокись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные моноклинные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 4500 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 4,5 |
| Температура плавления, °C | 480 |
| Температура кипения, °C | 780 |
| Температура разложения, °C | 1000 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 171,35474 |
* Примечание:
— нет данных.
Получение гидроксида бария:
В лаборатории гидроксид бария получается в результате следующих химических реакций:
- 1. в результате взаимодействия металлического бария с водой:
Ba + 2H2O → Ba(OH)2 + H2.
- 2. в результате взаимодействия оксида бария и воды:
BaO + H2O → Ba(OH)2.
- 3. в результате взаимодействия сульфида бария с горячей водой:
BaS + 2H2O → Ba(OH)2+ H2S.
Химические свойства гидроксида бария. Химические реакции гидроксида бария:
Гидроксид бария – химически активное вещество, химическое основание.
Водные растворы Ba(OH)2 имеют щелочную реакцию.
Химические свойства гидроксида бария аналогичны свойствам гидроксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида бария с хлором:
6Ba(OH)2 + 6Cl2 5BaCl2 + Ba(ClO3)2 + 6H2O (to).
В результате реакции образуются хлорид бария, хлорат бария и вода.
2. реакция гидроксида бария с ортофосфорной кислотой:
Ba(OH)2 + H3PO4 → BaHPO4 + 2H2O,
3Ba(OH)2 + 2H3PO4 → Ba3(PO4)2 + 6H2O.
В первом случае в результате реакции образуются гидроортофосфат бария и вода. При этом в качестве исходных веществ ортофосфорная кислота используется в виде концентрированного раствора.
Во втором случае в результате реакции образуются ортофосфат бария и вода. При этом в качестве исходных веществ ортофосфорная кислота используется в виде разбавленного раствора.
3. реакция гидроксида бария с азотной кислотой:
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O.
В результате реакции образуются нитрат бария и вода.
Аналогично проходят реакции гидроксида бария и с другими кислотами.
4. реакция гидроксида бария с сероводородом:
Ba(OH)2 + H2S → BaS + 2H2O,
Ba(OH)2 + 2H2S → Ba(HS)2 + 2H2O.
В первом случае в результате реакции образуются сульфид бария и вода. При этом сероводород в качестве исходного вещества используется в виде разбавленного раствора.
Во втором случае в результате реакции образуются гидросульфид бария и вода. При этом сероводород в качестве исходного вещества используется в виде насыщенного раствора.
5. реакция гидроксида бария с фтороводородом:
Ba(OH)2 + 2HF → BaF2 + 2H2O.
В результате реакции образуются фторид бария и вода. При этом фтороводород в качестве исходного вещества используется в виде насыщенного раствора.
6. реакция гидроксида бария с оксидом углерода (углекислым газом):
Ba(OH)2 + CO2 → BaCO3 + H2O,
Ba(OH)2 + 2CO2 → Ba(HCO3)2.
Оксид углерода является кислотным оксидом. В результате реакции образуются в первом случае – карбонат бария и вода, во втором случае – гидрокарбонат бария и вода.
7. реакция гидроксида бария с оксидом серы:
Ba(OH)2 + SO2 → BaSO3 + H2O,
Ba(OH)2 + 2SO2 → Ba(HSO3)2.
Оксид серы является кислотным оксидом. В результате реакции образуются в первом случае – сульфит бария и вода, во втором случае – гидросульфит бария.
8. реакция гидроксида бария с хроматом калия:
Ba(OH)2 + K2CrO4 → BaCrO4 + 2KOH.
В результате реакции образуются хромат бария и гидроксид калия.
9. реакция гидроксида бария с дитионатом марганца:
Ba(OH)2 + MnS2O6 → BaS2O6 + Mn(OH)2 (t = 40-70 oC).
В результате реакции образуются дитионат бария и гидроксид марганца.
10. реакция гидроксида бария с хлоратом аммония:
Ba(OH)2 + 2NH4ClO3 → Ba(ClO3)2 + 2NH3 + 2H2O (to).
В результате реакции образуются хлорат бария, аммиак и вода. При этом гидроксид бария в качестве исходного вещества используется в виде насыщенного раствора, а хлорат аммония – в виде концентрированного раствора. Реакция протекает при кипении.
11. реакция гидроксида бария с сульфатом натрия:
Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH.
В результате реакции образуются сульфат бария и гидроксид натрия.
12. реакция гидроксида бария с сульфатом калия:
K2SO4 + Ba(OH)2 → BaSO4 + 2KOH.
В результате реакции образуются сульфат бария и гидроксид калия.
13. реакция гидроксида бария с карбонатом натрия:
Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH.
В результате реакции образуются карбонат бария и гидроксид натрия. При этом гидроксид бария в качестве исходного вещества используется в виде насыщенного раствора.
Аналогично проходят реакции гидроксида бария и с другими солями.
14. реакция разложения гидроксида бария:
Ba(OH)2 → BaO + H2O (t = 780-800 oC).
В результате реакции образуются оксид бария и вода.
Применение и использование гидроксида бария:
Гидроксид бария используется:
– в виде баритовой воды как реактив на SO42− и CO32− (сульфат- и карбонат-ионы);
– для очистки растительных масел и животных жиров;
– как компонент смазок;
– для получения солей бария, а также гидроксидов рубидия и цезия из их сульфатов и карбонатов;
– для удаления SO42− (сульфат-ионов) из промышленных растворов.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
гидроксид бария реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида бария
реакции с оксидом натрия
Коэффициент востребованности
5 346
Источник
Гидроксид бария – неорганическое вещество, имеет химическую формулу Ba(OH)2.
Краткая характеристика гидроксида бария:
Гидроксид бария – неорганическое вещество белого цвета.
Химическая формула гидроксида бария Ba(OH)2.
Обладает гигроскопичностью, но меньшей чем у гидроксида натрия.
Хорошо растворяется в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. В результате растворения в воде образуется сильнощелочной раствор. Насыщенный водный раствор гидроксида бария называется баритовой водой.
Растворим в этаноле. Не растворим в жидком аммиаке, диэтиловом эфире. Мало растворим в ацетоне.
Гидроксид бария – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Не горит, не взрывается.
Физические свойства гидроксида бария:
| Наименование параметра: | Значение: |
| Химическая формула | Ba(OH)2 |
| Синонимы и названия иностранном языке | barium hydroxide (англ.) бария гидроокись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные моноклинные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 4500 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 4,5 |
| Температура плавления, °C | 480 |
| Температура кипения, °C | 780 |
| Температура разложения, °C | 1000 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 171,35474 |
* Примечание:
— нет данных.
Получение гидроксида бария:
В лаборатории гидроксид бария получается в результате следующих химических реакций:
- в результате взаимодействия металлического бария с водой:
Ba + 2H2O → Ba(OH)2 + H2.
в результате взаимодействия оксида бария и воды:
BaO + H2O → Ba(OH)2. - в результате взаимодействия сульфида бария с горячей водой:
BaS + 2H2O → Ba(OH)2+ H2S.
Химические свойства гидроксида бария. Химические реакции гидроксида бария:
Гидроксид бария – химически активное вещество, химическое основание.
Водные растворы Ba(OH)2 имеют щелочную реакцию.
Химические свойства гидроксида бария аналогичны свойствам гидроксидов других металлов. Поэтому для него характерны следующие химические реакции:
- реакция гидроксида бария с хлором:
6Ba(OH)2 + 6Cl2 5BaCl2 + Ba(ClO3)2 + 6H2O (to).
В результате реакции образуются хлорид бария, хлорат бария и вода. - реакция гидроксида бария с ортофосфорной кислотой:
Ba(OH)2 + H3PO4 → BaHPO4 + 2H2O,
3Ba(OH)2 + 2H3PO4 → Ba3(PO4)2 + 6H2O.В первом случае в результате реакции образуются гидроортофосфат бария и вода. При этом в качестве исходных веществ ортофосфорная кислота используется в виде концентрированного раствора.Во втором случае в результате реакции образуются ортофосфат бария и вода. При этом в качестве исходных веществ ортофосфорная кислота используется в виде разбавленного раствора.
- реакция гидроксида бария с азотной кислотой:
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O.
В результате реакции образуются нитрат бария и вода.
Аналогично проходят реакции гидроксида бария и с другими кислотами. - реакция гидроксида бария с сероводородом:
Ba(OH)2 + H2S → BaS + 2H2O,
Ba(OH)2 + 2H2S → Ba(HS)2 + 2H2O.В первом случае в результате реакции образуются сульфид бария и вода. При этом сероводород в качестве исходного вещества используется в виде разбавленного раствора.Во втором случае в результате реакции образуются гидросульфид бария и вода. При этом сероводород в качестве исходного вещества используется в виде насыщенного раствора.
- реакция гидроксида бария с фтороводородом:
Ba(OH)2 + 2HF → BaF2 + 2H2O.В результате реакции образуются фторид бария и вода. При этом фтороводород в качестве исходного вещества используется в виде насыщенного раствора. - реакция гидроксида бария с оксидом углерода (углекислым газом):
Ba(OH)2 + CO2 → BaCO3 + H2O,
Ba(OH)2 + 2CO2 → Ba(HCO3)2.Оксид углерода является кислотным оксидом. В результате реакции образуются в первом случае – карбонат бария и вода, во втором случае – гидрокарбонат бария и вода. - реакция гидроксида бария с оксидом серы:
Ba(OH)2 + SO2 → BaSO3 + H2O,
Ba(OH)2 + 2SO2 → Ba(HSO3)2.Оксид серы является кислотным оксидом. В результате реакции образуются в первом случае – сульфит бария и вода, во втором случае – гидросульфит бария. - реакция гидроксида бария с хроматом калия:
Ba(OH)2 + K2CrO4 → BaCrO4 + 2KOH.В результате реакции образуются хромат бария и гидроксид калия. - реакция гидроксида бария с дитионатом марганца:
Ba(OH)2 + MnS2O6 → BaS2O6 + Mn(OH)2 (t = 40-70 oC).В результате реакции образуются дитионат бария и гидроксид марганца. - реакция гидроксида бария с хлоратом аммония:
Ba(OH)2 + 2NH4ClO3 → Ba(ClO3)2 + 2NH3 + 2H2O (to).В результате реакции образуются хлорат бария, аммиак и вода. При этом гидроксид бария в качестве исходного вещества используется в виде насыщенного раствора, а хлорат аммония – в виде концентрированного раствора. Реакция протекает при кипении. - реакция гидроксида бария с сульфатом натрия:
Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH.В результате реакции образуются сульфат бария и гидроксид натрия. - реакция гидроксида бария с сульфатом калия:
K2SO4 + Ba(OH)2 → BaSO4 + 2KOH.В результате реакции образуются сульфат бария и гидроксид калия. - реакция гидроксида бария с карбонатом натрия:
Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH.В результате реакции образуются карбонат бария и гидроксид натрия. При этом гидроксид бария в качестве исходного вещества используется в виде насыщенного раствора.Аналогично проходят реакции гидроксида бария и с другими солями.
- реакция разложения гидроксида бария:
Ba(OH)2 → BaO + H2O (t = 780-800 oC).В результате реакции образуются оксид бария и вода.
Применение и использование гидроксида бария:
Гидроксид бария используется:
- в виде баритовой воды как реактив на SO42− и CO32− (сульфат- и карбонат-ионы);
- для очистки растительных масел и животных жиров;
- как компонент смазок;
- для получения солей бария, а также гидроксидов рубидия и цезия из их сульфатов и карбонатов;
- для удаления SO42− (сульфат-ионов) из промышленных растворов.
Ссылка на источник
Источник
Глава 4. Обобщение знаний по химии за курс основной школы. Подготовка к ГИА
Электролитическая диссоциация — распад электролита в растворе (расплаве) на ионы:
Примеры тестовых заданий и рекомендации к их выполнению
1. При испытании веществ на электрическую проводимость лампочка загорится, если погрузить электроды в
1) водный раствор глюкозы
2) водный раствор гидроксида калия
3) спирт
4) ацетон
Анализ списка предложенных веществ позволяет выделить среди них единственное неорганическое соединение — щёлочь, что и обусловит выбор верного ответа. Ответ: 2.
2. Наиболее сильным электролитом является
1) раствор фтороводорода 3) сернистая кислота
2) раствор хлороводорода 4) фосфорная кислота
Знание относительно силы бескислородных и кислородсодержащих кислот позволит найти правильный ответ. Ответ. 2.
3. К слабым электролитам относится каждое из двух веществ
1) хлороводород и гидроксид лития
2) сероводородная кислота и гидрат аммиака
3) азотистая кислота и гидроксид калия
4) хлорная кислота и гидроксид бария
Знание представителей группы слабых электролитов (или сильных электролитов) позволяет выбрать среди предложенных вариантов ответы 2 и 3 (пары предложенных в них веществ начинаются слабыми кислотами). Однако ответ 3 не подходит под условие задания, так как второе вещество предложенной пары является щёлочью. Ответ: 2.
4. В водном растворе ортофосфорной кислоты максимальной является концентрация
1) фосфат-ионов 3) гидрофосфат-ионов
2) дигидрофосфат-ионов 4) катионов водорода
На первый взгляд наиболее верным является ответ 2, так как трёхосновная фосфорная кислота диссоциирует преимущественно по первой из трёх возможных ступеней (число катионов водорода в этом случае также будет равно числу дигидрофосфат- ионов, и в этом случае ответ 4 также следует рассматривать как верный). Однако это не так. В результате диссоциации фосфорной кислоты по каждой из трёх ступеней образуются катионы водорода. Их суммарное число и будет максимальным среди всех ионов. Ответ: 4.
5. В качестве катионов только катионы водорода образуются при диссоциации вещества, формула которого
1) CHgCOONa 2) НСlO4 3) NH4Cl 4) NaHSO4
Следует учесть, что кислые соли сильных кислот (ответ 4) диссоциируют с образованием катионов металла, катионов водорода и анионов кислотного остатка. Ответ: 2.
6. Наибольшее (суммарное) число ионов образуется при диссоциации 1 моль
1) нитрата железа (III) 3) сульфата железа (III)
2) гидрокарбоната натрия 4) гидроксонитрата бария
Для решения этого задания следует записать формулы предложенных солей. Наибольшее число ионов входит в состав сульфата железа (III). Ответ: 3.
7. Сокращённому ионному уравнению реакции
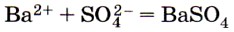
соответствует взаимодействие
1) оксида бария и серной кислоты
2) бария и серной кислоты
3) карбоната бария и серной кислоты
4) нитрата бария и серной кислоты
Все четыре варианта в качестве источника сульфат-иона предлагают серную кислоту, что отвечает сокращённому ионному уравнению реакции. Следовательно, необходимо анализировать первые вещества каждого из ответов. Катионы бария содержат его соли (ответы 3 и 4), однако ионы в растворе образуются при диссоциации растворимых солей. Ответ: 4.
8. Сокращённому ионному уравнению
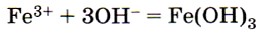
соответствует взаимодействие между
1) гидроксидом железа (III) и соляной кислотой
2) оксидом железа (III) и гидроксидом натрия
3) сульфатом железа (III) и гидроксидом бария
4) хлоридом железа (III) и гидроксидом калия
Ионы Fe3+ образуют растворимые соли железа (III). Поле для выбора сужено до ответов 3 и 4. Оба взаимодействия возможны для указанных в условии задания ионов. Однако при взаимодействии сульфата железа (III) и гидроксида бария образуется не только осадок Fe(OH)3, но и осадок BaSO4, т. е. ионное уравнение не будет отвечать заданному. Ответ: 4.
9. Сокращённому ионному уравнению
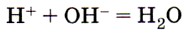
соответствует взаимодействие между
1) гидроксидом цинка и соляной кислотой
2) кремниевой кислотой и гидроксидом калия
3) гидроксидом меди (II) и азотной кислотой
4) гидроксидом натрия и серной кислотой
Приведённое в условии задания сокращённое ионное уравнение соответствует взаимодействию между сильной кислотой и щёлочью с образованием растворимой соли. Ответ: 4.
10. Сокращённому ионному уравнению
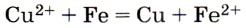
соответствует взаимодействие между
1) медью и раствором сульфата железа (II)
2) гидроксидом меди (II) и железом
3) раствором сульфата меди (II) и железом
4) раствором нитрата меди (II) и оксидом железа (II)
Для нахождения верного ответа следует в качестве отправной точки использовать одну из исходных частиц в левой части ионного уравнения — Cu2+ или Fe. Если выбирается ион Си2+, то поле для выбора верного ответа сужается до 3 и 4. Анализ второй части предложенных пар позволяет выбрать верный ответ 3. Если же выбирается Fe, то поле выбора для верного ответа сужается до 2 и 3. Анализ второй части предложенных пар позволяет выбрать тот же верный ответ, так как предложенный в ответе 2 гидроксид меди (II) нерастворим. Ответ: 3.

1. К сильным электролитам относится кислота
1) угольная 2) серная 3) сернистая 4) фосфорная
2. Только сильные электролиты перечислены в ряду
1) гидроксид натрия, азотная кислота, хлорид магния
2) оксид серы (IV), серная кислота, сульфат аммония
3) гидроксид калия, азотистая кислота, нитрат алюминия
4) гидрат аммиака, соляная кислота, иодид калия
3. Наибольшее количество хлорид-ионов образуется при диссоциации 1 моль
1) соляной кислоты 3) хлорида цинка
2) хлорида калия 4) хлорида алюминия
4. Сокращённому ионному уравнению
Cu2+ + 2OН- = Си(ОН)2
соответствует взаимодействие
1) нитрата меди (II) с гидроксидом магния
2) оксида меди (II) с гидроксидом калия
3) хлорида меди (II) с гидроксидом натрия
4) гидроксокарбоната меди (II) с гидроксидом натрия
5. В качестве катионов только катионы водорода образуются при диссоциации вещества, формула которого
1)NH4NO3 2) CHgCOOH 3)KHSO4 4) NH4H2PO4
6. Наибольшее число ионов в растворе образуется при диссоциации 1 моль
1) хлорида железа (III) 3) нитрата цинка
2) сульфата алюминия 4) хлорида аммония
7. Взаимодействию гидроксида железа (III) с соляной кислотой соответствует ионная реакция
1) Fe(OH)3 + ЗН+ = Fe3+ + 3H2O
2) Fe2O3 + 6Н+ = 2Fe3+ + 3H2O
3) 2Fe + 6Н+ = 2Fe3+ + ЗН2
4) Fe3+ + ЗОН- = Fe(OH)3
8. Ионному уравнению
Са2+ + 2OН- + СO2 = СаСO3 + Н2O
соответствует взаимодействие
1) раствора гидроксида кальция с угарным газом
2) оксида кальция с углекислым газом
3) кальция с углекислым газом
4) раствора гидроксида кальция с углекислым газом
9. Осадок образуется при сливании водных растворов
1) гидроксида натрия и хлорида лития
2) сульфата меди (II) и азотной кислоты
3) хлорида железа (III) и нитрат цинка
4) сульфата никеля и нитрата калия
10. Выделение газа происходит при взаимодействии веществ, формулы которых
1) ВаСO3 и НСl 3) СиО и H2SO4
2) Са(ОН)2 и Na2CO3 4) Аl(ОН)3 и КОН
Диссоциация электролитов в водных растворах. Ионные уравнения реакций. Ответы

Источник
