Какие ионы придают раствору щелочные свойства

Кислоты и щелочи – два крайних положения одной шкалы: их свойства (совершенно противоположные) обусловливает одна и та же величина – концентрация ионов водорода (H+). Однако само по себе это число очень неудобное: даже в кислых средах, где концентрация ионов водорода выше, это число составляет сотые, тысячные доли единицы. Поэтому для удобства пользуются десятичным логарифмом этого значения, умноженным на минус один. Принято говорить, что это pH (potentia Hydrogen), или же водородный показатель.
Возникновение понятия
 Вам будет интересно:Какие свойства воздуха использует костер? Или все-таки люди, его разжигая?
Вам будет интересно:Какие свойства воздуха использует костер? Или все-таки люди, его разжигая?
Вообще тот факт, что кислая среда и щелочная среда определяются концентрацией ионов водорода H+ и что чем выше их концентрация, тем раствор более кислый (и наоборот, чем ниже концентрация H+, тем более щелочная среда и выше концентрация противоположных ионов OH-), был известен науке достаточно давно. Однако лишь в 1909 году датский химик Серенсен впервые опубликовал исследования, в которых пользовался понятием водородного показателя – PH, впоследствии замененным на pH.
Расчет кислотности

При расчете водородного показателя исходят из того, что молекулы воды в растворе, хоть и в очень малых количествах, все же диссоциируют на ионы. Эта реакция называется автопротолизом воды:
H2O –> H+ + OH-
Реакция обратима, поэтому для нее определена константа равновесия (показывающая, какие в среднем устанавливаются концентрации каждого компонента). Здесь дано значение константы для стандартных условий – температуры 22 °С.
Внизу в квадратных скобках – молярные концентрации указанных компонентов. Молярная концентрация воды в воде – приблизительно 55 моль/литр, то есть величина второго порядка. Следовательно, произведение концентраций ионов H+ и OH- – около 10-14. Эта величина называется ионным произведением воды.
В чистой воде концентрации ионов водорода и гидроксид-ионов равны 10-7. Соответственно, водородный показатель воды будет приблизительно 7. Это значение pH принимают за нейтральную среду.

Далее нужно отвлечься от воды и рассмотреть раствор какой-нибудь кислоты или щелочи. Возьмем, например, уксусную кислоту. Ионное произведение воды останется прежним, однако баланс между ионами H+ и OH- сместится в сторону первых: ионы водорода придут от частично продиссоциировавшей уксусной кислоты, а “лишние” гидроксид-ионы уйдут в недиссоциировавшие молекулы воды. Таким образом, концентрация ионов водорода будет выше, и pH будет меньше (не надо забывать, что логарифм берется со знаком “минус”). Соответственно, кислая среда и щелочная среда связаны с pH. И связаны следующим образом. Чем меньше значение водородного показателя, тем более кислая среда.
Свойства кислой среды
Кислая среда – это растворы с pH меньше 7. Следует оговориться, что, хотя значение ионного произведения воды на первый взгляд ограничивает значения водородного показателя в пределах от 1 до 14, на самом деле растворы с pH меньше единицы (и даже меньше нуля) и больше 14 существуют. Например, в концентрированных растворах сильных кислот (серной, соляной) pH может достигать -2.
 Вам будет интересно:Термин таймшит. Таймшит – это…
Вам будет интересно:Термин таймшит. Таймшит – это…
От того, имеем ли мы кислую среду или среду щелочную, может зависеть растворимость некоторых веществ. Например, возьмем гидроксиды металлов. Растворимость определяется величиной произведения растворимости, которое по структуре есть то же, что и ионное произведение воды: перемноженные концентрации. В случае с гидроксидом в произведение растворимости входит концентрация иона металла и концентрация гидроксид-ионов. В случае избытка ионов водорода (в кислой среде) они будут активнее “вырывать” гидроксид-ионы из осадка, тем самым смещая равновесие в сторону растворенной формы, повышая растворимость осадка.
Также стоит упомянуть, что весь пищеварительный тракт человека имеет кислую среду: pH желудочного сока колеблется от 1 до 2. Отклонение от этих значений в меньшую или большую сторону может являться признаком различных заболеваний.

Свойства щелочной среды
В щелочной среде водородный показатель принимает значения, превышающие 7. Для удобства в средах с высокой концентрацией гидроксид-ионов вместо водородного показателя кислотности pH пользуются показателем основности pOH. Нетрудно догадаться, что он обозначает величину, равную -lg[OH-] (отрицательный десятичный логарифм концентрации гидроксид-ионов). Непосредственно из ионного произведения воды следует равенство pH + pOH =14. Поэтому pOH = 14 – pH. Таким образом, у всех утверждений, верных для показателя кислотности pH, верны обратные утверждения для показателя основности pOH. Если pH щелочной среды большой по определению, то ее pOH, очевидно, маленький, и чем сильнее раствор щелочи, тем меньше показатель pOH.
В этом предложении только что появился логический парадокс, вносящий путаницу во многие рассуждения о кислотности: маленький показатель кислотности обозначает высокую кислотность среды, и наоборот: большие значения pH соответствуют низкой кислотности. Этот парадокс появляется потому, что логарифм берется со знаком минус, и шкала кислотности как бы инвертируется.
Практическое определение кислотности
Для определения кислотности среды применяются так называемые индикаторы. Обычно это достаточно сложно устроенные органические молекулы, которые меняют свой цвет в зависимости от pH среды. Индикатор меняет свой цвет в очень узком интервале pH: это используется в кислотно-основном титровании, чтобы добиться точных результатов: титрование прекращают, как только индикатор меняет цвет.
Наиболее известные индикаторы – метиловый оранжевый (интервал перехода в области с маленьким pH), фенолфталеин (интервал перехода в области с большим pH), лакмус, тимоловый голубой и другие. В кислых средах и щелочных средах применяются разные индикаторы в зависимости от того, в какой области лежит их интервал перехода.
Существуют также универсальные индикаторы – они меняют свой цвет постепенно с красного на глубоко фиолетовый при переходе из сильно кислотных сред в сильно щелочные. На самом деле универсальные индикаторы представляют собой смесь из обычных.

Для более точного определения кислотности используют прибор – pH-метр (потенциометр, метод, соответственно, называется потенциометрия). Его принцип работы основан на измерении ЭДС в цепи, элементом которой является раствор с измеряемым pH. Потенциал электрода, погруженного в раствор, чувствителен к концентрации ионов водорода в растворе – отсюда изменение ЭДС, на основании которого рассчитывается реальный pH.

Кислотность различных сред в быту
Показатель кислотности имеет большое значение в повседневной жизни. Например, слабые кислоты – уксусная, яблочная – используются в качестве консервантов. Щелочные растворы являются моющими средствами, в том числе и мыло. Самое простое мыло представляет собой натриевые соли жирных кислот. В воде они диссоциируют: остаток жирной кислоты – очень длинный – с одной стороны имеет отрицательный заряд, а с другой своей стороны – длинную неполярную цепочку атомов углерода. Тот конец молекулы, на котором заряд участвует в гидратации, собирает вокруг себя молекулы воды. Второй конец присоединяется к другим неполярным вещам, например, молекулам жира. В результате образуются мицеллы – шарики, у которых наружу торчат “хвосты” с отрицательным зарядом, а внутри спрятаны “хвосты” и частички жира и грязи. Поверхность отмывается от жира и грязи за счет того, что моющее средство связывает весь жир и грязь в такие мицеллы.
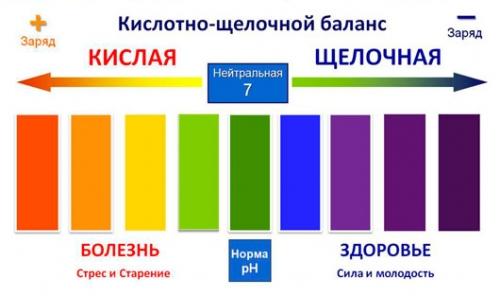
Кислотность и здоровье

Уже было упомянуто, что pH имеет большое значение для человеческого организма. Кроме пищеварительного тракта, показатель кислотности важно контролировать и в других частях организма: кровь, слюна, кожа – для многих биологических процессов имеют большое значение кислая среда и щелочная среда. Их определение позволяет оценить состояние организма.
Сейчас набирают популярность pH-тесты – так называемые экспресс-тесты для проверки кислотности. Они представляют собой обычные полоски универсальной индикаторной бумаги.
Источник

Слово «кислота» происходит от латинского слова «кислый». Некоторые продукты с нашего стола, к примеру, уксус или лимонный сок, — кислоты. Основание — соединение, химически противоположное кислоте, и при реакции с кислотой дает нейтральное соединение — соль. Растворимые в воде основания называются щелочами. В цитрусовых плодах — грейпфрутах, апельсинах лимонах — содержатся лимонная и аскорбиновая кислоты. Пчелиный яд – кислота. Нейтрализовать её можно основанием. В цитрусовых плодах – грейпфрутах, апельсинах, лимонах – содержится лимонная и аскорбиновая кислоты.
Кислоты содержат атомы водорода (катион) и кислотный остаток (анион). Щелочи содержат атомы металла (катион) и гидрокисильную группу ОН (анион). Это базовые определения.
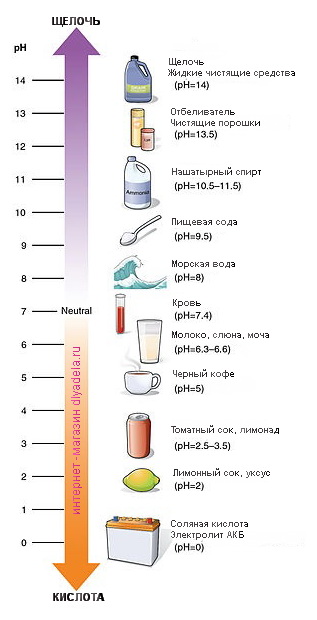
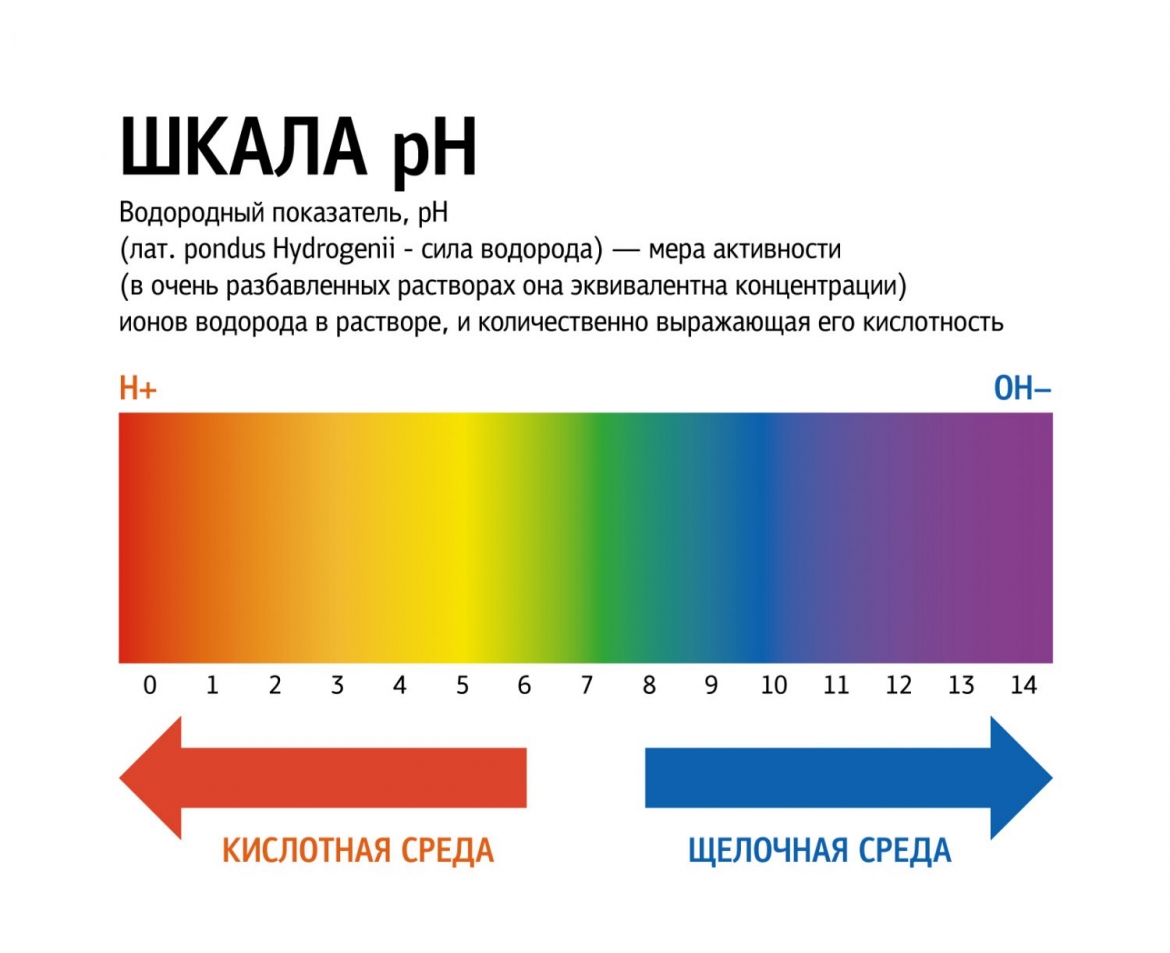
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 это все кислоты, а больше 7 это щёлочи.
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов…
Кислоты
Кислоты — это соединения, содержащие водород и образующие ионы водорода (Н+) при растворении в воде. Ионы — это частицы с электрическим зарядом (см. статью «Химические связи»). Именно ионы придают кислотам их свойства, но существовать они могут только в растворе. Следовательно, свойства кислот проявляются исключительно в растворах. Молекула серной кислоты (H2SO4) состоит из атомов водорода, серы и кислорода. В состав соляной кислоты (НСl) входят водород и хлор. Кислота считается сильной, если большинство ее молекул распадаются в растворе, выделяя ионы водорода. Соляная, серная, азотная кислоты относятся к сильным. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность»Сила кислоты измеряется числом рН — водородным показателем. Сильные кислоты очень агрессивны; попав на поверхность предмета или на кожу, они прожигают её. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность».
Такие кислоты, как лимонная или уксусная, т.е. произведенные живыми организмами, называются органическими. Кислоты широко применяются в химической и медицинской промышленности, в производстве продуктов питания и синтетических волокон. Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота. В цветных пятнах на коже морских улиток содержится кислота с неприятным вкусом, отпугивающая хищников. Для всех кислот характерно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода. Реакции кислот с большинством металлов дают соль и водород. Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Известный кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту. Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе. Число рН изменяется от 0 до 14. Чем меньше рН, тем выше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота. Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральны, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить с помощью индикатора. Индикатор — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи. Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из примитивных растений, называемых лишайниками. Другие растения, например, гортензия и краснокочанная капуста, также являются природными индикаторами.

Так называемый универсальный индикатор – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества. Он становится красным, оранжевым или желтым в кислотах, зеленым или желтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
Цветы гортензии на кислотной почве синие, а на щелочной — розовыеКислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.
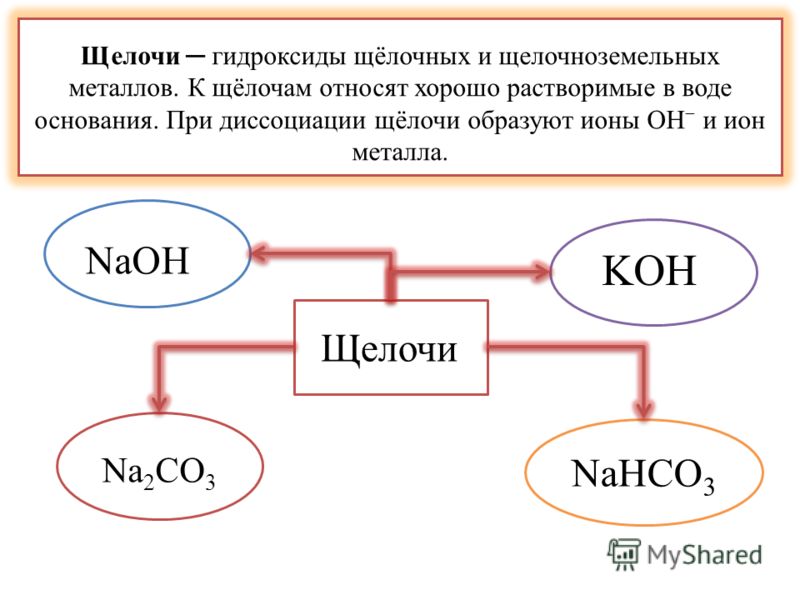
В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH−. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов. Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
Едкий натр. Самая популярная и востребованная в мире щелочь. Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали. Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия. Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция. Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития. Востребованное соединение в химпроме как сырье; в стекольной, керамической, Фиксаналырадиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария. Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
Есть мнения что:
• Кислоты и щелочи неспособны мирно сосуществовать даже одну секунду, находясь в соприкосновении. Перемешавшись, они мгновенно начинают бурное взаимодействие. Химическая реакция с ними сопровождается шипением и разогревом и длится до тех пор, пока эти ярые антагонисты не уничтожат друг друга.
• Кислотам свойственно образовывать кислую среду, а щелочам – щелочную.
• Химики отличают щелочь от кислоты по ее поведению с лакмусовой бумажкой или фенолфталеином.
Источники:
www.polnaja-jenciklopedija.ru/nauka-i-tehnika/kisloti-osnovaniya-schelochi.html
yznavai.ru/kisloty-i-shhyolochi
thedifference.ru/chem-otlichaetsya-kislota-ot-shhelochi
Источник
