Какие ионы могут проявлять восстановительные свойства
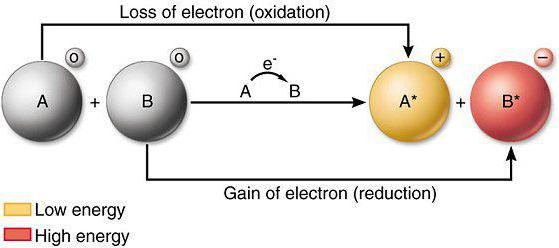
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым – соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
– Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
– S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4

Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
– Mn+7 принимает 5 e = Mn+2 2 является окислителем,
– 2I- отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
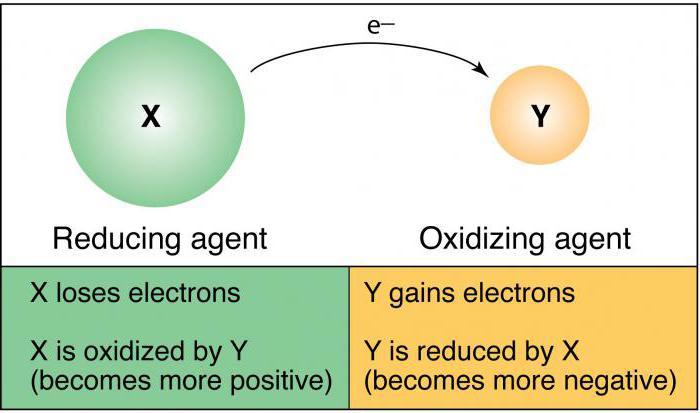
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
– серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
– Mn+7 принимает 5 e= Mn+2 2,
– S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
– нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
– Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
– Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
– 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
– Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции – фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла – алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Источник
Укажите изменение окислительно-восстановительных свойств галогенов при переходе от фтора к йоду Как меняются эти же свойства у соответствующих ионов F , С1 , Вг, J Приведите примеры. [c.150]
Вычислите электродные потенциалы приведенных полуреакций, протекающих в водных растворах с рН = 0, и предскажите характер изменения окислительно-восстановительных свойств веществ по мере повышения концентрации ионов водорода в растворе. [c.251]
Как следует из табл. В.32, восстановительные свойства соединений ослабляются с убыванием порядка связи. Так, гидразин в присутствии ионов Мо + восстанавливает пероксид водорода до воды, окисляясь при этом до N2. Окислительно-восстановительные свойства гидразина сильно зависят от pH [c.536]
Окислительно-восстановительные свойства элементов и их ионов определяются их способностью отдавать или присоединять электроны. Атомы или ионы, присоединяющие электроны, называются окислителями, а отдающие их — восстановителями. [c.17]
Окислительно-восстановительные свойства элементов в большой степени зависят от числа электронов на внешней оболочке и радиуса атома или иона. Если на внешней оболочке находится один, два или три электрона, то элемент может быть только восстановителем — присоединение электронов для него практически невозможно (исключение составляют водород и бор). При наличии четырех, пяти, шести или семи электронов возможно проявление и восстановительных, и окислительных [c.17]
Опыт 26. Окислительно-восстановительные свойства иона 0з > а) К раствору диоксида серы в воде приливайте по каплям бромную воду. Опытным путем определите продукты реакции. [c.57]
Хлороводород, строение молекулы. Растворение в воде. Хлороводородная (соляная) кислота, ее соли. Окислительно-восстановительные свойства. Качественная реакция на хлорид-ион. Получение и применение хлороводорода [c.114]
Ион металла при этом восстанавливается в одну из низших валентных форм. В результате совместного действия кислорода и углеводорода ионы металлов часто находятся в разных валентных состояниях, что в среднем соответствует некоторой дробной величине. Так, ион ванадия при окислении нафталина воздухом имеет среднюю валентность 4,3 вместо 5 в УгОб. Очевидно, что состояние иона металла определяется окислительно-восстановительными свойствами среды и зависит от соотношения кислорода и углеводорода, от наличия водяных паров и т. д. При этом в начальный период работы катализатор постепенно формируется в состояние, стабильное для данных условий синтеза, а варьирование условий может изменить его активность и селективность. [c.412]
Периодичность накопления электронов около ядра влечет за собой периодичность в изменении свойств атомов (элементов). Периодически изменяются валентность, радиусы атомов и ионов, окислительно-восстановительные свойства, ионизационные потенциалы, сродство к электрону, температуры плавления и кипения и др. [c.85]
Определение ионов, не обладающих окислительно-восстановительными свойствами (титрование по замещению). Этим методом могут быть определены, например, катионы кальция, стронция, бария, свинца, цинка и др., которые образуют малорастворимые оксалаты. При определении кальция осаждают оксалат кальция, затем после фильтрования и тщательного промывания растворяют осадок в серной кислоте и выделившуюся щавелевую кислоту титруют перманганатом калия. [c.276]
С переменной валентностью многих элементов Н1 аналитической группы связано наличие у ряда образуемых ими ионов окислительно-восстановительных свойств. Например, катионы Сг+++ и Мп++ при действии окислителен способны окисляться в анио- [c.127]
Отсюда возникает возможность двоякого использования окислительно-восстановительных свойств пары 12/21 в титриметрическом анализе для определения восстановителей — окислением их раствором иода и для определения окислителей — восстановлением Г-ионами. [c.396]
Изложенное показывает, что комплексообразование может сильно влиять на окислительно-восстановительные свойства ионов в растворах. Известно очень много комплексов Ре, Со, N1, некоторые из них имеют большое практическое значение. [c.561]
Одним из наиболее важных достоинств полярографического метода анализа является возможность одновременного определения нескольких полярографически активных веществ. Величина 1/2 характеризует природу иона, восстанавливающегося или окисляющегося на электроде. Для обратимого процесса величина 1/2 практически совпадает с величиной стандартного окислительного потенциала. Если в растворе присутствует несколько веществ, различающихся по окислительно-восстановительным свойствам, то в ряде случаев (если 1/ будут отличаться не менее чем на 100 мВ) удается фиксировать волны, соответствующие раздельному восстановлению компонентов смеси на электроде. В этом случае получают полярографический спектр. [c.169]
Приведите примеры реакций, иллюстрирующие окислительные, восстановительные свойства, а также примеры диспропорционирования иона NOr. [c.66]
Опишите окислительно-восстановительные свойства атомов и ионов щелочных металлов. [c.155]
Окислительно-восстановительные свойства галогенов зависят от электроотрицательности, энтальпии диссоциации и других факторов. С увеличением радиуса атомов окислительные свойства галогенов ослабевают. Поэтому легче всего окисляется ио-дид-ион, тогда как фторид-ион не может быть окислен обычными окислителями. [c.497]
При характеристике окислительно-восстановительных свойств сложных соединений необходимо в ряде случаев принимать во внимание степени окисления других атомов, входящих в их состав. Так, подчеркивая восстановительные свойства H I, НВг и HI, обусловленные ионами С1, Вг” и Г, не следует упускать из виду возможность проявления ими же окислительных свойств, обусловленных ионом Н+, например [c.125]
Окислительно-восстановительные свойства свинца и олова. Соединения олова (II) в щелочной среде проявляют восстановительные свойства сильнее, чем в кислой, так как образующиеся атомы связываются кислородом иона ОН” в стан-нат-ион [c.206]
Опыт 4. Окисление алюминия ионами водорода. Внесите кусочек алюминия в 2 н. раствор НС1. Наблюдайте окисление и составьте уравнение происходящей окислительно-восстановительной реакции. Дайте сравнительную характеристику окислительно-восстановитеЛьных свойств атомов и ионов алюминия и водорода. [c.143]
Как и кислородные кислоты галогенов, окислительно-восстановительные свойства проявляют их соли, которые используют главным образом как окислители. Кислородные соединения хлора, брома и иода, проявляя окислительные свойства, восстанавливаются в зависимости от условий реакции до свободного состояния или до отрицательно заряженного иона, например [c.126]
Об окислительно-восстановительных свойствах простых веществ и соединений можно судить, руководствуясь периодической системой элементов Д. И. Менделеева. Типичными окислителями являются а) простые вещества, атомы которых обладают большой электроотрицательностью (элементы VIA и VHA групп), из них наиболее активны фтор, а также кислород и хлор, б) ионы с дефицитом электронов, это простые катионы с высшей или большой степенью окисления, например РЬ Fe Т1 , Се , и сложные анионы, в которых более электроположительный элемент имеет высшую или значительную степень окисления, например (Сг 04) , ( rl O ) (N 03), (Мп 04)-, (S U) -, (сг Оз)- (С1 о -, (В1 0з), (Pb U) , (СГ 0)-, (Вг 0з)-. [c.217]
Участвующие в растворе ионы в данных условиях не обладают характерными окислительно-восстановительными свойствами, а поэтому реакция с Изменением степени окисления заряда ионов произойти не может. Следовательно, данная реакция относится к ионообменным. [c.46]
Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, от каких участвующих в реакции атомов, молекул или ионов и к каким атомам, молекулам или ионам переходят электроны и в каком количестве. Это можно установить на основе периодической системы Д. И. Менделеева, зная строение атомов и молекул, окислительно-восстановительные свойства реагирующих веществ (восстановителей и окислителей), условия протекания реакций, правила и методы их составления, значения ионизационных потенциалов, сродства к электрону, электроотрицательности атомов, окислительно-восстановительные потенциалы. [c.89]
Выше было отмечено, что окислительно-восстановительные свойства могут проявляться у нейтральных атомов, молекул, элементарных ионов и сложных ионов. Характеристика нейтральных атомов и молекул дана в табл. 62. [c.197]
Окислительно-восстановительные свойства элементарных веществ и образованных ими элементарных ионов являются перио- [c.140]
Наличие нескольких характерных степеней окисления у марганца предопределяет окислительно-восстановительные свойства его соединений. Перманганат-ион проявляет окислительные свойства в водном растворе при любом значении pH, причем в кислотной среде он — сильный окислитель [c.243]
Оценка окислительно-восстановительных свойств элементарных ионов вытекает из следующих соображений [c.141]
При заполнении графы Окислительно-восстановительные свойства учтите, что вопрос относится не к ионам Н , которые могут быть только окислителями, а к анионам или к молекулам кислоты. Пробу на окислительные свойства проделайте, подействовав на одну-две капли кислоты каплей раствора, в,состав которого входит серная кислота, иодид калия и крахмальный клейстер. Посинение раствора вследствие появления свободного иода укажет на присутствие в кислоте анионов или молекул-окислителей. Восстановительные свойства кислоты исследуйте, подействовав на две-три капли кислоты каплей раствора перманганата калия, подкисленного серной кислотой. Обесцвечивание раствора указывает на восстановительные свойства исследуемой кислоты. [c.297]
Анион 50 Открывают реакцией с ионом Ва ” . Кислота сильная, так как водный раствор ее соли с натрием показывает нейтральную реакцию. Ион S0 не обнаруживает резко выраженных окислительно-восстановительных свойств. Кислота устойчивая. Термический распад возможен только при очень высокой температуре. Концентрированная кислота заметно отличается от разбавленной по окислительным свойствам и более резко выраженной способности к гидратации — к обезвоживающему действию. [c.297]
Опыт 15. Окислительно-восстановительные свойства нитрат (1П)-иона. Исследуйте отношение раств1ора нитрита натрия (калия) к подкисленным растворам иоДида калия и оксоманганата (VII) калия. [c.66]
Окислительно-восстановительные свойства сложных отрицательных ионов зависят от величины положительной валентности центрального атома. При максимальной валентности они проявляют окислительные свойства (А), а при промежуточной валентности — окислительно-восстано-вительные свойства (Б). [c.198]
То, что было сказано об окислительно-восстановительных свойствах фторидов, остается справедливым и для хлоридов. Однако, так как хлор более слабый окислитель, чем фтор, то его ион СГ при известных условиях проявляет свои восстановительные свойства. [c.244]
Окислительно-восстановительные свойства нейтральных атомов и ионов можно легко объяснить с помощью периодической системы элементов Менделеева (см. табл. 11). [c.136]
Окислительно-восстановительные свойства элементарных ионов. Элементарные ионы могут быть заряжены отрицательно или положительно. [c.141]
Окислительно-восстановительные свойства сложных ионов. [c.142]
Оквслительно-восстановительные свойства элементарных ионов. Окислительно-восстановительные свойства элементарных ионов обусловливаются строением их электронных оболочек и энергетическими характеристиками энергией ионизации и сродством к электрону. Элементарные анионы образуются при присоединении к нейтральным атомам элементов шестой группы двух [c.151]
Райт и Уэллер [6] изучали влияние добавок на изменение среды. Как известно, образование клешневидных колец изменяет окислительно-восстановительные свойства ионов н поэтому, но-видимому, снособно оказать влияние иа активацию водорода. Присутствие этилендиамина и этилепдиамиптетрауксусной кислоты вызывает уменьшение как скорости, так и степени восстановления хинона и моногидрата ацетата меди(И) в хинолиновом растворс при 100°. Образование металлической меди авторы относят за счет присутствия органического вещества. [c.187]
Каковы окислительно-восстановительные свойства сульфидокарбонат(роданид)-иона Какие атомы иона [c.79]
Двухвалентный кислород в соединении МпО аналогично кислороду в ионе 804 не может быть восстановителем. В реакции участвует разбавленная серная кислота, которая не проявляет окислительно-восстановительных свойств за счет ионов Следовательно, в молекуле N32803 ион 80з ” — восстановитель, он отдает 2 электрона и переходит в ион 804 , в молекуле КМПО4 ион Мп04 — окислитель, он в кислой среде принимает 5 электронов и переходит— в ион Мп . [c.198]
Каковы окислительно восстановительные свойства воды Составьте ионно-элекгронные уравнения для воды как окислителя и как восстановителя. [c.153]
Закономерным образом зависят от строения атома окислительно-восстановительные свойства элементов. Восстановительные свойства атомов уменьшаются в группах снизу вверх и в периодах слева направо. Таким образом, наиболее сильные восстановители — щелочные металлы. Окислительные свойства возрастают в периодах слева направо, а в группах — снизу вверх. Следовательно, наиболее сильными окислителями являются галогены, а также кислородсодержащие ионы неметаллов (N03-, ВгОз и т. д.) и металлов в высшей степени окисления (Сг04 -, М.ПО4 и др.). При этом окислительная способность убывает сверху вниз в группах. Восстановительные свойства, возрастающие сверху вниз в группе, могут проявлять и отрицательно заряженные ионы неметаллов (I”, и т. д.). [c.33]
В общем случае схема дробного анализа иона М в присутствии ионов Мь Ма, Мз,. .., М составляется следующим образом 1) из характерных реакций иона М выбирают реакцию с высоким индексом избирательности или с наименьшим числом мешающих ионов 2) выбирают реагент, связывающий мешающие ионы в прочные комплексы, но не связывающий определяемый ион М 3) если ионы Мь. .., М обладают окислительно-восстановительными свойствами, подбирают реагент и условия для переведения мешающих ионов в такую степень окисления, в которой они не мешают обнаружению иона М 4) если пункты 2 и 3 не выполнимы, из общих реакций выбирают такую, чтобы ион М и ионы Мь. … М оказались в разных фазах (растворч осадок, раствор газ) 5) если пункт 4 не выполним, подбор общих реакций продолжают до тех пор, пока в одной фазе с М останутся ионы, не мешающие его [c.122]
В результате платина получает положительный заряд, а раствор у поверхности ее — отрицательный заряд за счет образовавшегося избытка ионов С1 . Равновесие в двойном электрическом слое выразится уравнением Ре +е s f Pe2. ” Таким образом, возникает положительный потенциал на платине, который будет тем выше, чем больше окислительная способность катиона. И, наоборот, чем сильнее восстановительная активность иона, тем вероятнее отдача электрона им в кристаллическую решетку платины и возникновение отрицательного заряда на ней. Так появляется отрицательный потенцйал на платине в растворе, содержащем ионы Ст . В двойном слое устанавливается равновесие Сг з Сг + е. Потенциал платины в разобранных двух примерах определяется соотношением активных концентраций окисленной и восстановленной формы ионов и характеризует окислительновосстановительную способность каждой из систем Ре , Pe Pt и Сг2, r Pt. Потому потенциал и получил название окислительновосстановительного. Отметим, что это название сохранилось за потенциалами систем только в тех случаях, когда в электродной реакции не участвуют непосредственно металлы газы, хотя очевидно, что во всех случаях причиной возникновения скачка потенциала является окислительно-восстановительный процесс на поверхности электрода, приводящий к образованию двойного электрического слоя и потенциала в нем. Следовательно, потенциал характеризует окислительно-восстановительные свойства системы. [c.195]
Смотреть страницы где упоминается термин Ионы, окислительно-восстановительные свойства:
[c.121]
[c.284]
Источник
