Какие химические свойства жиров

Жиры – это сложные эфиры, образованные глицерином и высшими одноосновными карбоновыми кислотами (жирными кислотами).
.

Жиры образуются при взаимодействии глицерина и высших карбоновых кислот:

| Жирные (высшие) кислоты | |
| Предельные кислоты | Непредельные кислоты |
| Масляная кислота С3Н7 -СООН | Олеиновая кислота С17Н33СООН (содержит одну двойную связь в радикале) СН3—(СН2)7—СН = СН—(СН2)7—СООН |
| Пальмитиновая кислота С15Н31 — СООН | Линолевая кислота С17Н31СООН (две двойные связи в радикале) СН3-(СН2)4-СН = СН-СН2-СН = СН-СООН |
| Стеариновая кислота С17Н35 — СООН | Линоленовая кислота С17Н29СООН (три двойные связи в радикале) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
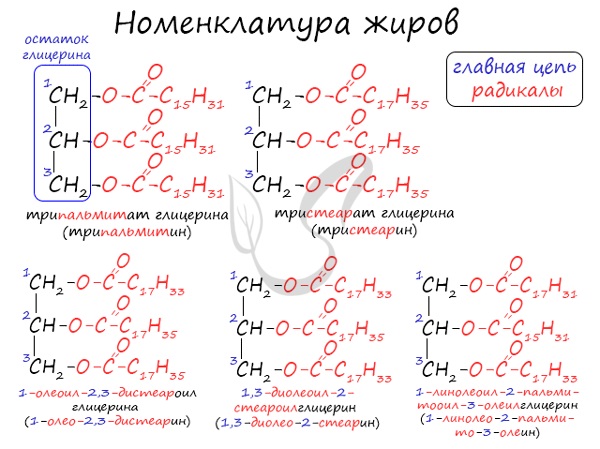
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:

Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
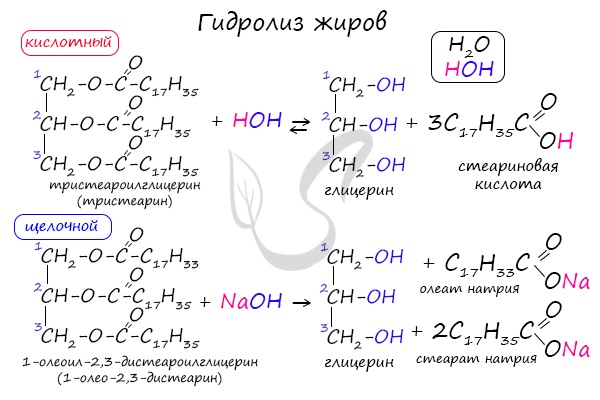
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин

1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия.

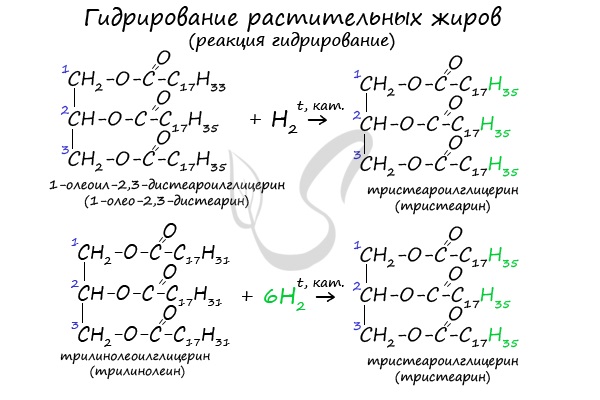
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина:

Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира.
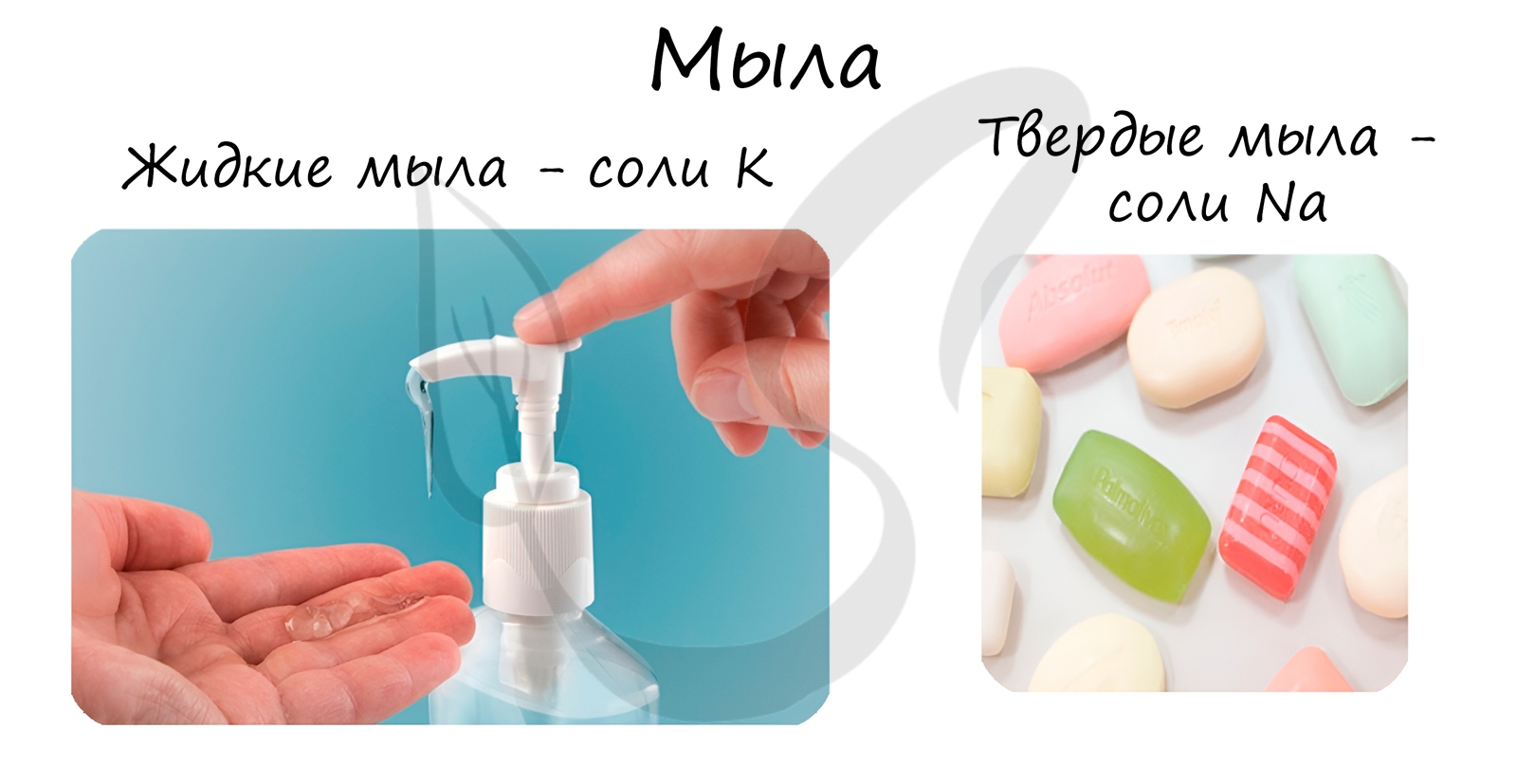
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca2+ и Mg2+ дают с высшими кислотами нерастворимые в воде соли.
Например, тристеарат глицерина взаимодействует с сульфатом кальция
![]()
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата.
![]()
Далее алкилсульфат гидролизуется щелочью:
![]()
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Источник
Жиры – органические соединения, по строению являющиеся сложными эфирами трехатомного спирта глицерина и высших карбоновых (жирных)
кислот.
К жирным кислотам (их формулы лучше выучить 😉 относятся:
- Пальмитиновая – C15H31COOH (предельная)
- Стеариновая – C17H35COOH (предельная)
- Олеиновая – C17H33COOH (непредельная, 1 двойная связь в радикале)
- Линолевая – C17H31COOH (непредельная, 2 двойные связи в радикале)
- Линоленовая – C17H29COOH (непредельная, 3 двойные связи в радикале)
Растительные и животные жиры
Жиры образуются в организме растений и животных, служат запасным питательным веществом. В строении растительных и животных жиров
есть некоторые важные отличия.
Заметьте, что растительные жиры чаще жидкие и в них входят преимущественно остатки непредельных жирных кислот, а животные жиры – твердые и
содержат остатки предельных жирных кислот.

Номенклатура жиров
По систематической номенклатуре жиры принято называть триацилглицеринами. Названия жирам дают в зависимости от ацилов – остатков жирных
кислот, входящих в их состав. Для формирования единого названия к остаткам кислот добавляют суффикс “оил”.
В соответствии с тривиальной номенклатурой, жиры называют, добавляя окончание “ин” к названию кислоты и приставку, указывая, сколько гидроксогрупп
в молекуле глицерина подверглось этерификации. В общем лучше 1 раз увидеть, чем 100 раз услышать 😉
Получение жиров
Жиры (по строению сложные эфиры) получаются в реакции этерификации, протекающей между трехатомным спиртом глицерином и высшими карбоновыми
(жирными) кислотами.
В зависимости от того, какие именно кислоты участвуют в реакции, образуются различные жиры.

Химические свойства жиров
- Гидрирование растительных жиров
- Гидролиз
В состав растительных жиров входят непредельные кислоты, которые поддаются гидрированию и превращаются в предельные. Таким путем в пищевой
промышленности получают маргарин.
Как сложные эфиры, жиры способны вступать в реакцию гидролиза, который может быть кислотным и щелочным. В результате кислотного гидролиза
образуется глицерин и исходные жирные кислоты, в результате щелочного гидролиза – глицерин и соли жирных кислот.
Реакция щелочного гидролиза жиров называется реакцией омыления, в результате получаются соли жирных кислот – мыла. Кислотный гидролиз протекает
обратимо, щелочной – необратимо.
В состав твердого мыла входят соли Na, в состав жидкого – K.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Химические свойства жиров обусловлены наличием:
1. Сложных эфирных связей,
2. Двойных связей в углеводородных радикалах жирных кислот,
3. Наличием глицерина в составе жира.
1. Обусловленные наличием сложных эфирных связей
Жиры легко подвергаются гидролитическому расщеплению при участии ферментов, образуется глицерин и жирные кислоты.
Ферментативный гидролиз происходит ступенчато. Фермент – липаза содержится во всех жирномасличных растениях. Гидролизу способствует влага и повышенная температура. Происходит гидролитическое прогоркание жира.
Указанное свойство учитывается при хранении жиров.
Жиры расщепляются под действием щелочей с образованием глицерина и солей жирных кислот. Образующиеся соли называют мылами: калиевые мыла – жидкие, натриевые – твердые.
Процесс называют омылением
C3H5(COOR)3 + 3 NaOH C3H5 (OH)3 + 3 R`COONa
Свойство учитывают в анализе жира. Реакция омыления широко используется для приготовления бытовых и медицинских мыл, а также для выяснения состава жиров и их доброкачественности.
Чем больше число омыления, тем меньше молекулярная масса глицеридов.
2. Обусловленные наличием двойных связей в углеводородных радикалах жирных кислот
По двойньм связям жирных кислот может присоединяться водород, галогены, кислород.
1). Присоединение водорода – гидрирование жиров (гидрогенизация жиров) идет при повышенной температуре в присутствии катализатора (трубчатый никель).
Непредельные жирные кислоты переходят в предельные, жидкие масла превращаются в твердые. Получают саломассы, их используют в медицинской практике как мазевые и суппозиторные основы (бутирол) и в пищевой промышленности – производство маргарина.
Реакция гидрогенизации широко используется для получения плотных жиров из растительных масел.
2). Присоединение галогенов – это свойство используют в анализе жиров. При определении химической константы – йодного числа.
Надежным способом выявления высыхаемости масел служит определение йодного числа. Известно, что все непредельные кислоты, в том числе и жирные, способны присоединять по месту двойной связи галогены.
Чем больше в жирных кислотах будет двойных связей, тем больше присоединится галогенов.
По величине йодного числа можно легко установить, к какой группе по степени высыхаемости относится то или иное масло.
Йодное число некоторых масел
| Невысыхающие масла (тип олеиновой кислоты) | |
| Оливковое | 80-85 |
| Арахисовое | 83-105 |
| Миндальное | 93-102 |
| Персиковое | 96-103 |
| Касторовое | 81-90 |
| Полувысыхающие масла (тип линолевой кислоты) | |
| Горчичное | 93-107 |
| Кунжутное | 103-112 |
| Хлопковое | 100-120 |
| Подсолнечное | 119-144 |
| Кукурузное | 111-131 |
| Высыхающие масла (тип линоленовой кислоты) | |
| Маковое | 131-143 |
| Конопляное | 140-175 |
| Льняное | 169-192 |
Способность некоторых масел к высыханию широко используется в народном хозяйстве (лакокрасочная промышленность).
Для медицины, наоборот, представляют интерес масла невысыхающие, поскольку они используются для парентерального введения лекарственных средств.
Олеиновая кислота обладает способностью под влиянием азотистой кислоты переходить в свои стереоизомер – элаидиновую кислоту, которая при комнатной температуре имеет твердую консистенцию.
Этой реакцией, известной под названием элаидиновая проба, широко пользуются для определения типа масла: если проба положительная, то, следовательно, исследуемое масло невысыхающее (содержит триглицериды олеиновой кислоты).
3). Присоединение кислорода воздуха приводит к окислению и прогорканию жиров. Может быть химическое окисление (альдегидное) и биохимическое при участии микроорганизмов (кетонное). Жиры приобретают специфический вкус и запах и к употреблению непригодны. Изменяется цвет жира – чаще обесцвечиваются; изменяются физические и химические свойства жира: увеличивается плотность и кислотное число, уменьшается йодное число и вязкость.
Различают 3 вида окислительного прогоркания:
1 – неферментативное – кислород присоединяется по месту двойных связей, образуя пероксиды; при разложении пероксидов жирных кислот получаются альдегиды.
+O2
R1 – CH = CH – R2 R1 – CH – CH – R2 R1 – C = O + R2 – C = O
O O H H
2. – ферментативное с участием липоксидаз и липоксигеназ, образуются гидропероксиды.
+O2
R1 – CH2 – CH = CH2 – R2 R1 –CH2 – CH = CH – CH – R2
O – OH
Гидропероксиды способны окислять БАВ, содержащиеся в масле, например, каротиноиды. Гидроперикиси подвергаются разложению с образованием альдегидов и кетонов.
Свойство учитывают при хранении жиров и при анализе.
3. – ферментативное (кетонное) – происходит при участии микроорганизмов, образуется кетокислота и кетон
Этот вид порчи жира легко контролируется по величине кислотного числа (КЧ).
Глииерин, входящий в состав жира, подвергается окислению и дегидратации при нагревании жира с конц. серной кислотой. Ощущается неприятный запах акролеина. Это «акролеиновая проба», позволяющая отличить жиры от жироподобных веществ.
акролеин
Источник
Жиры
Жиры — это сложные эфиры глицерина и высших одноосновных карбоновых кислот.

Глицерин как трёхатомный спирт может образовывать сложные эфиры с участием либо всех, либо части гидроксильных групп. В природе встречаются только полные эфиры глицерина — продукт реакции по всем ОН-группам.
Общее название таких соединений — триглицериды или триацилглицериныТриацилглицерин — продукт замеще-ния атомов водорода в трех ОН-группах глицерина на три ацильные группы -C(O)R (ацил – остаток карбоновой кислоты)., где ацил – остаток карбоновой кислоты -C(O)R .
.
В состав природных триглицеридов входят остатки насыщенных (предельных) кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH и др.) и ненасыщенных (непредельных) кислот (олеиновой C17H33COOH, линолевой C17H31COOH, линоленовой C15H29COOH и др.). Эти и подобные монокарбоновые кислоты называют высшими жирными кислотами (ВЖК).
Природные жиры представляют собой смесиНапример, триглицериды молочного жира содержат остатки более 15-ти различных жирных кислот, другие жиры – по 5-8. полных сложных эфиров глицерина, отличающихся остатками жирных кислот.
Жирные кислоты, образующие молекулы жиров, характеризуются рядом общих признаков:
– являются монокарбоновыми;
– содержат чётное число углеродных атомов (от 4 до 24);
– углеводородные радикалы имеют неразветвлённое цепное строение;
– для С=С-связей (если они присутствуют) характерна цис-конфигурация (пример );
);
– при наличии двух и более С=С-связей они разделяются метиленовой группой -СН2- (примеры
 ).
).
Эти особенности строения жирных кислот обусловлены процессами биосинтеза.
Жиры содержатся во всех живых организмах (входят в группу липидовЛипиды (от греч. λίπος – жир) – большая и относительно разнородная группа веществ, содержащихся в животных и растительных тканях, легко растворимых в неполярных органических раствори-телях (хлороформ, эфир, бензол) и нерастворимых в воде.
Жиры, наряду с восками, относятся к простым (двухкомпонентным) липидам.) и выполняют важные биологические функции. Наряду с белками и углеводами жиры составляют основу питанияЖиры как продукты питания являются источником энергии, служат теплоизолятором, входят в состав клеточных компонентов, в том числе мембран, используются в биосинтезе очень важных для организма соединений — простагландинов, которые принимают участие почти во всех биологических процессах. Употребление пищи без жира ведет к нарушению деятельности центральной нервной системы, ослаблению иммунитета.
человека (по энергетической ценностиЖиры — самый эффективный источник энергии: 1 г жиров при полном окислении в клетках организма выделяет 40 кДж (9,5 ккал) энергии. жиры вдвое превышают белки и углеводы).
Физические свойства жиров определяются качественным и количественным составом смесей триглицеридов
Физические свойства жиров
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
Консистенция жиров зависит от их состава:
- в твердых жирах преобладают триглицериды с остатками насыщенных кислот, имеющие относительно высокие температуры плавления;
- для жидких жиров (масел), напротив, характерно высокое содержание триглицеридов ненасыщенных кислот с низкими температурами плавления.
Причиной снижения температуры плавления триглицеридов с остатками ненасыщенных кислот является наличие в них двойных связей с цис-конфигурацией. Это приводит к существенному изгибу углеродной цепи, нарушающему упорядоченную (параллельную) укладку длинноцепных радикалов кислот.
Сравним пространственное строение ненасыщенной и насыщенной и кислот с равным числом углеродных атомов в цепи: олеиновой C17H33COOH и стеариновой C17H35COOH.

- На молекулярной модели олеиновой кислоты виден изгиб цепи по связи С=С, препятствующий плотной упаковке молекул.

- В углеродной цепи стеариновой кислоты отсутствуют изгибы, поэтому ее молекулы способны к плотной параллельной укладке.
Чем плотнее упаковка молекул вещества, тем выше температуры его фазовых переходов (т.плав., т.кип.). Соответственно, температура плавления тристеарата глицерина (71 oC) существенно больше, чем у триолеата (–17 oC).
Жиры практически не растворимы в воде, но при добавлении мыла или других поверхностно-активных веществ (эмульгаторов) они способны образовывать стойкие водные эмульсии. Жиры ограниченно растворимы в спирте и хорошо растворимы во многих неполярных и малополярных растворителях – эфире, бензоле, хлороформе, бензине.
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твёрдыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных жирных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов, пальмовое масло).
Масла содержат в основном остатки ненасыщенных (непредельных) кислот. - Важное биологическое значение имеют жиры, содержащие остатки полиненасыщенных жирных кислот
Полиненасыщенные жирные кислоты
При правильном питании примерно треть потребляемых человеком жиров должны составлять растительные масла как источники ненасыщенных кислот, играющих исключительно важную роль в жизнедеятельности организма.
Особенно важны полиненасыщенные жирные кислоты (ПНЖК) с несколькими двойными связями:- линолевая (октадекадиен-9,12-овая)
CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH, - линоленовая (октадекатриен-9,12,15-овая)
CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH, - арахидоновая (эйкозатетраен-5,8,11,14-овая)
CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH, - тимнодоновая (эйкозапентаен-5,8,11,14,17-овая)
CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH и др.
Именно они обладают наибольшей биологической активностью (препятствуют развитию атеросклероза, улучшают кровообращение, уменьшают воспалительные процессы в организме, улучшают питание тканей и т.п.).
Арахидоновая кислота может быть синтезирована в организме из линолевой кислоты, а тимнодоновая — из линоленовой кислоты с помощью ферментативных реакций дегидрирования и удлинения цепи.
Организм человека не может синтезировать линолевую и линоленовую кислоты и должен получать их готовыми с пищей. Поэтому эти полиненасыщенные жирные кислоты получили название “незаменимых” (применяется также условный, устаревший термин «витамин F»).В номенклатуре ненасыщенных кислот используются как общие правила ИЮПАК, так и собственные приёмы с указанием числа атомов углерода, числа и положения двойных связей в структуре молекулы. При этом отсчёт положения двойных связей ведётся не как обычно от карбоксильной группы, а от последнего атома углерода на противоположном конце цепи независимо от её длины. Этот концевой атом углерода обозначается последней буквой греческого алфавита ω (омега). Цифрой указывается положение двойной связи, ближайшей к ω-атому.
Пример:
В соответствии с этим способом линолевая кислота обозначается как
18:3 ω-6,
арахидоновая —
20:4 ω-6,
тимнодоновая —
20:5 ω-3.
- линолевая (октадекадиен-9,12-овая)
Химические свойства жиров обусловлены их принадлежностью к сложным эфирам и наличием двойных С=С-связей.
1. Жирам как сложным эфирам свойственна обратимаяОбратная реакция — этерификация.
реакция гидролиза, катализируемая минеральными кислотами:

При участии щелочей (или карбонатов щелочных металлов) гидролиз жиров происходит необратимо. Продуктами в этом случае являются мыла – соли высших карбоновых кислот и щелочных металлов:

Натриевые соли – твердые мыла, калиевые – жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Высшие карбоновые кислоты можно выделить из мыла действием более сильных кислот.
Видеоопыт “Выделение жирных кислот из мыла”.
При длительном хранениии жиры портятся (прогоркают). Под действием воздуха, света и микроорганизмов происходит частичный гидролиз жиров с образованием свободных жирных кислот и продуктов их превращения, обычно имеющих неприятный запах и вкус. Срок годности жиров увеличивается при низкой темературе и в присутствии консервантов (чаще всего поваренной соли).
2. Жиры, содержащие остатки ненасыщенных кислот, вступают в реакции присоединения по С=С-связям, характерные для алкенов: гидрирование, галогенирование, окисление, полимеризация.
- Жидкие жиры (масла) превращают в твердые путем реакции гидрогенизации (каталитического гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел.
Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас) – используют для получения маргаринаМаргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и т.п.). и других продуктов питания.
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний. Многократное использование растительных масел при жарке также резко повышает содержание в пище опасных транс-жиров.
- Реакция галогенирования – присоединение галогенов по связям С=С – используется для определения степени ненасыщенности жиров и масел.
Видеоопыт “Определение непредельности жиров” (качественная реакция).
Количественно степень ненасыщенности жиров оценивается иодным числом.Иодное число равно массе иода в граммах, присоединяющегося к 100 г жира. Присоединение иода происходит по двойным связям С=С. Чем больше значение иодного числа, тем выше степень ненасыщенности кислот, входящих в состав жира. - Масла с высоким содержанием остатков ненасыщенных кислот с двумя или тремя С=С-связями способны к окислительной полимеризации под действием кислорода воздуха, солнечного света и тепла.
Такие масла (льняное, соевое, тунговое, подсолнечное и др.) относятся к так называемым высыхающим маслам. Они входят в состав экологически чистых красок и лаков (в частности, олифы), образующих на окрашиваемой поверхности прочную пленку за счёт полимеризации по кратным связям и сопутствующих реакций сшиванияРеакции сшивания — процесс образо-вания поперечных химических связей между макромолекулами, приводящий к получению прочных полимерных мате-риалов с 3-х мерной сетчатой структурой..
Для ускорения процесса плёнкообразования в высыхающие масла вводят вспомогательные вещества — сиккативы.Сиккативы (от лат. siccativus — высушивающий) — вещества, ускоряющие пленкообразование (высыхание, отверж-дение) лакокрасочных материалов.
Обычно это соли поливалентных металлов и одноосновных монокарбоновых кислот, являющихся при действии кислородом воздуха катализаторами радикальной полимеризации остатков ненасыщенных жирных кислот в олифах, масляных лаках и красках.
Источник
