Какие химические свойства у углекислого газа

Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота

Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония

Углеаммонийная соль
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO

Оксид цинка
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
CH4 + 2O2 → CO2 + 2H2O + 891кДж

Горение газа на плите
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3H2O + 2CO2 + Q

Молекула этанола
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
8) В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2

Образование глюкозы
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород

Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Источник
Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
СО2
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Получение углекислого газа
Природные источники углекислого газа
Углекислый газ образуется при медленном окислении в процессах дыхания, брожения, гниения органических веществ. Выделяется при разложении природных карбонатов, сгорании топлива, образовании дымовых газов. Содержится в воздухе, минеральных источниках.
В сутки организм человека выделяет 1 кг СО2. В воздухе содержится 0,03% углекислого газа.
Лабораторные способы получения
В лаборатории газ можно получить взаимодействием соляной кислоты с мелом, мрамором, содой. Собирается газ методом вытеснения воздуха.
CaCO3 + 2HCl → CaCl2+ H2O + CO2,
NaHCO3+ HCl → NaCl + H2O + CO2.
Промышленные способы получения
- Обжиг известняка: CaCO3 → CaO + CO2.
- Как побочный продут разделения воздуха при получении кислорода, азота, аргона.
Свойства углекислого газа
Физические свойства
Вещество нетоксичное, негорючее.
| Свойство | Описание |
|---|---|
| Агрегатное состояние при н.у. | Газ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Температура плавления | -750оC |
| Температура кипения | -56,50оC |
| Растворимость в воде | Растворяется частично. При t +150оC в 1 литре воды может раствориться 1,7 л углекислого газа |
| Плотность | 1,977 г/л |
| Молярная масса | 44г/моль |
Вещество в твердом агрегатном состоянии называется «сухим льдом».
Высокую концентрацию диоксида углерода можно определить органолептически – во рту, на языке появляется кисловатый привкус. Повышенное содержание опасно для организма – вызывает удушье.
Химические свойства
- Качественная реакция: при взаимодействии углекислого газа с известковым молочком (гидроксидом кальция) образуется карбонат кальция – осадок белого цвета.
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
- CO2, как кислотный оксид, реагирует с водой с образованием угольной кислоты. Эта кислота – соединение нестойкое, легко распадается на углекислый газ и воду. Тип реакции – реакция соединения, обратимая.
CO2 + H2O ↔ H2CO3.
При нагревании распадается на оксид углерода(II) и воду: 2CO2 = 2CO + O2.
Взаимодействует с основными оксидами, с образованием солей:
CaO + CO2 = CaCO3; Al2O3 + 3CO2 = Al2(CO3)3.
Тип реакции – реакция соединения.
- Взаимодействует со щелочами, с образованием кислых и средних солей:
CO2 + NaOH = NaHCO3;
CO2 + 2NaOH = Na2CO3 + H2O.
Средняя соль образуется при избытке щелочи. Кислая соль образуется при отношении количеств вещества оксида и щелочи – 1:1.
- При температуре реагирует с активными металлами:
CO2 + 2Mg = C + 2MgO
Углекислый газ в основном проявляет восстановительные свойства, но при взаимодействии с активными металлами является окислителем.
- Вступает в реакции взаимодействия с простыми веществами:
CO2 + 4H2 = CH4 + 2H2O (условия протекания реакции – высокая температура, катализатор Cu2O).
Применение углекислого газа
В пищевой промышленности:
- используется при производстве минеральной воды и газированных напитков;
- как пищевая добавка (Е290), повышает сроки хранения продуктов;
- в качестве разрыхлителя придает легкость и пышность кондитерским изделиям;
- как хладогент;
- для удаления из кофе кофеина.
В авиамоделировании используется как источник энергии для двигателей; применяется в пневматическом оружии; как заправка для углекислотных огнетушителей. Используется в качестве защитной среды при сварке.
Находит углекислый газ применение и в медицине – используется для криоабляции новообразований, служит стимулятором глубокого дыхания.
В химической промышленности газ используется в синтезе химических веществ, производстве солей угольной кислоты, процессах осушки и очистки полимеров, волокон растительного и животного происхождения. Применяется для очистки сточных вод, повышает проводимость сверхчистой воды.
Примеры решения задач
Задача 1
Найти массовую долю углерода в углекислом газе.
Решение
М(СО2) = 12+2х16 = 44 г/моль.
Аr(С) = 12 г/моль.
W(С) = 12/44 = 0,27 или 27%
Ответ: массовая доля углерода в углекислом газе равна 27%.
Задача 2
Вычислить объем углекислого газа, выделившегося при взаимодействии соляной кислоты с мрамором массой 100 г.
Решение
300 г — х л
CaCO3 + 2HCl → CaCl2+ H2O + CO2
1 моль — 1 моль
100 г/моль — 22,4 л/моль
100 г — 22,4 л
х(СО2) = 300х22,4/100 = 67, 2 (л).
Ответ: Объем углекислого газа равен 67, 2 л.
Тест по теме «Углекислый газ»
Источник
Углекислый газ, свойства, получение и применение.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Углекислый газ, формула, молекула, строение, состав, вещество
Физические свойства углекислого газа. Сухой лёд
Получение углекислого газа
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа
Применение углекислого газа
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
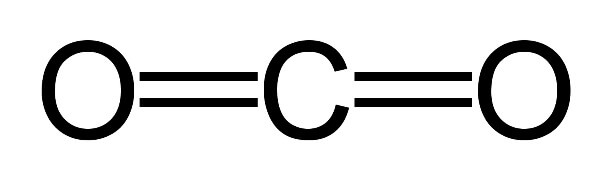
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Физические свойства углекислого газа:
| Наименование параметра: | Значение: |
| Химическая формула | CO2 |
| Синонимы и названия иностранном языке | углерода двуокись (рус.) углерода диоксид (рус.) угольный ангидрид (рус.) оксид углерода (IV) carbon dioxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветный газ |
| Цвет | бесцветный |
| Вкус | кисловатый вкус |
| Запах | почти без запаха (в больших концентрациях с кисловатым «содовым» запахом) |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), кг/м3 | 1561 |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), г/см3 | 1,561 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), кг/м3 | 1190 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), г/см3 | 1,19 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), кг/м3 | 1101 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), г/см3 | 1,101 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), кг/м3 | 925 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), г/см3 | 0,925 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,9768 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), г/см3 | 0,0019768 |
| Температура сублимации (возгонки), °C | -78,5 |
| Критическая температура*, °C | 31 |
| Критическое давление, МПа | 7,387 |
| Критический удельный объём, м3/кг | 0,468 |
| Критическая точка | 31 °C, 7,38 МПа |
| Тройная точка | −56,6 °C, 0,52 МПа |
| Молярная масса, г/моль | 44,01 |
| Растворимость в воде, г/100 г | 0,3803 при 16 °C, 0,3369 при 20 °C, 0,2515 при 30 °C |
| Теплопроводность, Вт/(м·K) | 0,0166 |
| Удельная теплоемкость, Дж/(кг·К) | 849 |
| Удельная теплота испарения, кДж/кг | 379,5 |
| Удельная теплота плавления, кДж/кг | 205 |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ), кДж/моль | -393,51 |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ), кДж/моль | -394,38 |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 213,68 |
| Стандартная мольная теплоемкость Cp (298 К, для состояния вещества – газ), Дж/(моль·K) | 37,11 |
| Энтальпия плавления ΔHпл, кДж/моль | 8,37 |
| Энтальпия возгонки ΔHвозг, кДж/моль | 25,23 |
| Скорость звука в веществе (при 20°C, состояние среды – газ), м/с | 274,6 |
| Давление паров, мм.рт.ст. | 0,000001 (при -186,4°C), 0,00001 (при -180,7°C), 0,0001 (при -174,3°C), 0,001 (при -166,8°C), 0,01 (при -158°C), 2,31 (при -130°C), 9,81 (при -120°C), 34,63 (при -110°C), 104,81 (при -100°C), 279,5 (при -90°C), 672,2 (при -80°C), 1486,1 (при -70°C), 3073,1 (при -60°C), 5127,8 (при -50°C), 7545 (при -40°C), 10718 (при -30°C), 14781 (при -20°C), 19872 (при -10°C), 26142 (при 0°C), 33763 (при 10°C), 42959 (при 20°C), 54086 (при 30°C) |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Получение углекислого газа:
В промышленности углекислый газ образуется в дымовых газах при сжигании различных органических и неорганических веществ или как побочный продукт химических процессов, например, при разложении природных карбонатов (доломита, известняка). Также углекислый газ как побочный продукт получают на установках разделения воздуха с целью получения чистого кислорода, азота и аргона.
В лабораторных условиях углекислый газ получают, например, в результате следующих химических реакций:
1. взаимодействия карбоната кальция и азотной кислоты:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O,
2. в результате взаимодействия карбоната кальция с другими минеральными кислотами,
3. взаимодействия пищевой соды с лимонной кислотой или с кислым лимонным соком,
4. реакции горения углерода:
С + O2 → CO2.
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа:
Диоксид углерода относится к кислотным оксидам, поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия оксида углерода (IV) и водорода:
CO2 + 4H2 → CH4 + 2H2O (t ~ 200 °C, kat = Cu2O).
В результате реакции образуются метан и вода.
2. реакция взаимодействия оксида углерода (IV) и углерода:
CO2 + C ⇄ 2CO (t = 700-1000 °C).
В результате реакции образуется оксид углерода (II). Реакция протекает при взаимодействии углекислого газа с раскаленными углями.
3. реакция взаимодействия оксида углерода (IV) и магния:
CO2 + 2Mg → 2MgO + C (t ~ 500 °C).
В результате реакции образуются оксид магния и углерод.
4. реакция взаимодействия оксида углерода (IV) и гафния:
Hf + CO2 → HfC + HfO2 (t = 800-1000 °C).
В результате реакции образуются карбид гафния и оксид гафния.
5. реакция взаимодействия оксида углерода (IV) и германия:
Ge + CO2 → GeO + CO (t = 700-900 °C).
В результате реакции образуются оксид германия и оксид углерода (II).
6. реакция взаимодействия оксида углерода (IV) и цинка:
Zn + CO2 → ZnO + CO (t = 800-950 °C).
В результате реакции образуются оксид цинка и оксид углерода (II).
7. реакция взаимодействия оксида углерода (IV) и индия:
2In + CO2 → In2O + CO (t ~ 850 °C).
В результате реакции образуются оксид индия и оксид углерода (II).
8. реакция взаимодействия оксида углерода (IV) и циркония:
2Zr + CO2 → ZrC + ZrO2 (t = 800-100 °C).
В результате реакции образуются карбид циркония и оксид циркония.
9. реакция взаимодействия оксида углерода (IV) и вольфрама:
W + 2CO2 → WO2 + 2CO (t ~ 1200 °C).
В результате реакции образуются оксид вольфрама и оксид углерода (II).
10. реакция взаимодействия оксида углерода (IV) и оксида лития:
Li2O + CO2 → Li2CO3.
В результате реакции образуется карбонат лития.
11. реакция взаимодействия оксида углерода (IV) и оксида натрия:
Na2O + CO2 → Na2CO3 (t = 450-550 °C).
В результате реакции образуется карбонат натрия.
12. реакция взаимодействия оксида углерода (IV) и оксида калия:
K2O + CO2 → K2CO3 (t ~ 400 °C).
В результате реакции образуется карбонат калия.
13. реакция взаимодействия оксида углерода (IV) и оксида бария:
BaO + CO2 → BaCO3.
В результате реакции образуется карбонат бария.
14. реакция взаимодействия оксида углерода (IV) и оксида кальция:
CaO + CO2 → CaCO3.
В результате реакции образуется карбонат кальция.
15. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
CaCO3 + CO2 + H2O → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция.
16. реакция взаимодействия оксида углерода (IV) и оксида магния:
MgO + CO2 → MgCO3.
В результате реакции образуется карбонат магния.
17. реакция взаимодействия оксида углерода (IV) и оксида кремния (II):
SiO + CO2 → SiO2 + CO (t ~ 500 °C).
В результате реакции образуются оксид кремния (IV) и оксид углерода (II).
18. реакция взаимодействия оксида углерода (IV) и воды:
CO2 + H2O ⇄ H2CO3.
В результате реакции образуется угольная кислота.
19. реакция взаимодействия оксида углерода (IV) и гидроксида лития:
2LiOH + CO2 → Li2CO3 + H2O.
В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития.
20. реакция взаимодействия оксида углерода (IV) и гидроксида калия:
KOH + CO2 → KHCO3,
2KOH + CO2 → K2CO3 + H2O.
В первом случае в результате реакции образуются гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция протекает в первом случае в этаноле и используется разбавленный раствор гидроксида калия, во втором используется концентрированный раствор гидроксида калия.
21. реакция взаимодействия оксида углерода (IV) и гидроксида натрия:
NaOH + CO2 → NaHCO3,
2NaOH + CO2 → Na2CO3 + H2O.
В первом случае в результате реакции образуются гидрокарбонат натрия, во втором – карбонат натрия и вода. В ходе первой реакции используется разбавленный раствор гидроксида натрия, в ходе второй – концентрированный раствор гидроксида натрия.
22. реакция взаимодействия оксида углерода (IV) и гидроксида кальция:
Ca(OH)2 + CO2 → CaCO3 + H2O.
В результате реакции образуются карбонат кальция и вода.
23. реакция взаимодействия оксида углерода (IV) и гидроксида бария:
Ba(OH)2 + CO2 → BaCO3 + H2O.
В результате реакции образуются карбонат бария и вода.
24. реакция взаимодействия оксида углерода (IV) и метана:
CH4 + CO2 → 2CO + 2H2 (t = 800-900 °C, kat = NiO, нанесенный на Al2O3).
В результате реакции образуются оксид углерода (II) и вода.
25. реакция термического разложения оксида углерода (IV):
2CO2 → 2CO + O2 (t > 2000 °C).
В результате реакции образуются оксид углерода (II) и кислород.
26. реакция фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2 (hv, kat = хлорофилл).
В результате реакции образуются глюкоза и кислород.
Применение углекислого газа:
Углекислый газ используется во многих отраслях промышленности и быту:
– как пищевая добавка Е290 в качестве разрыхлителя в пищевом производстве и консерванта в алкогольных и безалкогольных газированных напитках, а также для газирования лимонада, газированной воды и других напитков;
– в системах пожаротушения и в огнетушителях;
– для создания защитной среды при сварке металлов;
– для охлаждения, замораживания и хранения пищевых продуктов при прямом и косвенном контакте с сухим льдом;
– для сушки литейных форм;
– в качестве активной среды углекислотного лазера.
Примечание: © Фото https://www.pexels.com, https://pixabay.com.
карта сайта
Коэффициент востребованности
1 457
Источник
