Какие химические свойства проявляют алканы

Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Строение алканов
Гомологический ряд
Получение алканов
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
![]() Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н

Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
![]()
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н

2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
![]()
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
![]()
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана.
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
![]()
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:![]()
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.

Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
![]()
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
![]()
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.

Источник
Àëêàíû – íàñûùåííûå (ïðåäåëüíûå) óãëåâîäîðîäû. Ïðåäñòàâèòåëåì ýòîãî êëàññà ÿâëÿåòñÿ ìåòàí (ÑÍ4). Âñå ïîñëåäóþùèå ïðåäåëüíûå óãëåâîäîðîäû îòëè÷àþòñÿ íà ÑÍ2– ãðóïïó, êîòîðàÿ íàçûâàåòñÿ ãîìîëîãè÷åñêîé ãðóïïîé, à ñîåäèíåíèÿ – ãîìîëîãàìè.
Îáùàÿ ôîðìóëà – ÑnH2n+2.

Ñòðîåíèå àëêàíîâ.
Êàæäûé àòîì óãëåðîäà íàõîäèòñÿ â sp3 – ãèáðèäèçàöèè, îáðàçóåò 4 σ– ñâÿçè (1 Ñ-Ñ è 3 Ñ-Í). Ôîðìà ìîëåêóëû â âèäå òåòðàýäðà ñ óãëîì 109,5°.
Ñâÿçü îáðàçóåòñÿ ïîñðåäñòâîì ïåðåêðûâàíèÿ ãèáðèäíûõ îðáèòàëåé, ïðè÷åì ìàêñèìàëüíàÿ îáëàñòü ïåðåêðûâàíèÿ ëåæèò â ïðîñòðàíñòâå íà ïðÿìîé, ñîåäèíÿþùåé ÿäðà àòîìîâ. Ýòî íàèáîëåå ýôôåêòèâíîå ïåðåêðûâàíèå, ïîýòîìó σ-ñâÿçü ñ÷èòàåòñÿ íàèáîëåå ïðî÷íîé.
Èçîìåðèÿ àëêàíîâ.
Äëÿ àëêàíîâ ñâîéñòâåííà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà. Ïðåäåëüíûå ñîåäèíåíèÿ ìîãóò ïðèíèìàòü ðàçëè÷íûå ãåîìåòðè÷åñêèå ôîðìû, ñîõðàíÿÿ ïðè ýòîì óãîë ìåæäó ñâÿçÿìè. Íàïðèìåð,

Ðàçëè÷íûå ïîëîæåíèÿ óãëåðîäíîé öåïè íàçûâàþòñÿ êîíôîðìàöèÿìè.  íîðìàëüíûõ óñëîâèÿõ êîíôîðìàöèè àëêàíîâ ñâîáîäíî ïåðåõîäÿò äðóã â äðóãà ñ ïîìîùüþ âðàùåíèÿ Ñ-Ñ ñâÿçåé, ïîýòîìó èõ ÷àñòî íàçûâàþò ïîâîðîòíûìè èçîìåðàìè. Ñóùåñòâóåò 2 îñíîâíûå êîíôîðìàöèè – «çàòîðìîæåííîå» è «çàñëîíåííîå»:

Èçîìåðèÿ óãëåðîäíîãî ñêåëåòà àëêàíîâ.
Êîëè÷åñòâî èçîìåðîâ âîçðàñòàåò ñ óâåëè÷åíèåì ðîñòà óãëåðîäíîé öåïè. Íàïðèìåð ó áóòàíà èçâåñòíî 2 èçîìåðà:

Äëÿ ïåíòàíà – 3, äëÿ ãåïòàíà – 9 è ò.ä.
Åñëè ó ìîëåêóëû àëêàíà îòíÿòü îäèí ïðîòîí (àòîì âîäîðîäà), òî ïîëó÷èòñÿ ðàäèêàë:

Ôèçè÷åñêèå ñâîéñòâà àëêàíîâ.
 íîðìàëüíûõ óñëîâèÿõ – Ñ1-Ñ4 – ãàçû, Ñ5-Ñ17 – æèäêîñòè, à óãëåâîäîðîäû ñ êîëè÷åñòâîì àòîìîâ óãëåðîäà áîëüøå 18 – òâåðäûå âåùåñòâà.
Ñ ðîñòîì öåïè ïîâûøàåòñÿ òåìïåðàòóðà êèïåíèÿ è ïëàâëåíèÿ. Ðàçâåòâëåííûå àëêàíû èìåþò áîëåå íèçêèå òåìïåðàòóðû êèïåíèÿ, ÷åì íîðìàëüíûå.
Àëêàíû íåðàñòâîðèìû â âîäå, íî õîðîøî ðàñòâîðÿþòñÿ â íåïîëÿðíûõ îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ. Ëåãêî ñìåøèâàþòñÿ äðóã ñ äðóãîì.
Ïîëó÷åíèå àëêàíîâ.
Ñèíòåòè÷åñêèå ìåòîäû ïîëó÷åíèÿ àëêàíîâ:
1. Èç íåíàñûùåííûõ óãëåâîäîðîäîâ – ðåàêöèÿ «ãèäðèðîâàíèÿ» ïðîòåêàåò ïîä âîçäåéñòâèåì êàòàëèçàòîðà (íèêåëü, ïëàòèíà) è ïðè òåìïåðàòóðå:

2. Èç ãàëîãåíïðîèçâîäíûõ – ðåàêöèÿ Âþðöà: âçàèìîäåéñòâèå ìîíîãàëîãåíàêëêàíîâ ñ ìåòàëëè÷åñêèì íàòðèåì, â ðåçóëüòàòå ÷åãî ïîëó÷àþòñÿ àëêàíû ñ óäâîåííûì ÷èñëîì óãëåðîäíûõ àòîìîâ â öåïè:

3. Èç ñîëåé êàðáîíîâûõ êèñëîò. Ïðè âçàèìîäåéñòâèè ñîëè ñ ùåëî÷è, ïîëó÷àþòñÿ àëêàíû, êîòîðûå ñîäåðæàò íà 1 àòîì óãëåðîä ìåíüøå ïî ñðàâíåíèþ ñ èñõîäíîé êàðáîíîâîé êèñëîòîé:

4. Ïîëó÷åíèå ìåòàíà.  ýëåêòðè÷åñêîé äóãå â àòìîñôåðå âîäîðîäà:
Ñ + 2Í2 = ÑÍ4.
 ëàáîðàòîðèè ìåòàí ïîëó÷àþò òàê:
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3.
Õèìè÷åñêèå ñâîéñòâà àëêàíîâ.
 íîðìàëüíûõ óñëîâèÿõ àëêàíû – õèìè÷åñêè èíåðòíûå ñîåäèíåíèÿ, îíè íå ðåàãèðóþò ñ êîíöåíòðèðîâàííîé ñåðíîé è àçîòíîé êèñëîòîé, ñ êîíöåíòðèðîâàííîé ùåëî÷üþ, ñ ïåðìàíãàíàòîì êàëèÿ.
Óñòîé÷èâîñòü îáúÿñíÿåòñÿ ïðî÷íîñòüþ ñâÿçåé è èõ íåïîëÿðíîñòüþ.
Ñîåäèíåíèÿ íå ñêëîííû ê ðåàêöèÿõ ðàçðûâà ñâÿçè (ðåàêöèÿ ïðèñîåäèíåíèÿ), äëÿ íèõ ñâîéñòâåííî çàìåùåíèå.
1. Ãàëîãåíèðîâàíèå àëêàíîâ. Ïîä âîçäåéñòâèåì êâàíòà ñâåòà íà÷èíàåòñÿ ðàäèêàëüíîå çàìåùåíèå (õëîðèðîâàíèå) àëêàíà. Îáùàÿ ñõåìà:

Ðåàêöèÿ èäåò ïî öåïíîìó ìåõàíèçìó, â êîòîðîé ðàçëè÷àþò:
À) Èíèöèèðîâàíèå öåïè:

Á) Ðîñò öåïè:

Â) Îáðûâ öåïè:

Ñóììàðíî ìîæíî ïðåäñòàâèòü â âèäå:

2. Íèòðîâàíèå (ðåàêöèÿ Êîíîâàëîâà) àëêàíîâ. Ðåàêöèÿ ïðîòåêàåò ïðè 140 °Ñ:

Ëåã÷å âñåãî ðåàêöèÿ ïðîòåêàåò ñ òðåòèòè÷íûì àòîìîì óãëåðîäà, ÷åì ñ ïåðâè÷íûì è âòîðè÷íûì.
3. Èçîìðèçàöèÿ àëêàíîâ. Ïðè êîíêðåòíûõ óñëîâèÿõ àëêàíû íîðìàëüíîãî ñòðîåíèÿ ìîãóò ïðåâðàùàòüñÿ â ðàçâåòâëåííûå:

4. Êðåêèíã àëêàíîâ. Ïðè äåéñâèè âûñîêèõ òåìïåðàòóð è êàòàëèçàòîðîâ âûñøèå àëêàíû ìîãóò ðâàòü ñâîè ñâÿçè, îáðàçóÿ àëêåíû è àëêàíû áîëåå íèçøèå:

5. Îêèñëåíèå àëêàíîâ.  ðàçëè÷íûõ óñëîâèÿõ è ïðè ðàçíûõ êàòàëèçàòîðàõ îêèñëåíèå àëêàíà ìîæåò ïðèâåñòè ê îáðàçîâàíèþ ñïèðòà, àëüäåãèäà (êåòîíà) è óêñóñíîé êèñëîòû.  óñëîâèÿõ ïîëíîãî îêèñëåíèÿ ðåàêöèÿ ïðîòåêàåò äî êîíöà – äî îáðàçîâàíèÿ âîäû è óãëåêèñëîãî ãàçà:


Ïðèìåíåíèå àëêàíîâ.
Àëêàíû íàøëè øèðîêîå ïðèìåíåíèå â ïðîìûøëåííîñòè, â ñèíòåçå íåôòè, òîïëèâà è ò.ä.
Источник
1. Реакции замещения.
а)
Галогенирование
при действии
света – hν или нагревании (стадийно – замещение атомов
водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик,
академик, лауреат Нобелевской премии Н. Н. Семёнов )
В
реакции образуются вещества галогеналканы
RГ или
СnH2n+1Г
(Г – это галогены F, Cl, Br, I)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
;
метан хлорметан CH3Cl + Cl2 hν → CH2Cl2 + HCl
(2 стадия);
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
тетрахлорметан
Скорость реакции замещения водорода на атом галогена у
галогеналканов выше, чем у соответствующего алкана, это связано с взаимным
влиянием атомов в молекуле:


Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в
результате на нём скапливается частичный отрицательный заряд, а на атоме
углерода – частичный положительный заряд.
На атом углерода в метильной группе ( – СН3) создаётся
дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт
соседних атомов водорода, в результате
связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы
хлора. При увеличении углеводородного радикала наиболее подвижными остаются
атомы водорода у атома углерода ближайщего к заместителю:
CH3 –
CH2 –
Cl + Cl2hν
→ CH3 – CHCl2 + HCl
хлорэтан 1,1 -дихлорэтан
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для
удаления HI из рекции.
Внимание!
В
реакциях замещения алканов легче всего замещаются атомы водорода у третичных
атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не
соблюдается при T>400˚C.
б)
Нитрование
(реакция
М.И. Коновалова, он провёл её впервые в 1888 г)
CH4 + HNO3(раствор) t˚С→ CH3NO2
+ H2O
нитрометан
RNO2илиСn H2n+1 NO2 (нитроалкан)
2. Реакции отщепления (дегидрирование)
а) CnH2n+2 t˚С, Ni или Pd → CnH2n
+ H2
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
2CH4 1500°С → C2H2 + 3H2
3. Реакции перегруппировки (изомеризация)
н-алкан AlCl3, t°С →
изоалкан
4. Реакции горения (горят светлым не коптящим
пламенем)
CnH2n+2 + O2 t°С → nCO2 + (n+1)H2O
Помните!
Смесь метана с воздухом и кислородом взрывоопасна
V(CH4)
: V(O2)
= 1: 2
V(CH4)
: V(воздуха) = 1 : 10
5. Реакции разложения
а)
Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
C10H22 t°С → C5H12 + C5H10
алкан алкен
б)
Пиролиз при температуре 1000°С разрываются все связи,
продукты
– С и Н2:
СH4 1000°С → C + 2H2
в)
Конверсия метана с образованием синтез –
газа (СО + Н2)
CH4 + H2O 800˚C, Ni → СО + 3Н2
Видео:
Горениепарафина в условиях избытка и недостатка кислорода
Горение
метана и изучение его физических свойств
Горениежидких углеводородов
Горение твердых углеводородов (напримере парафина)
Установление качественного составапредельных углеводородов
Определение содержания хлора ворганических соединениях
Отношение метана к растворуперманганата калия и бромной воде
Взрыв метана с кислородом
Источник
Алканы – соединения гомологического ряда метана. Это насыщенные нециклические углеводороды. Химические свойства алканов зависят от строения молекулы и физического состояния веществ.

Строение алканов
Молекула алкана состоит из атомов углерода и водорода, которые образуют метиленовые (-CH2-) и метильные (-CH3) группы. Углерод может создавать четыре ковалентные неполярные связи с соседними атомами. Именно наличие прочных σ-связей -С-С- и -С-Н обуславливает инертность гомологического ряда алканов.
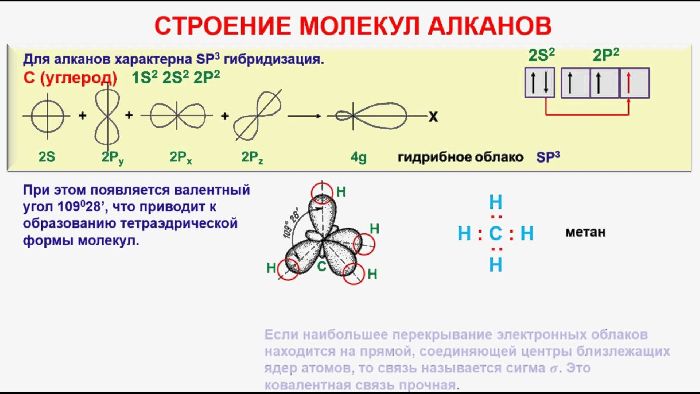
Рис. 1. Строение молекулы алкана.
Соединения реагируют на свету или при нагревании. Реакции протекают по цепному (свободно-радикальному) механизму. Таким образом, связи способны расщепляться только под действием свободных радикалов. В результате замещения водорода образуются галогеналканы, соли, циклоалканы.
Алканы относятся к предельным или насыщенным углеродам. Это значит, что молекулы содержат максимальное количество атомов водорода. Из-за отсутствия свободных связей реакции присоединения для алканов не характерны.
Химические свойства
Общие свойства алканов приведены в таблице.
Типы химических реакций | Описание | Уравнение |
Галогенирование | Реагируют с F2, Cl2, Br2. Реакция с йодом не идёт. Галогены замещают атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°C. В результате образуются галогеналканы | CH4 + Cl2 → CH3Cl + HCl |
Нитрование (реакция Коновалова) | Взаимодействие с разбавленной азотной кислотой при температуре 140°C. Атом водорода замещается нитрогруппой NO2. В результате образуются нитроалканы | CH3-CH3 +HNO3 → CH3-CH2-NO2 + H2O |
Сульфохлорирование | Сопровождается окислением с образованием алкансульфонилхлоридов | R-H + SO2 + Cl2 → R-SO3Cl + HCl |
Сульфоокисление | Образование алкансульфоновых кислот в избытке кислорода. Атом водорода замещается группой SO3H | C5H10 + HOSO3H → C5H11SO3H + H2O |
Крекинг | Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей С-С образуются алканы и алкены | C4H10 → C2H6 + C2H4 |
Горение | В избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа, сажи | – CH4 + 2O2 → CO2 + 2H2O; – 2CH4 + 3O2 → 2CO + 4H2O |
Каталитическое окисление | Происходит частичное окисление алканов при небольшой температуре и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты | C4H10 → 2CH3COOH + H2O |
Дегидрирование | Отщепление водорода в результате разрыва связей С-Н в присутствии катализатора (платины, оксида алюминия, оксида хрома) при температуре 400-600°С. Образуются алкены | C2H6 → C2H4 + H2 |
Ароматизация | Реакция дегидрирования с образованием циклоалканов | C6H14 → C6H6 + 4H2 |
Изомеризация | Образование изомеров под действием температуры и катализаторов | C5H12 → CH3-CH(CH3)-CH2-CH3 |
Чтобы понимать, как проходит реакция и какие радикалы замещаются, рекомендуется записывать структурные формулы.
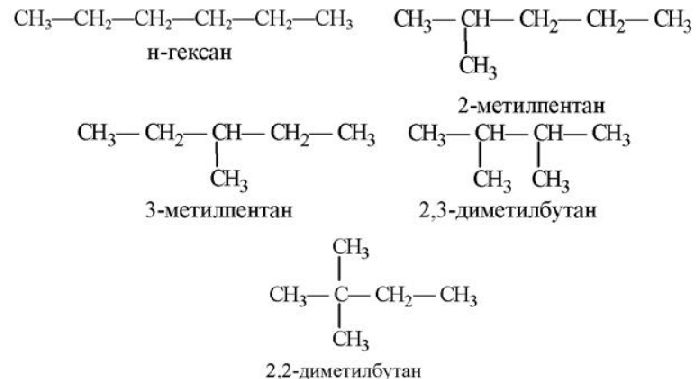
Рис. 2. Структурные формулы.
Применение
Алканы широко применяются в промышленной химии, косметологии, строительстве. Из соединений изготавливают:
- топливо (бензин, керосин);
- асфальт;
- смазочные масла;
- вазелин;
- парафин;
- мыло;
- лаки;
- краски;
- эмали;
- спирты;
- синтетические ткани;
- каучук;
- адьдегиды;
- пластмассы;
- моющие средства;
- кислоты;
- пропелленты;
- косметические средства.

Рис. 3. Продукция, получаемая из алканов.
Что мы узнали?
Узнали о химических свойствах и применении алканов. Из-за прочных ковалентных связей между атомами углерода, а также между атомами углерода и водорода, алканы проявляют инертность. Возможны реакции замещения и разложения в присутствии катализатора при высоких температурах. Алканы – предельные углеводороды, поэтому реакции присоединения невозможны. Алканы используются для производства материалов, моющих средств, органических соединений.
Тест по теме
Оценка доклада
Средняя оценка: 4.1. Всего получено оценок: 322.
Источник
