Какие химические свойства можно предположить у вещества
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Это интересно: Химические свойства кислорода
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Источник
«Вещества и их свойства. Чистые вещества и смеси»
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
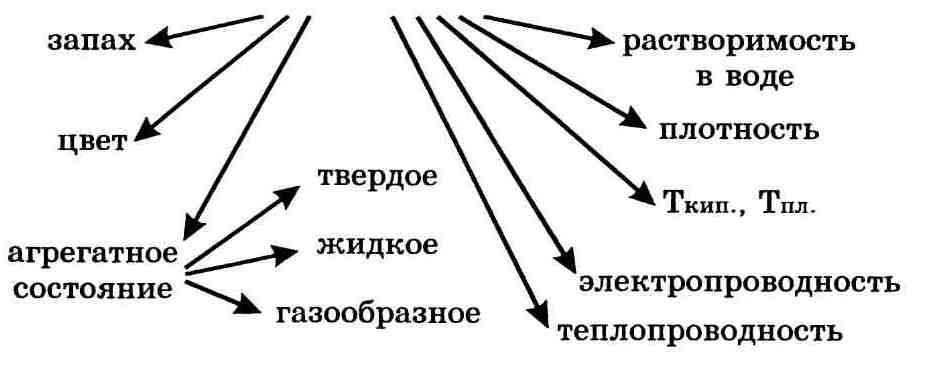
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
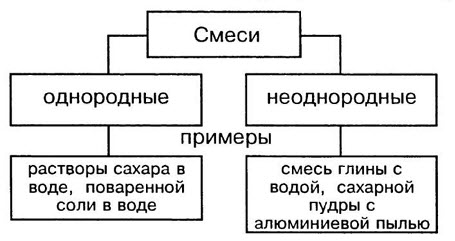
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.

Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
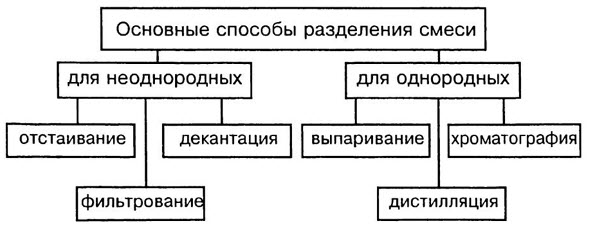
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Следующая тема: «Физические и химические явления».
Источник
Химия, 10 класс
Урок № 1. Предмет органической химии. Теория химического строения органических веществ
Перечень вопросов, рассматриваемых в теме: урок посвящён общим вопросам органической химии и органических веществ: предмет органической химии, особенностям и признакам органических веществ, теории строения органических веществ.
Глоссарий
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся друг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Графическая формула – формула вещества, в которой указывается последовательность расположения атомов в молекуле с помощью, так называемой валентной черты, или валентного штриха.
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Молекулярная формула – формула, которая показывает, из каких химических элементов состоит молекула вещества (качественный состав) и сколько атомов каждого элемента образуют молекулу данного вещества (количественный состав).
Органическая химия – химия углеводородов и их производных, т.е. продуктов, образующихся при замене водорода в молекулах этих веществ другими атомами или группами атомов, или химия углерода и его соединений.
Структурная формула – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками. Например, структурные формулы: СН3-СН2-СН2-СН3 бутан.
Углеродный скелет – каркас органической молекулы, который представляет собой последовательность химически связанных между собой атомов углерода.
Химическое строение – порядок соединения атомов в молекуле, их взаимное расположение в пространстве.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: https://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Ученые-химики изначально делили известные вещества на минеральные, животные и растительные, используя признак классификации – источник их получения. В дальнейшем вещества делят на две группы неорганические и органические. Признаком классификации послужило наличие в веществах атомов химического элемента углерода. Конечно, чёткой границы между органическими и неорганическими веществами нет и данная классификация условна, так как некоторые неорганические вещества обладают признаками органических веществ и могут превращаются в органические в одну стадию (карбиды, угарный газ и другие). Но и объединить в единую группу все вещества невозможно, так как органические вещества значительно отличаются от неорганических веществ. Органические вещества имеют общие признаки, которые отличают их от неорганических веществ:
наличие в составе молекулы атомов углерода; большинство способны гореть и (или) разлагаться с образованием углеродсодержащих продуктов; наличие в молекуле только ковалентных связей; непосредственное соединение углерода с атомами других элементов; валентность углерода равна IV. Йенс Якобс Берцелиус – шведский химик придерживался виталистической теории и определил органическую химию как химию растительных или животных веществ, образующихся под влиянием «жизненной силы» – vis vitalis; в 1806 году ввел понятия «органическая химия» и «органические вещества». Классическое определение понятия «органическая химия» была сформулировано немецким химиком в 1889 г. Карлом Шорлеммером (1834 – 1892): «Органическая химия есть химия углеводородов и их производных». В настоящее время органическую химию называют химией углерода и его соединений. Согласно схеме «Классификация веществ» неорганических веществ насчитывается около 700 тыс., а органических веществ – около 40 млн. Почему количество органических веществ превышает количество неорганических веществ. Причин многообразия органических веществ несколько: атомы углерода, соединяясь друг с другом, могут образовать цепи разной длины (от 1 до 100 атомов), разной формы (линейные, циклические, разветвленные); углерод может образовывать простые, двойные, тройные связи; углерод может соединяться с различными элементами; существование изомеров и гомологов. Изомерия – явление существования разных веществ-изомеров, имеющих одинаковый количественный и качественный состав, но разное строение и потому разные свойства. Например:молекулярной формулеC2H6O соответствуют два вещества: CH3-CH2-OHэтиловый спирт – жидкость, tкип = 78,4 Сº, хорошо растворим в воде, взаимодействует со щелочными металлами; CH3-O-CH3 диметиловый эфир – газ, –tкип = –24 Сº, нерастворим в воде, не взаимодействует со щелочными металлами. Гомологический ряд – это ряд соединений, сходных по строению и свойствам и расположенных в порядке увеличения их относительных молекулярных масс. Гомологи – это вещества, имеющие сходное строение и отличающиеся друг от друга на одну или несколько групп –СН2 – гомологическую разность. Например: Гомологический ряд метана с общей формулой CnH2n+2: CH4 метан; C2H6 этан; C3H8 пропан; C4H10 бутан и т.д.
Основой каждой науки является теория. Для органической химии такой теорией служит теория строения органических веществ Александра Михайловича Бутлерова. Предпосылками появления теории являются:
1. Накопление большого количества теоретического и практического материала об органических веществах и их свойствах;
2. Ученые не могли объяснить множество противоречий в известном фактическом материале (например, многообразие органических веществ и существование изомеров);
3. Работы предшественников А.М.Бутлерова и его собственная работа как талантливого исследователя и ученого.
Таблица 1. История развития органической химии.
Ученый | Год | Вклад в науку |
Йенс Якобс Берцелиус | 1806 | ввел понятия «органическая химия» и «органические вещества» |
Фридрих Вёллер | 1824 | синтезирована щавелевая кислота |
1828 | показал, что неорганическое вещество – циановокислый аммоний – при нагревании превращается в продукт жизнедеятельности животного организма – мочевину | |
Карлом Шорлеммером | 1889 | сформулировал классическое определение понятия «органическая химия» («Органическая химия есть химия углеводородов и их производных») |
Николай Николаевич Зинин | 1842 | синтезировал анилин |
Адольф Вильгельм Герман Кольбе | 1845 | синтезировал органическое вещество-уксусную кислоту, в качестве исходных веществ он использовал древесный уголь, серу, хлор и воду |
1847 | были синтезированы и другие органические кислоты, которые раньше выделялись только из растений | |
Пьер Эжен Марселен Бертло | 1854 | удалось синтезировать вещества, относящиеся к классу спиртов |
Александр Михайлович Бутлеров | 1861 | синтезировал сахаристые вещества |
Обобщив все имеющиеся знания о строении органических веществ в середине 19 века, а также на основании своих исследований и умозаключений Александр Михайлович Бутлеров (1828–1886) разработал правильную материальную теорию о строении органических веществ.19 сентября 1861 года на съезде немецких естествоиспытателей и врачей в городе Шпейере русский химик-органик А. М. Бутлеров выступил с докладом «О химическом строении веществ», где представил свою теорию строения органических веществ, выдвинул новое понятие – структура соединения, которое отражало последовательность соединения атомов в молекуле, а изображать структуру соединений предложил с помощью черточек. Кратко теорию строения органических веществ можно сформулировать с помощью основных положений:
1 положение – атомы в молекулах соединяются в определенной последовательности согласно их валентности; строение вещества можно выразить структурной формулой.
2 положение – химические свойства веществ определяются не только качественным и количественным составом, но и химическим строением (структурой) вещества.
3 положение – по строению органического вещества можно предположить химические свойства.
4 положение – атомы или группы атомов в молекулах взаимно влияют друг на друга непосредственно или через другие атомы. Например: В молекуле толуола (метилбензола) заместители I рода – доноры электронов, поэтому ориентируют (направляют) реакцию в мета- и пара-положение (-СН3, -ОН, -Hal, -NH2) как показано в следующей формуле.

Очень велико значение теории строения органических веществ, которая смогла: объяснить противоречия в знаниях об окружающем мире; обобщить достижения в области химии и представить качественно новый подход к пониманию строения и свойств веществ; определить возможные направления получения принципиально новых веществ, необходимых для жизни людей: лекарственных средств, синтетических красителей, полимеров, пластмасс, взрывчатых и других соединений с заданными свойствами. Теория строения органических веществ А.М.Бутлерова является актуальной и на современном этапе развития химии. Дальнейшее развитие она получила в двух направлениях – стереохимия (учение о пространственном строении молекул) и учение об электронном строении атомов.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи о свойствах органических веществ.
Задача. Вычислите объём водорода, который можно получить при полном разложении 250 л метана, если объемная доля выхода водорода равна 60 %. Объемы газов измерены при одинаковых условиях. Ответ укажите в литрах с точностью до целых.
Решение. 1. Запишем уравнение реакции.СН4 → C + 2H2
2. Рассчитаем теоретический объём (л) водорода.
250 л Vт-?
СН4 → C + 2H2
1 моль 2 моль
3. Объемные отношения газов по уравнению 1:2, следовательно по закону объемных отношений газов при одинаковых условиях V(H2)= 2V(СН4); Vт(H2)=2х250 л =500 л
4. Рассчитаем практический объём (л) водорода от теоретически возможного. Vпр(H2)= Vт(H2)хφ/100%; Vпр(H2)= 500лх60%/100%=300 л.
Ответ: Vпр(H2)=300 л.
- Определение формулы органического вещества по его плотности при н.у.
Задача.Выведите формулу алкина, если его плотность равна 1, 786 г/л (при н.у.). Постройте его структурную формулу.
Решение.1. Рассчитываем относительную молекулярную массу алкина:M (алкина) = 22,4 л/моль х 1, 786 г/л = 40 г/моль
2. Алкины имеют общую формулу CnH2n-2.
3. Выразим Mr (алкина) в общем виде:
Mr (алкина) = 12n + 2n – 2 = 14n – 2
4.Составим уравнение: 14n – 2 = 40; n = 3
5. Составление молекулярной формулы алкина C3H4 и его структурную формулуCH = C – CH3.
Ответ: молекулярной формулы алкина C3H4; структурную формулуCH = C – CH3.
Источник
