Какие химические свойства характерны для воды

Nurjan Isaeva
11 мая · 1,5 K
Автор вопроса считает этот ответ лучшим
На сайте https://tvoiklas.ru/ представлены уроки географии, биологии и истории на… · tvoiklas.ru
- Химические:
а) реагирует со многими металлами с выделением кислорода;
б) разлагается на кислород и водород при действии электрического тока;
в) реагирует со многими оксидами неметаллов;
г) реагирует с некоторыми оксидами металлов.
- Физические:
а) высокая теплопроводность (теплоёмкость) и низкая теплоотдача;
б) несжимаемость;
в) способность к поверхностному натяжению;
г) жидкость без цвета, вкуса и запаха;
д) сцепление – водородные связи удерживают молекулы воды вместе;
е) высокая удельная температура парообразования и конденсации;
ж) способность растворять многие вещества;
з) гидроксид водорода может находиться в трёх состояниях: в жидком – вода, парообразном – водяной пар и твёрдом – лёд. При этом лёд имеет более низкую плотность;
и) при замерзании расширяется и т.д.
- Биологические
а) сохраняет объём и тургор клеток и тканей;
б) обеспечивает
охлаждение благодаря испарению с поверхности тела,
- доставку питательных веществ и кислорода ко всем клеткам тела,
- буферизацию (поддержание кислотности) внутренней среды,
- регуляцию температуры тела,
- преобразование пищи в энергию,
- усвоение питательных веществ клетками,
- вывод шлаков и отходов, появившиеся в процессе жизнедеятельности и целый ряд других функций.
Биологически вода это жизнь!!! Без воды и не туды и не сюды)) у воды много не обьяснимых функций, как она достигает самых верхних листьев дерева ведь у деревьев нет насосов))
Физические свойства воды: лед, вода, пар, ещё есть 4-ое но я не знаю вода бывает в виде плазмы, может это молния, при раскатах молнии вода делится на водород, и озон,
Химические свойства воды: растворяет практически любой состав, даже вода налитая в стакан, растворяет стекло но очень медленно, при взаимодействии с металлами вступает в реакцию и вызывает ВОДОРОД,
Почему когда происходит кораблекрушение, люди прыгают в воду и потом тонут?
мои ответы не являются “глубокомысленными” статьями для ЯДзен. пользователь…
Во-первых, сложно тем, что психически далеко не все подготовлены. Одно дело плавать в бассейне или у берега моря, другое дело в ситуации паники.
Во-вторых, вы не учитываете принципиально важное. Вода отличный проводник тепла и когда ее температура ниже ваших 36 она будет вас охлаждать:
Я не знаю как считают, но гугл дает для Тихого океана, например, температуру среднюю 15 градусов.
А, например, во время крушения Титаника температура воды составляла минус 2 градуса. Как такое может быть? Да просто соленая вода замерзает ниже нуля и как раз -2 порог замерзания.
Прочитать ещё 62 ответа
Каким свойством обладает чистая вода?
Вода является прозрачной, безвкусной жидкостью, которая не имеет никакого запаха, но при этом основные её характеристики поистине поразительны:
показатель молекулярной массы равен 18,0160;
уровень плотности — 1 г/см³;
вода является уникальным растворителем: она окисляет практически все известные виды металла и способна разрушить любую твёрдую горную породу;
сферическая капля воды отличается наименьшей (оптимальной) поверхностью объёма;
коэффициент поверхностного натяжения равен 72,75*10‾³Н/м;
вода превосходит большинство веществ по степени удельной теплоёмкости;
удивительно и то, что вода способна поглощать огромное количество тепла и при этом сама очень мало нагревается;
вода отличается и полимеризационными способностями. В таком случае свойства её становятся несколько иными, например, кипение полимеризованной воды происходит при более высоких температурах (порядка 6–7 раз выше), чем обычной.
Наш организм в основном состоит из воды. Эмбрион человека на 97% составляет вода. У новорожденного на долю воды приходится около 80% от массы тела. Наиболее интенсивно он теряет жидкость в первые дни жизни — происходит физиологическая убыль массы тела (5-7 %).
С годами количество воды в организме постоянно уменьшается. У детей в возрасте до 5 лет содержание воды в организме составляет уже около 70% от массы тела. К тому времени, когда мы достигаем 50-60-летнего возраста, наше тело содержит не более 50-60% воды.
Все мы знаем, какая эластичная и мягкая кожа у младенцев. Они изгибаются и скручиваются, оставаясь пухлыми, как наполненный водой шарик. Степень гибкости, свойственная младенцам и маленьким детям, к сожалению, с возрастом снижается.
Содержание воды в разных тканях варьирует от 20% в жировой ткани до 83-90% в почках и крови, у женщин в связи с большим количеством жировой клетчатки содержание воды ниже, чем у мужчин. Наш мозг представляет собой влажную субстанцию и состоит из воды на 85%, слюна из неё состоит на 99%, мышцы на 60%. Особенно много воды в крови — до 90%, а стекловидное тел глаза содержит ее даже 96-99%. В костях 20% воды и около 10% в верхних слоях кожи.
Именно благодаря воде обеспечивается тонкое регулирование всех процессов в организме. Вода регулирует массу и температуру нашего тела, разносит питательные вещества к клеткам и выводит шлаки и продукты распада из организма, защищает внутренние органы, участвует в процессе дыхания, растворяет минеральные соли, помогает организму усваивать питательные вещества и преобразовывать пищу в энергию.
Водный обмен регулируется жаждой, метаболизмом, ведущим к образованию воды вследствие процессов окисления, кислотно-щелочным балансом (ацидоз увеличивает диурез, алкалоз — уменьшает), а также функциональным состоянием почек, играющих решающую роль в водном обмене. Резкие сдвиги водного баланса как в сторону гипо-, так и гипергидратации неблагоприятно отражаются на общем состоянии организма человека. При этом избыток воды переносится легче, чем ее недостаток. При понижении содержания воды в организме всего на 2% человек чувствует усталость. Если оно понизится на 8%, следует ожидать серьезных проблем со здоровьем, а на 12% — вероятна остановка сердца. Попробуйте чистую воду тут: https://257267.ru/product/voda-pitevaya-admiral/
Прочитать ещё 1 ответ
Из чего состоит морская вода?
ООО “НПК “Диасел” – Профессиональная очистка воды · diasel.ru
Морская вода – это вода с высоким содержанием солей, средняя соленность мирового океана порядка 35 г/л. Главным образом, солесодержание морской воды связанос с наличие ионов натрия и хлора (хлоридов).
У разных морей и океанов различное содержание солей. Самым соленым является Мертвое море (350 г/л). Наименее соленым является Балтийское море (от 2 до 8 г/л).
Также в морской воде есть сульфаты, хлориды, калий, магний, нитраты, кальций, карьонаты и другие ионы. В малых количествах в морской воде присутсвует практически вся таблица Менделеева.
Прочитать ещё 1 ответ
Какова роль воды на нашей планете?
Всем трям, то есть здравствуйте. 🙂 Я по жизни оптимист, натуралист, огородник-г…
Вода на нашей планете играет огромную роль. Вода – источник жизни, главный компонент всех организмов и ни одно живое существо не может прожить без воды. Также вода участвует в создании самой земли – поверзность нашей планеты на 70% состоит из воды, благодаря мировому запасу воды формируются материки, она влияет на климат, благодаря воде существуют растения, атмосфера вокруг земли тоже образовалась в том числе благодаря воде.
Прочитать ещё 2 ответа
Почему человек тонет в воде?
Утопление происходит по разным причинам. Часто люди тонут, пренебрегая элементарными мерами предосторожности (не заплывать за буйки, не купаться в нетрезвом виде, не купаться в сомнительных водоёмах, не купаться в шторм).
Эффект поплавка
1. Человек чувствует, что тонет. А может быть, ему это только кажется.
2. Он пугается и старается высунуться из воды как можно выше.
3. Архимедова сила, поддерживающая его тело, уменьшается. Поэтому он глубже погружается в воду.
4. Затем архимедова сила возрастает и выталкивает его тело наверх. Снова повторяется пункт 3. И т.д.
5. Возникает процесс раскачивания верх–вниз, который развивается стремительно. А человек от всех этих качаний ещё больше пугается.
6. Человек не успевает вдыхать воздух, тем более что когда его лицо над водой, по лицу ручьями стекает вода. Поэтому он не в состоянии нормально дышать, кричать или звать на помощь.
7. Человек захлёбывается и идёт ко дну.
Со стороны это действительно выглядит как поплавок. Всё происходит бесшумно и очень быстро, за два десятка секунд.
Так, что будьте бдительны и осторожны!
Прочитать ещё 2 ответа
Источник
Благодаря своим уникальным физическим и химическим
свойствам, часто аномальным, вода сделала возможной жизнь на Земле. Так в чем
состоят эти уникальные характеристики?
Физические свойства воды
Вода имеет высокую удельную теплоемкость, т.е. ей нужно
много тепла, чтобы нагреться, и потребуется много времени, чтобы потерять
накопленное тепло и остыть. Вот почему она используется в системах охлаждения
(например, в автомобильных радиаторах или для охлаждения промышленного
оборудования). Эта характеристика объясняет также то, почему в прибрежных (или
озерных) регионах температура воздуха мягче: в этих местах, когда времена года
меняются, температура воды «смягчает» температуру воздуха, так как она уменьшается
или увеличивается медленнее.

При ответе на вопрос: какие физические свойства воды
определяют ее особое биологическое значение, первым делом нужно вспомнить, что
она имеет высокое поверхностное натяжение. Это означает, что после наливания на
гладкую поверхность она имеет тенденцию образовывать сферические капли, а не
растекаться в тонкую пленку. И это свойство во многом объясняет высокую
биологическую активность воды. Без гравитации капля ее была бы совершенно
сферической. Поверхностное натяжение позволяет растениям поглощать воду,
содержащуюся в почве, через корни. И поверхностное натяжение делает кровь такой
«проникающей» через ткани нашего организма.
Вода обычно находится в жидком состоянии, но может легко
стать твердой или газообразной. Чистая вода переходит из жидкой в твердую, то
есть замерзает при 0° С, а на уровне моря она кипит при 100 ° С (чем выше
уровень, тем ниже температура, при которой вода начинает кипеть). Значения
кипения и замерзания воды берут в качестве контрольной точки для калибровки
термометров: в градусах Цельсия 0 ° по шкале Цельсия — это точка замерзания, а
100 ° — это точка кипения.
При замерзании вода расширяется, то есть ее плотность
уменьшается, а объем остается неизменным: поэтому лед плывет по поверхности или
лопается бутылка, наполненная водой и помещенная в морозильник.

Вода является особым природным ресурсом, поскольку она
является единственным на Земле веществом, которое можно найти во всех трех
физических состояниях в зависимости от температуры окружающей среды: жидкой,
твердой (лед) и газообразной (пар).
Химические свойства воды
Химическая формула молекулы воды — H2O: два атома водорода
(H2) связаны с одним атомом кислорода (O). Электроны атома (частицы с
отрицательным зарядом) устанавливают связи между собой. Кислород способен
держать их ближе к нему, чем водород. Молекула эта оказывается заряженной
отрицательно вблизи атома кислорода и положительно вблизи атомов водорода.
Поскольку противоположности притягиваются, молекулы воды имеют тенденцию
соединяться вместе, как магниты.
Вода может растворять многие вещества
Воду называют универсальным растворителем, поскольку она
может растворять больше веществ, чем любая другая жидкость. И нам очень с этим
повезло: если бы не это химическое свойство, мы не могли бы выпить чашку
горячего подслащенного чая, потому что сахар остался бы на дне чашки. Вот
почему воды рек, ручьев, озер, морей и океанов, которые выглядят чистыми на
первый взгляд, на самом деле содержат огромное количество растворенных
элементов и минералов, выделяемых камнями или атмосферой.
Везде, где течет вода, над землей, под землей или внутри
нашего тела, вода растворяет в себе и несет чрезвычайно большое количество
различных веществ. Таким образом, она выполняет драгоценную задачу: переносить
иногда на большие расстояния вещества, с которыми она сталкивается на своем
пути. Причем, с водой при обычных климатических условиях не реагирует
большинство этих веществ.

Чистая вода, как и дистиллированная вода, имеет рН 7
(средний). Морская вода в основном щелочная, имеет рН около 8. Чистая вода
реагирует с немногими веществами, например, серой, некоторыми солями и
металлами. Также возможен гидролиз (распад) воды при реакции с какими-то
химическими веществами.
Вода может содержать огромное количество взвешенных частиц
разных веществ, в т.ч. и радиоактивных. Именно этим и объясняется превращение
чистой воды в радиоактивную. И в наш век вездесущей атомной энергетики глубокая
и своевременная дезактивация воды – уже глобальная проблема.
Физико-химические свойства воды
То, какими свойствами обладает чистая вода, во многих
случаях зависит от водородных связей внутри ее молекул. При сравнении этих
свойств со свойствами атомов или не связанных с водородом молекулярных
жидкостей с аналогичными размерами молекул некоторые особенности воды
заслуживают внимания:
- Точка плавления льда исключительно высока среди гидридов шестой основной группы.
- Во время таяния льда при атмосферном давлении объем вещества уменьшается на 8,2%. Это аномальное сокращение объема, ведь большинство веществ расширяется во время плавления. Снижению температуры замерзания способствует увеличение давления.
- Зависимость молярного объема жидкой воды от давления и температуры показывает крайности. Плотность жидкой воды имеет максимум при 3,98 ° С.
- Коэффициент теплового расширения α жидкой воды на порядок меньше по сравнению с другими молекулярными жидкостями. Изотермическая сжимаемость χT показывает, что для молекулярной жидкости вода довольно несжимаема.
- Динамическая вязкость воды выше, чем у сопоставимых, не связанных водородом жидкостей. Более того, зависимость вязкости от давления аномальна: вязкость уменьшается с давлением и достигает минимума около 60 МПа (это давление эквивалентно толще воды в 6 км).
- Поверхностное натяжение воды выше, чем у других жидкостей, включая большинство других жидкостей, связанных водородом. В диапазоне температур от 0 до 130°С вода жидкая.
- Теплопроводность увеличивается с ростом температуры. Жидкая вода обладает высокой удельной теплоемкостью при постоянном давлении, которое изменяется незначительно до 100°C.
- Энтальпия испарения воды аномально высока. Аналогично удельной теплоемкости, она почти в четыре раза выше, чем для других сопоставимых жидкостей, не связанных с водородом. Эта разница приписывается водородной связи. Кроме того, энтальпия испарения воды очень велика по сравнению с энтальпией таяния.
Тот факт, что вода увеличивается в объеме при замерзании,
приводит ко многим последствиям в природе. Именно вода и ее свойство легко
проникать в расщелины скал, когда она замерзает, приводит к разрушению скал.
Постепенно происходит физическое и химическое выветривание скальных пород. И, в
конечном итоге, физические свойства и химические функции воды сформировали
почву на нашей планете.
Тот факт, что вода имеет самую высокую плотность при 4°С, а
не в точке замерзания, имеет важное значение для термического расслоения и
циркуляции воды в природе. Это химико-физическое свойство воды приводит к
замерзанию водоемов от их поверхности в направлении дна. Это важно не только
для жизни внутренних водоемов, но и для океанов. Если бы самые холодные районы
океанов должны были замерзать снизу-вверх, то солнечной энергии, полученной за
время лета, было бы достаточно только для оттаивания самого верхнего слоя. Так
осуществляется круговорот энергии и материи, которая опирается на циркуляции
океанов частично или даже полностью.
Огромная удельная теплоемкость воды ответственна за его
способность хранить огромное количество энергии. Таким образом, водные потоки,
например, Гольфстрим, способны нести огромное количество тепла из более теплых
климатических зон в более холодные. Таким образом, океаны работают как огромные
термостаты. Не только климат Земли, но и температурное регулирование живых
организмов зависит от высокой теплоемкости воды. Это способствует, например,
поддержанию постоянной температуры тела у теплокровных организмов. Кроме того,
относительно высокая теплопроводность воды предотвращает серьезные локальные
колебания температуры.
Абсолютно чистая вода имеет электрическую проводимость 0,03
мкСм / см это связано с автопротолизом. Электропроводность, однако, на реальных
водоемах значительно выше, из-за растворенных ионных компонентов. Вода, будучи
сильным диэлектриком (водный диэлектрик – константа), является одним из самых
лучших растворителей для солей и газов, которые способны к сольволизу с
последующей диссоциацией (например, CO2).
Еще одна особенность воды, которая важна для
гидрологического цикла — ее энтальпия испарения. С этим тесно связана летучесть
воды. Она определяет количество воды, которое переходит в газовую фазу и может
транспортироваться в атмосферу.
Таким образом, можно сделать вывод, что вода уникальна в
физическом и химическом плане. Особые свойства воды сделали ее колыбелью и
абсолютным условием жизни на Земле. Зная основные характеристики этого
вещества, можно делать вывод: благодаря каким своим химическим и физико-химическим
свойствам вода стала жидкой основой жизни.
Источник
Оксид водорода (H2O), гораздо более известный всем нам под названием “вода”, без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом – в виде льда, в жикдом, собственно вода, в газообразном – в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. – это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см3;
- вода – хороший растворитель.
Строение молекулы воды
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода – положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
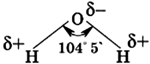
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
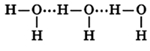
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры – чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии – образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода “охотно” вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
2Na+2H2O = 2NaOH+H2↑
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
3Fe+4H2O=FeO → Fe2O3+4H2↑
C+2H2O → CO2+2H2↑ - с основными оксидами при н.у. вода реагирует с образованием оснований:
CaO+H2O = Ca(OH)2
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
CO2+H2O = H2CO3
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества – в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества – в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества – в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды – такой “слоеный пирог” называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
CuSO4+5H2O = CuSO4·5H2O
См. далее:
- Жесткость воды
- Пероксид водорода (H2O2)
Источник
