Какие химические свойства характерны для кислорода

Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона. Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li + O2 = 2Li2O;
2Na + O2 = Na2O2;
K + O2 = KO2;
2Ca + O2 = 2CaO;
4Al + 3O2 = 2Al2O3;
2Cu + O2 = 2CuO;
3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000С в электрической дуге, в природе – при грозовом разряде). Например:
4P + 5O2 = 2P2O5;
S+ O2 = SO2;
С + O2 = СО2;
2Н2 + O2 = 2Н2О;
N2 + O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S + 3O2 = 2SO2↑ + 2H2O (t);
4NH3 + 3O2 = 2N2↑ + 6H2O (t);
4NH3 + 5O2 = 4NO↑ + 6H2O (t, kat);
2PH3 + 4O2 = 2H3PO4 (t);
SiH4 + 2O2 = SiO2 + 2H2O;
4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t).
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO + O2 = 2CO2 (t);
2SO2 + O2 = 2SO3 (t, V2O5);
2NO + O2 = 2NO2;
4FeO + O2 = 2Fe2O3 (t).
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 + 2O2 = CO2↑ +H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3 = 2KCl +3 O2↑
Примеры решения задач
Источник
В 1772 году шведский химик Шееле открыл элемент кислород. Химические свойства этого вещества оказались воистину уникальными: он реагирует практически со всеми металлами (кроме золота и платины), взаимодействует с неметаллами, органическими и неорганическими веществами. Позднее, в 1774 году, это же доказал и английский ученый Пристли.

Нахождение в природе и физические свойства
Кислород (формула O2) — элемент, который наиболее распространен в земной коре (его весовое содержание составляет 49,13%). Также он содержится в воздухе, где его 23%, входит в состав воды (88,9%), во всех оксидах и кислородосодержащих солях. Общая характеристика кислорода при обычных условиях:
- бесцветный газ;
- не имеет запаха;
- плохо растворим в воде (как и в других растворителях);
- сжижается при -183°C, а затвердевает при -219°C.
Примечательно, что в жидком и твердом состоянии O2 приобретает цвет: он становится голубым. А еще он притягивается магнитом.

В таблице периодической системы находится в главной подгруппе (классе) VI группы. Элементы, расположенные здесь, на внешнем электронном слое имеют по 6 электронов, поэтому могут либо присоединять 2 электрона, либо (кроме кислорода) отдавать 4 или 6 электронов. Именно этим и объясняются их физ. и хим. свойства.
При нормальных условиях чистый кислород малоактивен, но в присутствии воды его реакционная способность усиливается. Реакции, которые протекают с участием этого вещества, называются горением. К этому процессу относится и ржавление, а также дыхание (медленное горение).
Примечание: химическая сущность дыхания состоит в соединении углерода и водорода органических веществ с кислородом.
Химические характеристики и соединения
С точки зрения химии, этот элемент — типичный активный неметалл. Во всех соединениях он проявляет степень окисления -2 (исключение — реакции с фтором). Как может протекать взаимодействие веществ с кислородом:
- Уравнения взаимодействия с металлами. 2Ca + O2 → 2CaO (оксид кальция или негашеная известь); 4Al + 3O2 → 2Al2O3.
- Реакции с неметаллами — в результате образуются несолеобразующие оксиды. S+O2 → SO2 (сернистый газ); N2 + O2 → 2NO (окись азота).
Кроме этих веществ, кислород хорошо вступает в реакции с органическими и неорганическими соединениями (с серой, углеродом, сульфидами металлов — то есть с соединениями, которые горючи в атмосфере O2). Со сложными веществами взаимодействие будет протекать по плану (реакции горения):
- CH4 + 2O2 → CO2 + 2H2O.
- 4Fe (OH)2 + O2 + 2H2O → 4Fe (OH)3.

Справка: в атомарном состоянии элемент более активен, чем в молекулярном. Именно на этом свойстве основано применение кислорода в качестве отбеливающего агента — так легче разрушаются окрашивающие органические вещества.
В молекулярном состоянии кислород может существовать в виде O2 и озона O3, то есть для него характерно явление аллотропии (существование нескольких простых веществ одного и того же химического элемента).
Оксиды и пероксиды
Если говорить кратко, можно сказать, что кислород образует два типа соединений: оксиды и пероксиды. При этом первые из названых можно рассматривать как производные воды (схема): H-O-H, Na-O-Na. Вторые же можно охарактеризовать как пероксидов водорода (тоже схематично): H-O-O-H, Na-O-O-Na.
Получить оксиды можно несколькими способами. Первый — это непосредственным взаимодействием с элементами, а второй — разложение при нагревании гидроксидов или солей. Примеры:
- Непосредственное взаимодействие. 2Mg + O2 → 2MgO.
- Разложение. Cu (OH)2 → CuO + H2O; CaCO3 → CaO + CO2.
С кислородом не будут прямо соединяться галогены, некоторые газы и благородные металлы. Щелочные металлы, за исключением лития, при взаимодействии будут образовывать пероксиды или супероксиды: 2Na +O2 → Na2O2; K + O2 → KO2 (супероксид).

Ряд окислов может соединяться с водой, образуя гидроксиды кислот — такие будут называться кислотными оксидами или ангидридами. К таким относятся SO2 (сернистый ангидрид), CO2 (угольный ангидрид). Те кислородные соединения, которые с водой образуют основания, именуют основными.
Часть оксидов обладает амфотерными свойствами. Гидроксиды таких соединений могут выступать кислотами или основаниями.
Высшие оксиды металлов (то есть те, где он находится в высшей степени окисления) всегда обладают кислотными свойствами: V2O5, Cr2O3. Известна также группа индифферентных (несолеобразующих) окислов: CO, SiO, NO.
Большинство бинарных кислородных соединений устойчивы к нагреванию. А вот оксиды благородных металлов при повышении температуры легко разлагаются.
Озон (O3) — аллотропная модификация
Это соединение образуется при медленном окислении влажного белого фосфора, а также при разложении концентрированной серной кислоты, перманганата калия, бихромата калия и некоторых других соединений (в этом случае O3 — примесь).

В природе озон образуется при окислении смолы хвойных деревьев, ультрафиолетовом облучении кислорода в верхних слоях атмосферы. Качественная реакция на присутствие O3 в воздухе:
O3 + 2KI + H2SO4 → I2 + K2SO4 + H2O + O2.
В промышленности его получают при действии тихого электрического заряда на O2: 3O2 → 2O3. Реакция протекает в специальном приборе — озонаторе, чистое вещество отделяется сжижением.
По внешнему виду — синяя жидкость, взрывоопасная. От соприкосновения с ним эфиры, спирты, скипидар воспламеняются. Озон разрушает многие органические вещества, а микроорганизмы вообще убивает. Какие химические свойства характерны для него:
- при воздействии на ненасыщенные органические вещества O3 присоединяется к ним по месту двойной связи, в результате чего образуются озониды;
- это сильный окислитель.
Благодаря своим бактерицидным свойствам озон широко применяется в промышленности: в пивоваренном производстве, для обеззараживания воды.
Получение кислорода
Один из методов получения — рефракционная перегонка воздуха, но такой кислород содержит около 3% инертных газов (в основной это аргон). Другой вариант — ректификация жидкого воздуха. Этот процесс можно кратко описать так:
- воздух сжимают при давлении 100−200 атм;
- нагревают, после чего охлаждают в специальных аммиачных холодильниках;
- охлажденную смесь пропускают через дроссель, при выходе из которого давление резко падает.
При расширении газов температура понижается, и воздух сжижается. Эта операция повторяется многократно для увеличения выхода конечного продукта.

Сжиженный воздух — смесь газов (в основном это азот и кислород, остальных там меньше 1%). Из-за разницы температур кипения (у N2 она -195,8°C, кислород закипает при -183°C) из жидкого воздуха отгоняется азот, а затем O2.
Полученный этим методом кислород содержит примеси азота, поэтому его подвергают дополнительной очистке.
В лаборатории его можно получить несколькими способами. Основные из них:
- Разложение бертолетовой соли. Реакция протекает при повышенной температуре и в присутствии катализатора, в роли которого используют диоксид марганца: 2KClO3 → 2KCl + 3O2.
- Процесс разложения перманганата калия при нагревании: 2KMnO4 → K2MnO4 + MnO2 + O2.
- Выделяют из нитратов щелочных металлов: 2NaNO3 → 2NaNO2 + O2.
- В процессе распада оксида ртути: 2HgO → 2Hg + O2.
Еще один способ синтеза — электролизация воды в присутствии гидроксидов щелочных металлов, например, KOH. Эти вещества добавляются для увеличения электропроводности.
Применение и промышленное значение
Благодаря своим свойствам кислород широко применяется в технике. В присутствии этого элемента окислительные процессы протекают гораздо интенсивнее, чем в простом воздухе. При этом повышается температура пламени. Поэтому O2 активно применяется для интенсификации окисления в химической и металлургической промышленности (выплавка чугуна и стали, обжиг сульфидных руд, резка металлов и прочее).

Смеси жидкого кислорода с горючими веществами (углерод, сера, древесные опилки) под названием оксиликвиты используются как взрывчатое вещество в горной и горнодобывающей промышленности (при проведении горно-взрывных работ). Чистый O2 применяется в медицине (при лечении бронхиальной астмы, органов ЖКТ — приготовление специальных коктейлей, и прочее), в кислородных приборах при работе под землей и под водой, на больших высотах. Незаменим он и в процессе производства ракетного топлива (окислитель).
Предыдущая
ХимияЦис-транс – изомерия – образование, формулы и примеры изомеров
Следующая
ХимияПриродные источники углеводородов – основные виды, способы добычи и переработки
Источник
Кислород (лат. Oxygenium) – элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов – элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po – халькогены. Халькогены (греч. χαλκος – руда + γενος –
рождающий) – входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Среди элементов VIa группы O, S, Se – неметаллы. Te, Po – металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O – 2s22p4
- S – 3s23p4
- Se – 4s24p4
- Te – 5s25p4
- Po – 6s26p4
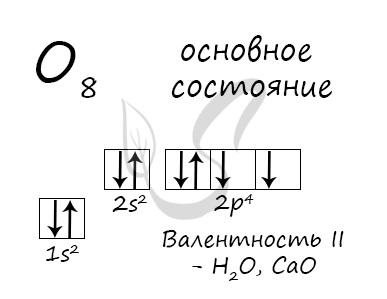
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух – в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. – MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление – угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление – углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

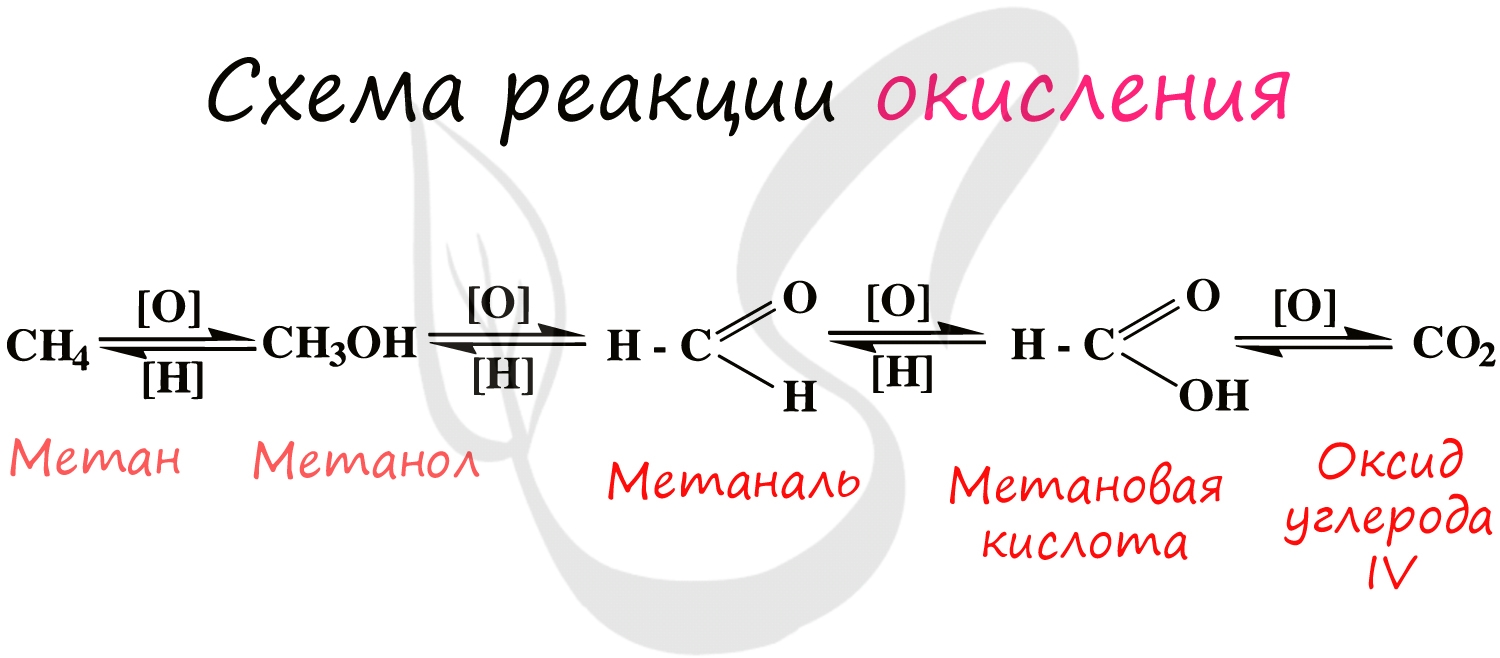
При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты – до альдегидов, альдегиды – до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Кислород – самый распространенный химический элемент на планете. Его массовая доля в земной коре составляет 47,3%, объемная доля в атмосфере – 20,95%, а массовая доля в живых организмах – около 65%. Что представляет из себя этот газ, и какими физическими и химическими свойствами кислород обладает?

Кислород: общая информация
Кислород – неметалл, в нормальных условиях не имеющий цвета, вкуса и запаха.

Рис. 1. Формула кислорода.
Практически во всех соединениях, кроме соединений с фтором и пероксидов, он проявляет постоянную валентность II и степень окисления -2. Атом кислорода не имеет возбужденных состояний, так как на втором внешнем уровне нет свободных орбиталей. Как простое вещество кислород существует в виде двух аллотропных видоизменений – газов кислорода O2 и озона O3.
при определенных условиях кислород может находится в жидком или твердом состоянии. они в отличие от газа имеют цвет: жидкий – светло-голубого цвета, а твердый кислород имеет светло-синий оттенок.

Рис. 2. Твердый кислород.
Кислород в промышленности получают с помощью сжижения воздуха с последующим отделением азота за счет его испарения (имеется разница в температурах кипения: -183 градуса для жидкого кислорода и -196 градусов для жидкого азота).
Химические свойства взаимодействия кислорода
Кислород является активным неметаллом. Кислород способен вступать в реакцию со всеми элементами кроме неона, гелия и аргона. обычно реакции этого газа с другими веществами экзотермичны. Процесс окисления, идущий при одновременном выделении энергии в виде тепла и света, называется горением. Очень важно использование органических соединений, в частности, алканов, в качестве топлива, так как при свободно-радикальной реакции горения выделяется большое количество тепла:
CH4 +2O2 = CO2 +2H2O +880 кДж.
С неметаллами кислород обычно вступает в реакцию при нагревании, образуя при этом оксид. Так, реакция с азотом начинается лишь при температуре выше 1200 градусов или в электрическом разряде:
N2 + O2 =2NO.
Кислород также реагирует с металлами:
3Fe + 2O2= Fe3O4 (в результате реакции образуется соединение – оксид железа)
в природе существует еще более сильный окислитель, чем кислород, это – озон. Он способен окислять золото и платину. В естественных условиях озон образуется из кислорода воздуха во время грозовых разрядов, а в лаборатории – пропусканием электрического разряда через кислород: 3О2 = 2О3 – 285 кДж (эндотермическая реакция)

Рис. 3. Озон.
Самое значительное соединение кислорода – вода. Около 71% земной поверхности занимает водная оболочка. Угловые молекулы воды полярны, каждая из них образует четыре водородные связи: две – как донор протонов и две – как акцептор протонов. Образуются ассоциаты (H2O)x, где x меняется от 2 до 5. В водяном паре присутствуют димеры (H2O)2, а в конденсированных фазах молекула воды может находиться в тетраэдрическом окружении четырех других молекул. если бы молекулы воды не были ассоциированы, то ее температура кипения составляла бы не 100 градусов, а около 80 градусов.
Что мы узнали?
Кислород – сильный окислитель и активный неметалл, поэтому его изучение начинается уже в 8 классе. Он является бесцветным газом без запаха, но также при определенных условиях может находится в жидком и твердом состояниях. Он взаимодействует с металлами и неметаллами, образуя оксиды, а также реагирует с большинством простых веществ.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Людмила Холина
10/10
Марина Островская
8/10
Регина Сычёва
7/10
Алексей Муркелинский
10/10
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 550.
Источник
