Какие химические свойства характерны для гидроксида серы
Характеристика элемента серы
Сера S – элемент № 16, 3–й период, VIA группа (халькогены). Электронная конфигурация атома серы в стационарном состоянии 1s22s22p63s23p4:

Электронная формула атома серы: ![]()
Валентные возможности серы: II – в стационарном состоянии, IV (3s23p33d1) и VI (3s13p33d2) – в возбуждённом состоянии атома.
Наиболее характерными для серы являются следующие степени окисления:
– в простых веществах (ромбическая, пластическая сера);
–2 – в сероводороде Н2S и сульфидах (FeS, Na2S);
+4 – в оксиде серы (IV) SO2, сернистой кислоте Н2SO3 и её солях – сульфитах (K2SO3);
+6 – в оксиде серы (VI) S03, серной кислоте Н2SO4 и её солях – сульфатах (K2SO4).
Реже сера проявляет степени окисления:
–1 – в дисульфидах, например FeS2;
+1 – S2C12 – дихлорид дисеры или дихлорид серы (I);
+2 – SC12 – дихлорид серы или хлорид серы (II).
Высшим оксидом серы является оксид серы (VI) SO3 (серный ангидрид), его характер – кислотный. Высшим гидроксидом серы является серная кислота Н2SO4 – сильный электролит, нелетучая, стабильная двухосновная кислота. Водородным соединением серы является сероводород Н2S (газ при обычных условиях), его водный раствор – сероводородная кислота, двухосновная, слабый электролит.
Сера – простое вещество
Наиболее прочны молекулы серы S8, имеющие форму короны.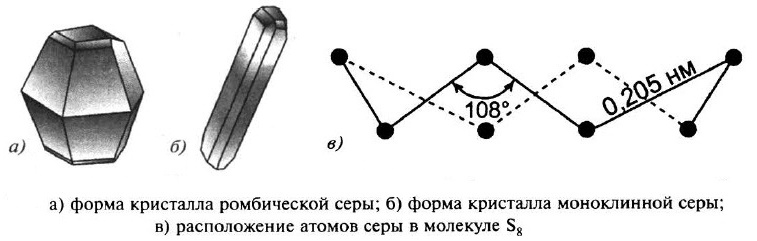
Сера образует несколько аллотропных модификаций: ромбическая сера и моноклинная сера. Кристаллическая решётка в обоих случаях молекулярная, в узлах решётки – молекулы S8.
При выливании расплава серы в холодную воду образуется пластичная масса – пластическая сера, не имеющая кристаллического строения. Её макромолекулы образованы линейными цепями Sn. При хранении пластическая сера становится хрупкой, изменяет окраску и переходит в ромбическую модификацию.
Если медленно нагреть ромбические кристаллы выше 96 °С, то они превращаются в моноклинную модификацию. В обеих модификациях молекулы серы находятся в форме восьмичленных колец, но упакованы они по–разному. Переход ромбической серы в моноклинную при 96 °С является обратимым. При нагревании до 112 °С сера плавится, а составляющие кристаллическую решётку восьмичленные кольца разрываются, образуя молекулы с открытой цепью.
При обычных условиях сера – твёрдое кристаллическое вещество; кристаллы жёлтого цвета, хрупкие, лёгкие (р ≈ 2 г/см3), легкоплавкие (t0пл ≈ 113°С для ромбической серы).
Для серы характерна окислительно-восстановительная двойственность: по отношению к металлам и водороду сера выступает в роли окислителя.
С водородом сера взаимодействует при нагревании с образованием сероводорода:![]()
При обычных условиях сера взаимодействует со ртутью:![]()
При нагревании сера взаимодействует со многими металлами:![]()
По отношению к неметаллам сера выступает в роли восстановителя. При нагревании сера сгорает в кислороде:![]()
Сера взаимодействует со всеми галогенами. Фтор окисляет серу до высшей степени окисления.
При температуре примерно 700–800 °С уголь взаимодействует с серой, образуется сероуглерод:![]()
Сера реагирует с концентрированной серной и азотной кислотами:
Сера используется для производства серной кислоты, в реакции вулканизации каучука, для производства инсектицидов, в косметической промышленности.

Конспект урока «Сера: химические свойства».
Следующая тема: «».
Источник
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
<.p>
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Источник
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым |
Универсальный индикатор | Универсальный индикатор становится синим |
Видеофрагмент:
Действие щелочей на индикаторы
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакции обмена между щелочами и кислотами называют реакциями нейтрализации.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+H2O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2H2O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода((IV)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+H2O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода((IV)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора((V)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3H2O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди((II)) образуются сульфат натрия и гидроксид меди((II)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+H2O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди((II)) с серной кислотой образуются сульфат меди((II)) и вода:
Cu(OH)2+H2SO4→CuSO4+2H2O.
Б) При взаимодействии гидроксида железа((III)) с соляной (хлороводородной) кислотой образуются хлорид железа((III)) и вода:
Fe(OH)3+3HCl→FeCl3+3H2O.
Видеофрагмент:
Взаимодействие гидроксида железа((III)) с соляной кислотой
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди((II)) с оксидом серы((VI)) образуются сульфат меди((II)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+H2O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди((II)) образуются оксид меди((II)) и вода:
Cu(OH)2⟶t°CuO+H2O.
Видеофрагмент:
Разложение гидроксида меди((II))
Б) Гидроксид железа((III)) при нагревании разлагается на оксид железа((III)) и воду:
2Fe(OH)3⟶t°Fe2O3+3H2O.
Источник
Оксид серы((VI))
Oксид серы(VI) образуется при каталитическом окислении сернистого газа:
2SO2+O2⇄t,k2SO3.
При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
SO3+H2O=H2SO4.
Эта реакция протекает даже с парами воды. Поэтому оксид серы((VI)) дымит на воздухе.
Особенностью оксида серы((VI)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
Оксид серы((VI)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
SO3+2NaOH=Na2SO4+H2O,
SO3+CaO=CaSO4.
Степень окисления серы в этом оксиде — (+6). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота H2SO4 — важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Серная кислота очень гигроскопична и используется для осушки разных веществ.
Химические свойства серной кислоты зависят от её концентрации.
Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
H2SO4+CuO=CuSO4+H2O,
H2SO4+Zn(OH)2=ZnSO4+2H2O;
- с солями, если образуется газ или нерастворимое вещество:
H2SO4+CaCO3=CaSO4+H2O+CO2↑,
H2SO4+BaCl2=BaSO4↓+2HCl.
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
H2+1SO4+Zn0=Zn+2SO4+H2↑0.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
2H2S+6O4+Cu0=Cu+2SO4+S+4O2+2H2O.
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
H2SO4(к)+2NaNO3(тв)=Na2SO4+2HNO3.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):
Серная кислота образует два ряда солей. Средние соли называются сульфатами (Na2SO4,CaSO4), а кислые — гидросульфатами (NaHSO4,Ca(HSO4)2).
Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.
Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.
Соли серной кислоты также находят применение. Медный купорос CuSO4⋅5H2O используется для борьбы с заболеваниями растений, гипс CaSO4⋅2H2O применяется в строительстве, сульфат бария BaSO4 — в медицине.
Источник
Оксиды серы. Общая характеристика, химические свойства

Большинство школьников знают два оксида серы – SO2 и SO3.
Однако, это не все соединения, которые сера образует с кислородом.
Рассмотрим их все.
Монооксид серы – SO

- Встречается только в виде разбавленной газовой фазы;
- после концентрирования превращается в S2O2 (диоксид дисульфита);
- SO имеет триплетное основное состояние, схожее с таковым у O2, то есть каждая молекула имеет по два неспаренных электрона;
- молекула SO используется в реакциях органического синтеза (встраивается в молекулы алкенов, алкинов, диенов для получения молекул с трехчленными кольцами, содержащими серу);
- монооксид серы обнаружен на Ио – спутнике Юпитера, а также в атмосфере Венеры, в комете Хейла – Боппа (или “Большая комета 1997 года”);
- редко встречается в атмосфере Земли, поэтому токсичность в полной мере не выявлена;
- обладает высокой воспламеняемостью, горит до образования ядовитого сернистого газа SO2.
Дисульфид серы – SO2

- Токсичный газ, ответственен за запах сгоревших спичек;
- в природе образуется в результате вулканической активности;
- вне Земли встречается в атмосфере Венеры, где образует облака в результате конденсации, способствуя при этом глобальному потеплению на планете; а также на Ио, спутнике Юпитера (90% атмосферы)
- промышленное значение сернистого газа в основном заключается в производстве серной кислоты;
- SO2 может связываться с ионами металлов в качестве лиганда с образованием комплексов диоксида серы с металлом, обычно там, где переходный металл находится в степени окисления 0 или +1;
- обладает антимикробными свойствами, используется в качестве консерванта для кураги, инжира (E220);
- диоксид серы издавна применяется в производстве вина – служит антибиотиком и антиоксидантом, защищая вино от порчи и потемнения (окисления);
- сернистый газа является сильным восстановителем, при этом обладает отбеливающим эффектом;
- эндогенный диоксид серы играет важную физиологическую роль в регуляции работы сердца и кровеносных сосудов, а нарушение его метаболизма может привести к артериальной гипертензии, атеросклерозу, стенокардии.
Триоксид серы, серный ангидрид – SO3

- Является значительным загрязнителем, основной компонент кислотных дождей;
- имеет большое значение в промышленности, так как является прекурсором серной кислоты;
- в сухой атмосфере обильно дымит, без запаха, но едкий;
- на воздухе образуется прямым окислением сернистого газа;
- в лаборатории триоксид серы можно получить путем двухстадийного пиролиза бисульфата натрия:
- 2NaHSO4 → Na2S2O7 + H2O
Na2S2O7 → Na2SO4 + SO3
- серный ангидрид агрессивно гигроскопичен – теплота гидратации достаточна, чтобы смесь этого газа и древесины (или хлопка) могла воспламениться;
- при вдыхании вызывает ожоги, обладает высокой коррозионной активностью.
Тетроксид серы – SO4
- Этот оксид серы представляет собой группу химических соединений с формулой SO3 + Х, где Х лежит между 0 и 1;
- здесь содержатся пероксогруппы (О-О), а степень окисления серы как в триоксиде серы, +6;
- может быть выделен при низких температурах (78 К), после реакции SO3 с атомарным кислородом или фотолиза смесей SO3 – озон.

Монооксид дисеры, субоксид серы – S2O
- Представляет собой бесцветный газ, который при конденсации образует твердое вещество бледного цвета, нестабильное при комнатной температуре;
- Грамотрицательные бактерии Desulfovibrio desulfuricans способны производить S2O;
- был обнаружен Питером Шенком в 1933 году.
Пoсле краткого обзора оксидов серы прилагаю таблицу двух важнейших оксидов серы – сернистого газа и серного ангидрида, так как именно они по большей части встречаются в заданиях ЕГЭ и ОГЭ по Химии.
Реагент | Оксид серы IV – SO2 – Диоксид серы; – газ с резким запахом; – кислотный оксид; – гибридизация серы – sp2; – валентный угол – 120 | Оксид серы VI – SO3 – Триоксид серы; – бесцветная летучая жидкость; – кислотный оксид; – гибридизация серы – sp3; – валентный угол 120 |
Получение | 1) В промышленности: S + O2 = SO2 (360 C) 4FeS + 7O2 = 2Fe2O3 + 4SO2 (t) 2) В лаборатории: Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O (t) Me + 2H2SO4 (k) = MeSO4 + SO2 + 2H2O (Me = Cu, Hg, Bi, Ag) 2HBr + 2H2SO4 (k) = Br2 + SO2 + 2H2O | 1) В промышленности: 2SO2 + O2 = 2SO3 (500 C, V2O5) SO2 + O3 = SO3 + O2 2) В лаборатории: 2CaSO4 = 2CaO + 2SO3 (450 C) 2CuSO4 = 2CuO + 2SO3 Na2S2O7 = Na2SO4 + 2SO3 |
+ O2 | 2SO2 + O2 = 2SO3 + Q | ≠ |
+ H2O | SO2 + H2O = H2SO3 | SO3 + H2O = H2SO4 |
+ H2O2 | SO2 + H2O2 = H2SO4 | ≠ |
+ Основные оксиды | SO2 + CaO = CaSO3 SO2 + Na2O = Na2SO3 | SO3 + Na2O = Na2SO4 SO3 + CaO = CaSO4 |
+ Кислотные оксиды | SO2 + CO = S + 2CO2 (Al2O3, 500 C) SO2 + NO2 = SO3 + NO (нитрозный способ получения серной кислоты) | ≠ |
+ Амфотерные оксиды | SO2 + Al2O3, BeO, ZnO ≠ | SO3 + Fe2O3 = Fe2(SO4)3 |
+ Основания | SO2 + 2NaOH = Na2SO3 + H2O SO2 + Me(OH)x ≠ (Me = Fe, Cr, Al, Sn) SO2 + 2KOH (расплав) = 3K2SO4 + K2S + 4H2O (t) | SO3 + 2NaOH (разб.) = Na2SO4 + H2O SO3 + Ca(OH)2 = CaSO4 + H2O |
+ Кислоты | SO2 + 4HI = S↓ + 2I2 + 2H2O SO2 + 2H2S = 3S + 2H2O SO2 + 2HNO3 (k) = H2SO4 + 2NO2 SO2 + 2HNO2 (p) = H2SO4 + 2NO | SO3 + HF = HSO3F (45 C) SO3 + HCl = HSO3Cl (20 C, в олеуме) SO3 + H2SO4 + CaF2 = 2HSO3F + CaSO4 SO3 + H2SO4 (безводн.) = H2S2O7 3SO3 + H2S = 4SO2 + H2O |
+ Соли | SO2 + Na2CO3 = Na2SO3 + CO2 (20 С) SO2 + Na2SO3 = Na2S2O5 (в этаноле) SO2 + PCl5 = PClO3 + SCl2O (50 – 60 C) | SO3 + MeF = MeSO3F (Me = Li, K, NH4) SO3 + 2KI = K2SO3 + I2 SO3 + Na2S = Na2SO4 |
+ Комплексные соли | 3SO2 + Na3[Al(OH)6] (P) = Al(OH)3 + 3NaHSO3 | ≠ |
+ Неметалл | SO2 + O3 = SO3 + O2 SO2 + 2C = S↓ + 2CO2 (600 С) SO2 + Cl2 = SO2Cl2 (солнечный свет) SO2 + F2 = SO2F2 (20 С, Pt) SO2 + 3F2 = SF6 + O2 (650 C) SO2 + 2H2 = S↓ + 2H2O SO2 + 3S = 2S2O (вакуум, эл. разряд) | 2SO3 + C = 2SO2 + CO2 10SO3 + P4 = P4O10 + 10SO2 |
+ Металл | SO2 + Me + H2O = MeSO3 + H2 (активные Ме) SO2 + Me = MeS2O4 (Me = Zn, Co; в смеси этанола иводы) | SO3 + Mg = MgO + SO2 |
ОВР | SO2 + Cl2 + 2H2O = 2HCl + H2SO4 SO2 + I2 + 2H2O = 2HI + H2SO4 5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 5SO2 + 2K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O SO2 + 2FeCl3+ 2H2O = 2FeCl2 + H2SO4 + 2HCl SO2 + 2CuCl2 + 2H2O = 2CuCl + 2HCl + H2SO4 | SO3 + 2HCl = SO2 + Cl2 + H2O (t) SO3 + 2HBr = SO2 + Br2 + H2O (0 C) SO3 + 8HI = H2S + 4I2 + 3H2O (0 C) |
pangenes.ru © 2020
Источник
