Какие химические свойства характерны для бора

- Обозначение – В (Boron);
- Период – II;
- Группа – 13 (IIIa);
- Атомная масса – 10,811;
- Атомный номер – 5;
- Радиус атома = 98 пм;
- Ковалентный радиус = 82 пм;
- Распределение электронов – 1s22s22p1;
- t плавления = 2075°C;
- t кипения = 3865°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,04/2,01;
- Степень окисления: +3, 0, -3;
- Плотность (н. у.) = 2,34 г/см3 (графит);
- Молярный объем = 4,6 см3/моль.
Первыми бор получили французы Гей-Люссак и Тенар в 1808 году.
В природе элементарный бор не встречается. Почит во всех минералах бор связан с кислородом, он встречается в небольших концентрациях во многих природных соединениях, в виде боратов и боросиликатов, в изверженных и осадочных породах, в водах морей, соляных озер, горячих гейзеров, грязевых вулканов.
Бор в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером “5”, относится к 13(IIIа) группе (См. Атомы 13(IIIа) группы).
Электронная конфигурация бора – 1s22s22p1 (см. Электронная структура атомов).
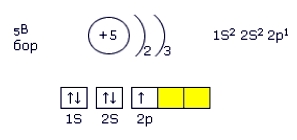
Рис. Электронная конфигурация атома бора.
На внешнем электронном слое бора находятся три электрона, которые он может либо отдавать, либо принимать еще 3, проявляя кислотность +3 или -3.
Бор, как простое вещество
Бор является инертным (при н. у.) неметаллом, образует ряд аллотропных модификаций, отличающихся строением кристаллической решетки – это самое твердное (после алмаза) природное вещество, обладающее малой электропроводностью. Свойства бора во многом зависят от его модификации и чистоты.
Химические свойства бора:
- при комнатной температуре бор вступает в реакцию только со фтором;
- при t=500-700°C реагирует с кислородом, серой, хлором: 4B + 3O2 = 2B2O3;
- при t=1200°C реагинует с кремнием (силицид бора) и азотом (нитрид бора): 3B + Si = B3Si;
- при t=2000°C реагинует с углеродом: 3C + 12B = B12C3;
- в сплавах с металлами бор образует бориды различного состава (в зависимости от условий сплавления и концентрации бора): Ni + 2B = NiB2; 2Ni + B = Ni2B;
- с парами воды бор вступает в реакцию при температуре красного каления: 6H2O + 2B = 2H3BO3 + 3H2.
- взаимодействует с горячими концентрированными азотной и серной кислотой, а также царской водкой: 3HNO3 + B = 3NO2 + H3BO3.
- с кислотами неокислителями бор не реагирует.
Соединения бора
Борная кислота (H3BO3) – это слабая одноосновная кислота, представляет собой растворимое в воде бесцветное кристаллическое вещество.
Борную кислоту получают из минерала сассолина.
Кислотные свойства борной кислоты обусловлены образованием протона при ее взаимодействии с водой:
H3BO3 + H2O = [B(OH)4]- + H+
При нагревании борная кислота, теряя воду, превращается в метаборную кислоту:
H3BO3 → HBO2 → B2O3 + H2O
Борная кислота применяется как дезинфицирующее и антисептическое средство, для изготовления эмалей, специальных стекол, цементов, косметики, средств гигиены.
Борный ангидрид (B2O3) – диэлектрическое бесцветное кристаллическое вещество, легко переходящее в стеклообразное состояние.
Энергично вступает в реакцию с водой, образуя борную кислоту: B2O3 + 3H2O = 2H3BO3.
Получение борного ангидрида:
- обезвоживанием борной кислоты: 2H3BO3 = B2O3 + 3H2O
- нагреванием бора на воздухе (t=700°C): 4B + 3O2 = 2B2O3.
Борный ангидрид нашел применение в производстве специальных стекол и для получения бора.
Получение бора:
- металлотермией получают аморфный “грязый” бор (магний и натрий выступают в роли восстановителей): B2O3 + 3Mg = 2B + 3MgO;
- кристаллический бор высокой частоты получают при температуре 800°C восстановлением галогенидов бора водородом: 2BBr3 + 3H2 = 6HBr + 2B;
- промышленным способом бор получают электролизом расплава K[BF4] и B2O3 (t=800-1000°C).
Применение бора:
- в изготовлении полупроводников (бор – полупроводник p-типа с дырочной проводимостью);
- для изготовления огнеупорных, кислотостойких материалов (силициды устойчивы к действию воды, щелочей, кислот, высокой температуры);
- в качестве металлургических добавок при изготовлении жаропрочной, механически и коррозионноустойчивой стали;
- для изготовления деталей реактивных двигателей, газовых турбин, работающих в тяжелых условиях высоких температур;
- в ядерной энергетике для изготовления замедлителей быстрых нейтронов и для биологической защиты.
Источник
Данный химический элемент, очень интересен. По сути, он является одним из простейших по строению неметаллов, после водорода и гелия. Задания, связанные с Бором могут попадаться на ЕГЭ, однако его часто «забывают» изучить в рамках школьного курса химии. Так давайте самостоятельно познакомимся с этим замечательным химическим элементом.
В периодической системе химических элементов Д.И. Менделеева, Бор располагается во 2 периоде, III группе, главной подгруппе. В своей подгруппе он является единственным элементом неметаллом. Порядковый номер Бора – 5, атомная масса элемента – 11.
Схема строения атома бора может быть изображена так:
Исходя из этого электронная формула бора:
История открытия химического элемента Бора.
Впервые, Бор был получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром, путем нагревания борного ангидрида B2O3 с металлическим калием.
Через несколько месяцев бор получил Гемфри Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова «бурак» или персидского «бурах», которые использовались для обозначения буры (наиболее распространенного и используемого соединения бора).
Физические свойства.
Бор может быть представлен в виде практически белого, серого или красного кристаллического вещества, а так же в виде темного аморфного вещества. Это совершенно нормально, так как данный элемент имеет около десятка аллотропных модификаций.
Аллотропия — это способность некоторых химических элементов существовать в виде двух и более простых веществ, различных по строению и свойствам.
Образование той или иной модификации и их взаимные переходы определяются в основном температурой, при которой получают бор.
По твердости бор занимает второе место (после алмаза), среди всех веществ. Тип кристаллической решетки Бора – атомная.
Способы получения.
1. Бор можно получить путем пиролиза бороводородов:
B2H6 = 2B +3H2
2. Путем металлотермии (то есть вытеснением его из соединения с помощью активных металлов).
B2O3 + 3Mg = 3MgO + 2B
3. Вытеснением его из соединений при помощи водорода:
2BBr3 + 3H2 = 2B + 6HBr
4. Термическим разложением галогенида бора в присутствие катализатора:
2BI3 = 2B + 3I2
Химические свойства Бора:
1. Взаимодействует с фтором.
Необходимо отметить, что бор является довольно инертным неметаллом. При нормальных условиях, без нагревания он реагирует только со фтором.
2B + 3F2 → 2BF3↑
2. Взаимодействует с кислородом (реакция горения).
4B + 3O2 → 2B2O3
3. Взаимодействует с некоторыми неметаллами.
Например, при нагревании бор реагирует с галогенами, азотом, фосфором и углеродом:
2B + 3Cl2 → 2BCl3
2B + N2 → 2BN
B + P → BP
4B + C → B4C
4. Взаимодействует с кремнеземом.
При сильном нагревании бор способен восстановить кремний из его оксида:
3SiO2 + 4B → 3Si + 2B2O3
5. Взаимодействие с кислотами:
Кислоты, не являющиеся окислителями, с бором не реагируют, однако концентрированная азотная кислота и «царская водка» окисляют его до борной кислоты.
B + HNO3 = H3BO3 + NO2 + H2O
Стоит отметить, что напрямую бор не взаимодействует с водородом, поэтому бороводороды обычно получают косвенным путем.
Соединения бора.
В природе бор часто встречается в составе различных минералов:
- Бандилит – CuCl[B(OH)4]
- Йохачидолит – CaAlB3O7
- Курнаковит – Mg[B3O3(OH)5]·5(H2O)
- Ридмерджнерит – NaBSi3O8
- Улексит – NaCa[B5O6(OH)6] • 5 H2O
Однако, как уже упоминалось ранее наиболее распространенным и используемым соединением бора является бура (Na2B4O7*10H2O).
Сферы применение буры:
- служит сырьем для производства борной кислоты.
- используется в производстве оптических и цветных стёкол, различных керамик.
- в производстве различных эмалей.
- как дезинфицирующее и консервирующее средство.
- в фармацевтической промышленности.
- в аналитической химии.
- является компонентом некоторых моющих средств.
- компонент косметики.
Стоит так же сказать несколько слов, про оксид бора и борную кислоту.
Оксид Бора (B2O3) – это бинарное неорганическое химическое соединение бора с кислородом, бесцветное, довольно тугоплавкое, стекловидное или кристаллическое вещество, диэлектрик. Является кислотным оксидом и при взаимодействие с водой дает борную кислоту:
B2O3 + 3H2O → 2H3BO3
Борная кислота (H3BO3) – это бесцветное кристаллическое вещество, без запаха. Является слабой кислотой.
Интересно то, что при взаимодействие со щелочами, на выходе, образуются продукты известные, как тетрабораты:
4H3BO3 + 2NaOH → Na2B4O7 + 7H2O
С избытком щелочи они могут быть переведены в метабораты:
Na2B4O7 + 2NaOH = 4NaBO2 + H2O
Сферы применения борной кислоты:
- В медицине в качестве антисептического средства.
- Как борное удобрение.
- В фотографии, в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
- В пищевой промышленности, как пищевую добавку E284.
- В ювелирном деле, как основа флюсов для пайки золотосодержащих сплавов.
- В быту, для уничтожение тараканов, муравьёв, клопов.
Вот собственно и все. Очень надеюсь, что вы узнали для себя что-то новое.
Источник
| Бор | |
|---|---|
| Тёмно-коричневое или чёрное вещество | |
 Элементарный бор | |
| Название, символ, номер | Бор / Borum (B), 5 |
| Атомная масса (молярная масса) | [10,806; 10,821]а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s2 2p1 |
| Радиус атома | 98 пм |
| Ковалентный радиус | 82 пм |
| Радиус иона | 23 (+3e) пм |
| Электроотрицательность | 2,04 (шкала Полинга) |
| Степени окисления | -3;0;+3 |
| Энергия ионизации (первый электрон) | 800,2(8,29) кДж/моль (эВ) |
| Плотность (при н. у.) | 2,34 г/см³ |
| Температура плавления | 2 348 K (2075 °C) |
| Температура кипения | 4 138 K (3865 °C) |
| Уд. теплота плавления | 23,60 кДж/моль |
| Уд. теплота испарения | 504,5 кДж/моль |
| Молярная теплоёмкость | 11,09 Дж/(K·моль) |
| Молярный объём | 4,6 см³/моль |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | a=10,17; α=65,18 Å |
| Отношение c/a | 0,576 |
| Температура Дебая | 1250 K |
| Теплопроводность | (300 K) 27,4 Вт/(м·К) |
| Номер CAS | 7440-42-8 |
Бор (B, лат. borum) — химический элемент 13-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе III группы, или к группе IIIA) с атомным номером 5. Бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.

История и происхождение названия
Впервые получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Хэмфри Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бурак (араб. بورق) или персидского бурах (перс. بوره), которые использовались для обозначения буры.
Нахождение в природе
Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется, прежде всего, тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространённых аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л), в водах соляных озёр, горячих источников и грязевых вулканов.
Основные минеральные формы бора:
- Боросиликаты: датолит CaBSiO4OH, данбурит CaB2Si2O8
- Бораты: бура Na2B4O7·10H2O, ашарит MgBO2(OH), гидроборацит (Ca, Mg)B6O11·6H2O, иниоит Ca2B6O11·13H2O, калиборит KMg2B11O19·9H2O.
Также различают несколько типов месторождений бора:

Образец датолита. Дальнегорское боросиликатное месторождение
- Месторождения боратов в магнезиальных скарнах:
- людвигитовые и людвигито-магнетитовые руды;
- котоитовые руды в доломитовых мраморах и кальцифирах;
- ашаритовые и ашарито-магнетитовые руды.
- Месторождения боросиликатов в известковых скарнах (датолитовые и данбуритовые руды);
- Месторождения боросиликатов в грейзенах, вторичных кварцитах и гидротермальных жилах (турмалиновые концентрации);
- Вулканогенно-осадочные:
- борные руды, отложенные из продуктов вулканической деятельности;
- переотложенные боратовые руды в озёрных осадках;
- погребённые осадочные боратовые руды.
- Галогенно-осадочные месторождения:
- месторождения боратов в галогенных осадках;
- месторождения боратов в гипсовой шляпе над соляными куполами.
Крупнейшее месторождение России находится в Дальнегорске (Приморье). Оно относится к боросиликатному типу. В этом одном компактном месторождении сосредоточено не менее 3 % всех мировых запасов бора. На действующем при месторождении горно-химическом предприятии выпускается боросодержащая продукция, которая удовлетворяет потребности отечественной промышленности. При этом 75 % продукции идёт на экспорт в Корею, Японию и Китай.
Получение
- Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
B2H6 → t 2B + 3H2
- Метод металлотермии (чаще восстановление магнием или натрием):
B2O3 + 3Mg ⟶ 3MgO + 2B KBF4 + 3Na ⟶ 3NaF + KF + B
- Термическое разложение паров бромида бора на раскалённой (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
2BBr3 + 3H2 →W 2B + 6HBr
Физические свойства

Сечения захвата нейтронов изотопами 10B (верхняя кривая) и 11B (нижняя кривая).
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора — самый высокий предел прочности на разрыв 5,7 ГПа.
Изотопы бора
Основная статья: Изотопы бора
В природе бор находится в виде двух изотопов 10B (19,8 %) и 11B (80,2 %).
10B имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуются два нерадиоактивных ядра (альфа-частица и литий-7), очень быстро тормозящиеся в среде, а проникающая радиация (гамма-кванты) при этом отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
10B + n → 11B* → α + 7Li + 2,31 МэВ.
Поэтому 10B в составе борной кислоты и других химических соединений применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор применяется в нейтрон-захватной терапии рака.
Кроме двух стабильных, известно ещё 12 радиоактивных изотопов бора, из них самым долгоживущим является 8B с периодом полураспада 0,77 с.
Происхождение
Все изотопы бора возникли в межзвёздном газе в результате расщепления тяжелых ядер космическими лучами, или при взрывах сверхновых.
Химические свойства

Ионы бора окрашивают пламя в зелёный цвет
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
2B + 3F2 ⟶ 2BF3↑
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
4B + 3O2 ⟶ 2B2O3
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
Mg3B2 + 6HCl ⟶ B2H6↑ + 3MgCl2
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
3SiO2 + 4B ⟶ 3Si + 2B2O3 3P2O5 + 10B ⟶ 5B2O3 + 6P
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. Растворяется в расплаве смеси гидроксида и нитрата калия:
2B + 2KOH + 3KNO3 →ot 2KBO2 + 3KNO2 + H2O
В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
B2O3 + 3H2O ⟶ 2H3BO3
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты, например:
4H3BO3 + 2NaOH ⟶ Na2B4O7 + 7H2O
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице.
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике в качестве акцепторной добавки для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Бор применяется и в медицине при бор-нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей).
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2−) [B4O12H8]−) применяются как окислительные агенты. Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, не содержащие хлор («персиль», «персоль» и др.).
Отдельно также стоит указать на то, что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (B(OH)3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путём изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Борная кислота применяется также в медицине и ветеринарии.
Нитрид бора, активированный углеродом, является люминофором со свечением от синего до жёлтого цвета под действием ультрафиолета. Обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но широко практиковалось химиками-любителями в первой половине XX века.
Боросиликатное стекло — стекло обычного состава, в котором заменяют щелочные компоненты в исходном сырье на окись бора (B2O3).
Фторид бора BF3 при нормальных условиях является газообразным веществом, используется как катализатор в оргсинтезе, а также как рабочее тело в газонаполненных детекторах тепловых нейтронов благодаря захвату нейтронов бором-10 с образованием ядер лития-7 и гелия-4, ионизирующих газ (см. реакцию выше).
Бороводороды и борорганические соединения
Ряд производных бора (бороводороды) являются эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения бора с водородом и углеродом стойки к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Боразон и его гексагидрид
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, в чём-то подобных органическим.
Так, гексагидрид боразона (H3BNH3, похож на этан по строению) при обычных условиях твёрдое соединение с плотностью 0,78 г/см3, содержит почти 20 % водорода по массе. Его могут использовать водородные топливные элементы, питающие электромобили.
Биологическая роль
Основная статья: Биологическая роль бора
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)⋅10−4 % бора, в костной ткани (1,1—3,3)⋅10−4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г. ЛД₅₀ ≈ 6 г/кг массы тела.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Источник
