Какие химические свойства характерны аминокислот
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
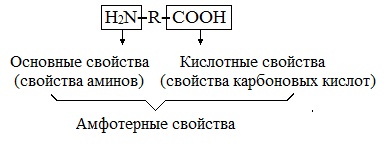
Кислотно-основное равновесие в водных растворах
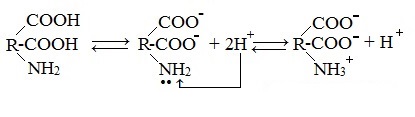
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
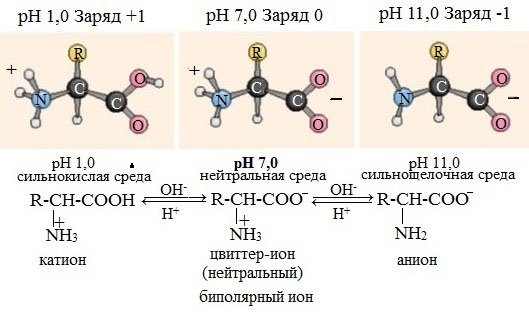
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
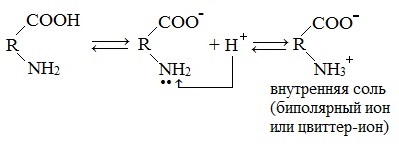
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
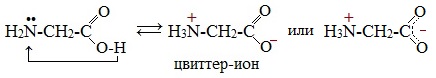
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН<7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н+.
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН— .
2. Взаимодействие с основаниями и кислотами
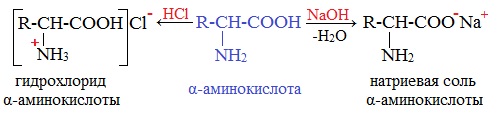
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
Образуются соли:
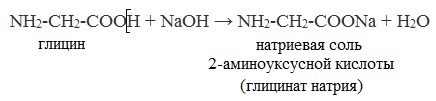
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
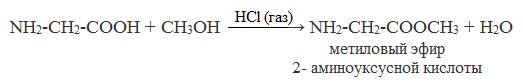
в) взаимодействие с аммиаком
Образуются амиды:
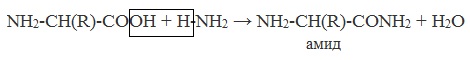
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
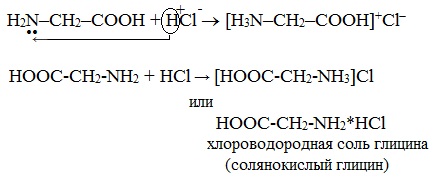
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
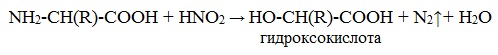
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.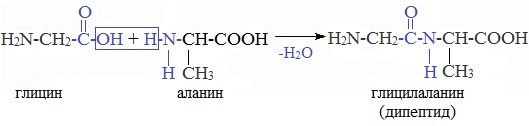
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
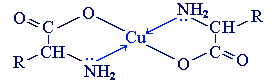
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Аминокислоты
Источник
Среди
азотсодержащих органических веществ имеются соединения с двойственной функцией.
Особенно важными из них являются аминокислоты.
В клетках и тканях живых организмов
встречается около 300 различных аминокислот, но только 20 (α-аминокислоты) из них служат звеньями (мономерами), из которых построены пептиды и
белки всех организмов (поэтому их называют белковыми аминокислотами).
Последовательность расположения этих аминокислот в белках закодирована в
последовательности нуклеотидов соответствующих генов. Остальные аминокислоты
встречаются как в виде свободных молекул, так и в связанном виде. Многие из
аминокислот встречаются лишь в определенных организмах, а есть и такие, которые
обнаруживаются только в одном из великого множества описанных организмов.
Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты;
животные и человек не способны к образованию так называемых незаменимых
аминокислот, получаемых с пищей. Аминокислоты участвуют в обмене белков и
углеводов, в образовании важных для организмов соединений (например, пуриновых
и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот),
входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов,
антибиотиков и т. д.; некоторые аминокислоты служат посредниками при передаче
нервных импульсов.
Аминокислоты — органические амфотерные соединения, в состав
которых входят карбоксильные группы – СООН и аминогруппы -NH2.
Аминокислоты можно рассматривать как
карбоновые кислоты, в молекулах которых атом водорода в радикале замещен
аминогруппой.
КЛАССИФИКАЦИЯ

Аминокислоты классифицируют по структурным признакам.
1.
В
зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты
подразделяют на α-, β-, γ-, δ-, ε- и
т. д.
2.
В
зависимости от количества функциональных групп различают кислые, нейтральные и
основные.
3.
По
характеру углеводородного радикала различают алифатические (жирные), ароматические,
серосодержащие и гетероциклические
аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.
Примером
ароматической аминокислоты может служить пара-аминобензойная
кислота:
Примером
гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота
НОМЕНКЛАТУРА
По систематической номенклатуре названия
аминокислот образуются из названий соответствующих кислот прибавлением
приставки амино- и указанием места расположения аминогруппы по отношению
к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.
Например:
Часто используется также другой способ
построения названий аминокислот, согласно которому к тривиальному названию
карбоновой кислоты добавляется приставка амино- с указанием положения
аминогруппы буквой греческого алфавита.
Пример:
Для α-аминокислот R-CH(NH2)COOH

, которые играют исключительно важную
роль в процессах жизнедеятельности животных и растений, применяются тривиальные
названия.
Таблица. Некоторые важнейшие α-аминокислоты
Аминокислота | Сокращённое обозначение | Строение радикала ( R ) |
Глицин | Gly (Гли) | H – |
Аланин | Ala (Ала) | CH3 – |
Валин | Val (Вал) | (CH3)2CH – |
Лейцин | Leu (Лей) | (CH3)2CH – CH2 – |
Серин | Ser (Сер) | OH- CH2 – |
Тирозин | Tyr (Тир) | HO – C6H4 – CH2 – |
Аспарагиновая кислота | Asp (Асп) | HOOC – CH2 – |
Глутаминовая кислота | Glu (Глу) | HOOC – CH2 – CH2 – |
Цистеин | Cys (Цис) | HS – CH2 – |
Аспарагин | Asn (Асн) | O = C – CH2 – │ NH2 |
Лизин | Lys (Лиз) | NH2 – CH2- CH2 – CH2 – |
Фенилаланин | Phen (Фен) | C6H5 – CH2 – |
Если
в молекуле аминокислоты содержится две аминогруппы, то в ее названии
используется приставка диамино-, три группы NH2 – триамино-
и т.д.
Пример:
Наличие
двух или трех карбоксильных групп отражается в названии суффиксом –диовая
или -триовая кислота:
ИЗОМЕРИЯ
1. Изомерия углеродного скелета
2. Изомерия положения функциональных
групп
3. Оптическая изомерия
α-аминокислоты, кроме глицина NН2-CH2-COOH.
ФИЗИЧЕСКИЕ СВОЙСТВА
Аминокислоты представляют собой
кристаллические вещества с высокими (выше 250°С) температурами плавления,
которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны.
Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в
воде и нерастворимы в органических растворителях, чем они похожи на
неорганические соединения. Многие аминокислоты обладают сладким вкусом.
ПОЛУЧЕНИЕ
3. Микробиологический синтез. Известны микроорганизмы, которые
в процессе жизнедеятельности продуцируют α – аминокислоты белков.
ХИМИЧЕСКИЕ СВОЙСТВА
Аминокислоты
амфотерные органические соединения, для них характерны кислотно-основные
свойства.
I.Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные
растворы электропроводны. Эти свойства объясняются тем, что молекулы
аминокислот существуют в виде внутренних солей, которые образуются за счет
переноса протона от карбоксила к аминогруппе:
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую
или щелочную среду в зависимости от количества функциональных групп.
Видео-опыт «Свойства аминоуксусной кислоты»
2. Поликонденсация→ образуются полипептиды (белки):
При взаимодействии двух
α-аминокислот образуется дипептид.
3. Разложение → Амин +
Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
II. Свойства карбоксильной группы
(кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH
+ NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa – натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные
эфиры – летучие вещества (р.
этерификации): NH2-CH2-COOH
+ CH3OH HCl(газ)→ NH2-CH2-COOCH3
+ H2O
NH2-CH2-COOCH3 – метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются
амиды:
NH2-CH(R)-COOH + H-NH2 →
NH2-CH(R)-CONH2 + H2O
4. Практическое значение имеет
внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой
кислоты, в результате которого образуется ε-капролактам (полупродукт для
получения капрона):
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
2. С азотистой кислотой (подобно
первичным аминам):
NH2-CH(R)-COOH +
HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение
объёма выделившегося азота позволяет определить количество аминокислоты (метод
Ван-Слайка)
IV.Качественная реакция
1. Все аминокислоты окисляются
нингидрином с образованием продуктов сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты
образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую
синюю окраску, используются для обнаружения α-аминокислот.
Видео-опыт “Образование медной соли аминоуксусной кислоты”.
Генетическая связь аминокислот с другими классами органических соединений
ПРИМЕНЕНИЕ
1) аминокислоты широко
распространены в природе;
2) молекулы аминокислот – это те
кирпичики, из которых построены все растительные и животные белки;
аминокислоты, необходимые для построения белков организма, человек и животные
получают в составе белков пищи;
3) аминокислоты прописываются при
сильном истощении, после тяжелых операций;
4) их используют для питания
больных;
5) аминокислоты необходимы в
качестве лечебного средства при некоторых болезнях (например, глутаминовая
кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты
применяются в сельском хозяйстве для подкормки животных, что положительно
влияет на их рост;
7) имеют техническое значение:
аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна –
капрон и энант.
О РОЛИ АМИНОКИСЛОТ
Нахождение в природе и биологическая роль аминокислот
Источник
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) |  цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) |  фенилаланин
тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH лизин |
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

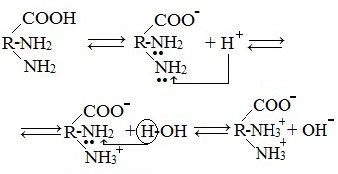
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
![]()
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с основаниями:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
![]()
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
![]()
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
![]()
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
![]()
Например, глицин разлагается при нагревании:
![]()
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Источник
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду

