Какие химические свойства аммиака используют при получении продуктов
Аммиак – NH3

Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH2)2CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с
атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных
связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой, она может образовать
донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ – сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
3. Получение аммиака
В лаборатории | В |
Для получения аммиака в лаборатории NH4Cl (NH4)2SO4 Внимание! Гидроксид аммония неустойчивое основание, При получении аммиака держите пробирку – приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака N2(г) + 3H2(г) ↔ 2NH3(г) Условия: катализатор температура давление Это так называемый процесс Габера (немецкий |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с
изменением степени окисления атома азота (реакции окисления) - без
изменения степени окисления атома азота (присоединение)
Реакции N-3 → N0 → N+2 NH3 – сильный |
с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео – Эксперимент ” Окисление аммиака в |
с оксидами металлов 2 NH3 |
с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl |
аммиак – непрочное соединение, при 2NH3↔ N2 + 3H2 |
5. Применение аммиака
По объемам производства
аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде
водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду
применяют также непосредственно в виде удобрения, а иногда поля поливают из
цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка. В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики
используют водные растворы аммиака (нашатырный спирт)
в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека
из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 “Горение аммиака”
Тренажёр №2 “Химические свойства аммиака”
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Источник
Урок посвящен изучению темы «Аммиак». Вы узнаете о свойствах соединений азота, в которых он проявляет степень окисления -3, в какие химические реакции и при каких условиях вступает аммиак.
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода.
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
I. Строение молекулы аммиака
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ – сигма связи N-H.
II. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
III. Получение аммиака
В лаборатории | В промышленности |
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O (NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4+ 2H2O Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O При получении аммиака держите пробирку – приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж Условия:
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода) |
IV. Химические свойства аммиака
Для аммиака характерны реакции:
- C изменением степени окисления атома азота (реакции окисления)
- Без изменения степени окисления атома азота (присоединение)
1. Реакции с изменением степени окисления атома азота (реакции окисления)
N-3 → N0 → N+2
NH3 – сильный восстановитель
- Взаимодействие с кислородом
1.Горение
Опыт: “Горение аммиака”(при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
Видео – эксперимент: “Окисление аммиака в присутствии оксида хрома”
- Взаимодействие с оксидами металлов
2NH3 + 3CuO = 3Cu + N2 + 3H2O
- Взаимодействие с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- Аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
2. Реакции без изменения степени окисления атома азота (присоединение –Образование иона аммония NH4+ по донорно-акцепторному механизму)
Видео – эксперимент: “Растворение аммиака в воде”
V. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
VI. Соли аммония
1. Составление формул солей аммония
Соли аммония – это сложные вещества, в состав которых входят ионы аммония NH4+, соединённые с кислотными остатками.
Например,
NH4Cl – хлорид аммония
(NH4)2SO4 – сульфат аммония
NH4NO3 – нитрат аммония
(NH4)3PO4 – ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
NH4H2PO4 – дигидроортофосфат аммония
2. Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
3. Получение
1 способ: Аммиак + кислота: NH3 + HNO3 → NH4NO3
2 способ: Аммиачная вода + кислота: 2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
4. Химические свойства
Общие свойства
1. Сильные электролиты (диссоциируют в водных растворах полностью)
NH4Cl → NH4+ + Cl-
2. Взаимодействие с кислотами (реакция обмена)
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
Взаимодействие с солями (реакция обмена)
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4↓ + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4↓
Спецефические свойства
1. Разложение при нагревании
a) если кислота летучая: NH4Cl → NH3 + HCl (при нагревании)
NH4HCO3 → NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства: NH4NO3 → N2O + 2Н2O (при нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на NH4+ – ион аммония
При нагревании со щелочами выделяется газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
5. Применение
- Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов;
- Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение;
- Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
- Хлорид аммония NH4Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии.
VII. Закрепление
Задание №1. Заполните таблицу – запишите молекулярные, полные и краткие ионные уравнения для следующих солей аммония:
Соли | Химические свойства, общие с другими солями (1 – 3) | Специфические свойства (1 – 2) |
1. Хлорид аммония | ||
2. Карбонат аммония | ||
3. Сульфид аммония | ||
4. Сульфат аммония | ||
5. Нитрат аммония |
Задание №2.
Ответьте на вопрос: Гидрокарбонат аммония иногда применяют при выпечке кондитерских изделий. Какие свойства гидрокарбоната при этом используют? Ответ подтвердите уравнениями реакций.
Задание №3. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
Задание №4. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
VIII. Тренажеры
Тренажёр №1: “Горение аммиака”
Тренажёр №2:“Химические свойства аммиака”
ЦОРы
Опыт: “Получение аммиака”
Опыт: “Горение аммиака”
Видео – Эксперимент: “Окисление аммиака в присутствии оксида хрома”
Анимация: “Донорно-акцепторнорный механизм”
Видео – Эксперимент: “Качественная реакция на аммиак”
Видео – Эксперимент: “Взаимодействие аммиака с хлороводородом (дым без огня)”
Видео – Эксперимент: “Взаимодействие аммиака с концентрированными кислотами”
Видео – Эксперимент: “Фонтан”
Видео – Эксперимент: “Растворение аммиака в воде”
Опыт: “Разложение карбоната аммония”
Опыт: “Качественная реакция на ион аммония”
Опыт:“Разложение дихромата аммония”
Источник
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.

Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
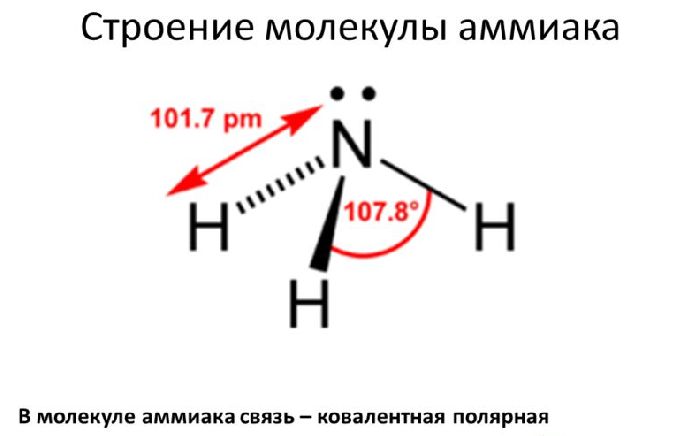
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
Взаимодействие | Продукты реакции | Уравнение |
С кислородом | Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота | – 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
С галогенами | Азот, кислота | 2NH3 + 3Br2 → N2 + 6HBr |
С водой | Гидроксид аммония или нашатырный спирт | NH3 + H2O → NH4OH |
С кислотами | Соли аммония | – NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
С солями | Замещает металл, образуя новую соль | 2NH3 + CuSO4 → (NH4)2SO4 + Cu |
С оксидами металлов | Восстанавливает металл, образуется азот | 2NH3 + 3CuO → 3Cu + N2 + 3H2O |

Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Костя Антонюк
4/5

Александр Котков
5/5
Оценка доклада
Средняя оценка: 4.3. Всего получено оценок: 288.
Источник
Химические свойства аммиака
1. Реакции с металлами.
Будет ли аммиак реагировать с металлами? У
атома азота в этом соединении формально восемь
внешних электронов (пять своих и три оттянуты от
атомов водорода), а металлы стремятся свои
валентные электроны отдать. С одной стороны,
атому азота уже некуда их принять. С другой – в
аммиаке есть атомы водорода, частично обедненные
электронами, т. е. имеющие возможность принять их.
Известно, что активные металлы вытесняют
водород из воды, а чем аммиак хуже? Ну только
разве тем, что аммиак газообразен при
температурах выше его точки кипения, равной
–33,4 °С. Соответственно газ NH3
рассредоточен в пространстве, и требуется
дополнительный подогрев, чтобы реакция пошла.
Именно накаливанием металлов в атмосфере
аммиака чаще всего и получают нитриды. (Нитриды –
это соединения, состоящие из двух элементов, один
из которых азот, причем атомы азота имеют в этом
соединении отрицательный заряд.) Например:
2. Реакции с неметаллами.
Формальная степень окисления азота в аммиаке
–3. Следовательно, аммиак может реагировать с
кислородом (и другими окислителями!), увеличивая
при этом степень окисления азота, т. е. отдавая
электроны. Однако на пути к положительным
степеням окисления находится нулевая – простое
вещество азот, как мы уже выяснили, необычайно
устойчиво.
Можно предположить, что при реакции аммиака с
кислородом будут образовываться азот и вода.
Именно так и происходит в действительности.
Следует добавить, что аммиак горит только в
чистом кислороде, а не на воздухе:
4NH3 + 3O2 = 6H2O + 2N2.
Как быть, если надо получить из аммиака оксиды
азота? Вспомним о катализаторах – веществах,
которые ускоряют реакцию или меняют ее
направление. Катализаторы используют и при
получении оксидов азота из аммиака и кислорода.
Реакцию каталитического окисления проводят на
металлической платине:
Интересна реакция аммиака с другим простым
веществом – озоном, более агрессивным
окислителем, чем кислород. Озон переводит азот из
степени окисления –3 в степень окисления +5. Но не
весь! В результате получается нитрат аммония:
6NН3 + 4O3 = 3NН4NO3
+ 3Н2O.
3. Реакция с водой.
Мы уже говорили о хорошей растворимости
аммиака в воде. Но почему фенолфталеин
становится в таком растворе малиновым? Загадка?
Попробуем разобраться, откуда появилась в
растворе щелочная среда. Для начала вспомним
теорию электролитической диссоциации. В водных
растворах все ионы и молекулы гидратированы –
окружены «шубой» из молекул воды,
сориентированных соответствующим образом: к
атомам водорода потянулись «кислородные
половинки», а к атому азота – «водородная
половинка» (рис. 5).
Рис. 5. Аммиак в воде:
атом азота – черный шар; атомы кислорода –
большие белые шары; атомы водорода – малые белые
шары
В какой-то момент образовалась конструкция Н3N•••НОН.
Далее, известно, что вода слабо, но диссоциирует
по реакции:
Поскольку электроотрицательность кислорода
больше, чем азота, связь кислорода с водородом
полярнее, чем связь азота с водородом. Можно
предположить, что равновесие в реакции
диссоциации гидратированной молекулы аммиака
будет больше смещено в сторону образования ионов
(по сравнению с водой):
В растворе появляется весьма ощутимый избыток
ионов ОН–, и фенолфталеин сигнализирует об
этом малиновой окраской. Стоит подчеркнуть, что
все эти реакции обратимые. Поэтому вместе со
щелочной реакцией среды (правая часть уравнения)
растворы аммиака обладают еще и характерным
запахом аммиака, выделяющегося из раствора
(левая часть уравнения), и заметным количеством
нестойкого гидратированного молекулярного
аммиака (это подтверждается, например, реакциями
образования аммиачных комплексов с ионами
металлов).
4. Реакции с кислотами.
Как слабое, но все же основание, водный раствор
аммиака реагирует с кислотами с образованием
соли и воды:
Соли аммония, подобно солям натрия и калия,
хорошо растворяются в воде, но при этом частично
гидролизуются:
С кислотами реагирует и газообразный аммиак,
причем не только с растворами, но и с
газообразными кислотами. В лабораториях, в
которых работают с растворами соляной кислоты и
аммиака, постоянно появляется белый налет на
окружающих предметах. Даже небольших количеств
аммиака и хлороводорода в воздухе достаточно для
протекания реакции:
5. Реакции со щелочами.
Газообразный аммиак со щелочами не реагирует. А
вот водный раствор аммиака «откликается» на
добавление щелочи. Поскольку при растворении
аммиака в воде протекает обратимая реакция
образования иона аммония и гидроксид-иона, то
добавление последнего в раствор смещает
равновесие, растворимость аммиака уменьшается (а
интенсивность запаха соответственно
увеличивается):
NН4OH + NaOH = NH3
+ H2O + NaOH.
Физические свойства аммиака в цифрах
Молярная масса M(NH3) = 17 г/моль. Температура
плавления равна –78 °C, температура кипения
–33 °С. Плотность газообразного аммиака при
нормальных условиях (0 °С, 1 атм) 0,771 г/л (аммиак
легче воздуха почти в два раза). Растворимость
при атмосферном давлении и 0 °С около 90 л (!)
газа в 100 г воды, при 20 °С – 65 л в 100 г воды.
При сравнении физических свойств аммиака и
азота в первую очередь обращает на себя внимание
температура кипения. Почему у аммиака она
настолько выше? У азота – почти –200 °С, а у
аммиака – только –33 °С. Загадка? Попробуем
отгадать.
Для начала сопоставим температуры кипения
соединений с водородом элементов V, VI и VII групп
главных подгрупп периодической системы (рис. 6).
Рис. 6. Графики зависимости температур кипения
водородных соединений элементов V(·),
VI(C)и VII(Д)
групп
главных подгрупп от номера периода (массы атома)
Если экстраполировать графики такой
зависимости, можно оценить, какими должны бы быть
эти температуры, исходя из общей закономерности.
Из графика видно, что аммиак, вода и фтороводород
имеют аномально высокие температуры кипения:
аммиак – примерно на 50 °С выше
«теоретической», фтороводород – на 100 °С, а
вода – на 160 °С. Во-первых, видно, что аммиак не
одинок, а во-вторых, вспоминается, что у азота,
кислорода и фтора самая высокая
электроотрицательность. Значит, и связи этих
элементов с водородом самые полярные. Водород в
таких соединениях почти без электрона и поэтому
сильно притягивается к неподеленным парам
электронов, которые есть и у азота, и у кислорода,
и у фтора. Образуются водородные связи. Они,
конечно, слабее обычных ковалентных связей, но их
много. И это «много» многое значит.
Водородные связи играют в природе огромную
роль. Например, спираль из двух молекул ДНК
образуется только за счет водородных связей.
Такие связи сравнительно легко разрываются,
когда происходит считывание информации с
определенного участка ДНК. Когда водородных
связей много, получается крепкое связывание в
целом.
В заключение стоит сказать, что связь водорода
с фтором полярнее, чем связь азота с водородом, и
соответственно притяжение сильнее, а
температура кипения HF выше, чем NH3. У воды же
самая высокая температура кипения из этой
троицы, потому что молекулы воды образуют
водородные связи сразу «двумя руками» – две
неподеленные пары электронов и два атома
водорода в каждой молекуле! Аммиак и
фтороводород по своему строению «однорукие».
Химические свойства аммиака
(дополнение)
Аммиак сам по себе устойчив и разлагается
только при очень высоких температурах. Но если
проводить нагревание в присутствии
обыкновенного железа, он разлагается на азот и
водород при значительно более низких
температурах. Интересно, что при каталитическом
разложении небольшая часть аммиака всегда
остается в смеси газов, независимо от времени и
температуры проведения реакции. Именно этот факт
подсказал ученым мысль о возможности связывания
атмосферного азота через аммиак. Действительно,
логично предположить, что разложение аммиака –
процесс обратимый, тогда изменением условий и
подбором катализатора можно сместить процесс в
сторону образования аммиака до такой степени,
что это станет выгодно для его промышленного
получения.
Еще немного о реакциях аммиака с простыми
веществами. Интересны реакции аммиака с
галогенами. Йод не может изменить степень
окисления азота! Он просто сам
диспропорционирует:
Нитрид йода (по названию понятно, что у йода в
этом соединении степень окисления
положительная), или иначе йодистый азот, в сухом
виде разлагается со взрывом даже от простого
сотрясения.
Бром и хлор могут отнять у азота только по три
электрона, переведя в простое вещество. И только
фтору под силу перевалить через эту
сверхустойчивую нулевую степень окисления
азота. Получается трифторид. И это максимально
возможный, просто потому, что у атомов второго
периода нет «запасных» орбиталей. Не бывает
поэтому и пятивалентного азота!
Жидкий аммиак – хороший растворитель. Реакции
в жидком аммиаке идут по тем же законам, что и в
воде, а вот растворимость в воде и в жидком
аммиаке у соединений различная. Например,
реакция
2АgNО3 + ВаBr2 = 2АgВr + Ва(NO3)2
в воде идет в сторону образования
нерастворимого бромида серебра, а в жидком
аммиаке – в сторону образования нерастворимого
бромида бария.
Из жидкого аммиака, как и из воды, активные
металлы вытесняют водород. Например, реакция с
цезием протекает за несколько минут:
А вот аналогичная реакция с натрием протекает
значительно дольше. При этом образуется
сольватированный электрон! (Сольватация –
процесс, аналогичный гидратации, только в других
растворителях.)
Экологические свойства аммиака
Аммиак – активное и «едкое» соединение
(едкость кислот и щелочей проявляется в том, что
большие количества ионов Н+ или ОН–
разъедают живую ткань растений, животных и,
естественно, человека; впрочем, неживую «ткань»
они тоже разъедают). Однако если заменить в
аммиаке один, два или все три атома водорода на
органические радикалы, то «едкость» существенно
снижается, а основные свойства остаются. Такие
соединения выполняют в живой природе функции
оснований.
Животные и человек используют уже
приготовленные растениями азотсодержащие
органические соединения, поэтому для нас с вами
аммиак, безусловно, яд. При попадании на кожу
концентрированный раствор аммиака вызывает
химические ожоги, при вдыхании большого
количества аммиака может наступить отек легких
– реакция организма на вдыхание почти всех едких
веществ.
Однако, как и многие другие яды, в малых дозах
аммиак оказывает положительное влияние на
организм: 10%-й раствор аммиака в воде используют в
медицине для стимуляции дыхания (его не пьют,
конечно, а просто дают понюхать), центральной
нервной системы и т. п.
В больших количествах аммиак вреден и для
растений. Но в небольших количествах он им
необходим. Ведь без азота, и в частности без
аммиака, не построить те органические
соединения, которые потом превращаются в
растительные белки, а в дальнейшем – в белки
животных. Большим количествам газообразного
аммиака растения противостоят по-разному.
Некоторые стараются прекратить ему доступ
внутрь (например, закрывают устьица на листьях).
Другие растения перерабатывают аммиак с помощью
соответствующих ферментов в нитрат-ионы, которые
для растений не ядовиты, тем самым запасая ценный
для своего развития элемент.
О.Р. Валединская
(МГУ, Москва)
Источник
