Какие химические элементы отражают химические свойства вещества

Все химические элементы разделяют на металлы и неметаллы в зависимости от строения и свойств их атомов. Также на
металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств.
В Периодической системе химических элементов Д.И. Менделеева неметаллы расположены по диагонали: бор – астат и над ней в главных подгруппах.
Для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне от 1 до 3 (исключение: германий, олово свинец – 4;
сурьма и висмут – 5; полоний – 6 электронов).
Атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем уровне от 4 до 8 (исключение бор, у него таких электронов –
три).
Отсюда стремление атомов металлов к отдаче внешних электронов, т.е. восстановительные свойства, а для атомов неметаллов – стремление к приему недостающих до
устойчивого восьмиэлектронного уровня электронов, т.е. окислительные свойства.
В металлах – металлическая связь и металлическая кристаллическая решетка. В узлах решетки находятся положительно заряженные ионы металлов, связанные
посредством обобществленных внешних электронов, принадлежащих всему кристаллу.
Это обуславливает все важнейшие физические свойства металлов: металлический блеск, электро- и теплопроводность, пластичность (способность изменять форму под
внешним воздействием) и некоторые другие, характерные для этого класса простых веществ.
Металлы I группы главной подгруппы называют щелочными металлами.
Металлы II группы: кальций, стронций, барий – щелочноземельными.
В химических реакциях металлы проявляют только восстановительные свойства, т.е. их атомы отдают электроны, образуя в результате положительные
ионы.
1. Взаимодействуют с неметаллами:
а) кислородом (с образованием оксидов)
Щелочные и щелочноземельные металлы окисляются легко при обычных условиях, поэтому их хранят под слоем вазелинового масла или керосина.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO
Обратите внимание: при взаимодействии натрия – образуется пероксид, калия – надпероксид
2Na + O2 = Na2O2, К + О2 = КО2
а оксиды получают прокаливанием пероксида с соответствующими металлом:
2Na + Na2O2 = 2Na2O
Железо, цинк, медь и другие менее активные металлы медленно окисляются на воздухе и активно при нагревании.
3Fe + 2O2 = Fe3O4 (смесь двух оксидов: FeO и Fe2O3)
2Zn + O2 = 2ZnO
2Cu + O2 = 2CuO
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
б) водородом (с образованием гидридов)
2Na + H2 = 2NaH
Ca + H2 = CaH2
в) хлором (с образованием хлоридов)
2K + Cl2 = 2KCl
Mg + Cl2 = MgCl2
2Al + 3Cl2 =2AlCl3
Обратите внимание: при взаимодействии железа образуется хлорид железа (III):
2Fe + 3Cl2 = 2FeCl3
г) серой (с образованием сульфидов)
2Na + S = Na2S
Hg + S = HgS
2Al + 3S = Al2S3
Обратите внимание: при взаимодействии железа образуется сульфид железа (II):
Fe + S = FeS
д) азотом (с образованием нитридов)
6K + N2 = 2K3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2. Взаимодействуют со сложными веществами:
Необходимо помнить, что по восстановительной способности металлы расположены в ряд, который называют электрохимическим рядом напряжений или активности
металлов (вытеснительный ряд Бекетова Н.Н.):
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au, Pt
а) водой
Металлы, расположенные в ряду до магния, при обычных условиях вытесняют водород из воды, образуя растворимые основания – щелочи.
2Na + 2H2O = 2NaOH + H2↑
Ba + H2O = Ba(OH) 2 + H2↑
Магний взаимодействует с водой при кипячении.
Mg + 2H2O = Mg(OH) 2 + H2↑
Алюминий при удалении оксидной пленки бурно реагирует с водой.
2Al + 6H2O = 2Al(OH) 3 + 3H2↑
Остальные металлы, стоящие в ряду до водорода, при определенных условиях тоже могут вступать в реакцию с водой с выделением водорода и образованием
оксидов.
3Fe + 4H2O = Fe3O4 + 4H2↑
б) растворами кислот
(Кроме концентрированной серной кислоты и азотной кислоты любой концентрации. См. раздел «Окислительно-восстановительные реакции».)
Обратите внимание: не используют для проведения реакций нерастворимую кремниевую кислоту
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Металлы, стоящие в ряду от магния до водорода, вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2↑
Обратите внимание: образуются соли двухвалентного железа.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Образование нерастворимой соли препятствует протеканию реакции. Например, свинец практически не реагирует с раствором серной кислоты из-за образования на
поверхности нерастворимого сульфата свинца.
Металлы, стоящие в ряду после водорода, НЕ вытесняют водород.
в) растворами солей
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Для остальных металлов выполняется правило:
Каждый металл вытесняет из растворов солей другие металлы, расположенные в ряду правее него, и сам может быть вытеснен металлами, расположенными левее
него.
Cu + HgCl2 = Hg + CuCl2
Fe + CuSO4 = FeSO4 + Cu
Как и в случае с растворами кислот, образование нерастворимой соли препятствует протеканию реакции.
г) растворами щелочей
Взаимодействуют металлы, гидроксиды которых амфотерны.
Zn + 2NaOH + 2H2O = Na2 [Zn(OH) 4] + H2↑
2Al + 2KOH + 6H2O = 2K[Al(OH) 4] + 3H2↑
д) с органическими веществами
Щелочные металлы со спиртами и фенолом.
2C2H5OH + 2Na = 2C2H5ONa + H2↑
2C6H5OH + 2Na = 2C6H5ONa + H2↑
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение
углеродного скелета молекулы (реакция А.Вюрца):
CH2Cl-CH2-CH2Cl + Zn = C3H6(циклопропан) + ZnCl2
2CH2Cl + 2Na = C2H6(этан) + 2NaCl
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. При этом образуются одинарные (в молекулах H2, F2,
Cl2, Br2, I2), двойные (в молекулах О2), тройные (в молекулах N2) ковалентные связи.
1. молекулярное
При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, O3, F2,
Cl2) или твердые вещества (I2, P4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества молекулярного строения, поэтому
летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. атомное
Эти вещества образованы кристаллами, в узлах которых находятся атомы: (Bn, Сn, Sin, Gen, Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением
ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма
мала.
Многие элементы – неметаллы образуют несколько простых веществ – аллотропных модификаций. Аллотропия может быть связана с разным составом молекул: кислород
О2 и озон О3 и с разным строением кристаллов: аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен. Элементы – неметаллы, имеющие аллотропные
модификации: углерод, кремний, фосфор, мышьяк, кислород, сера, селен, теллур.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение
электроотрицательности. В ряду неметаллов
At, B, Te, H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
электроотрицательность возрастает и усиливаются окислительные свойства.
Отсюда следует, что для простых веществ – неметаллов будут характерны как окислительные, так и восстановительные свойства, за исключением фтора – самого
сильного окислителя.
1. Окислительные свойства
а) в реакциях с металлами (металлы всегда восстановители)
2Na + S = Na2S (сульфид натрия)
3Mg + N2 = Mg3N2 (нитрид магния)
б) в реакциях с неметаллами, расположенными левее данного, то есть с меньшим значением электроотрицательности. Например, при взаимодействии фосфора и серы
окислителем будет сера, так как фосфор имеет меньшее значение электроотрицательности:
2P + 5S = P2S5 (сульфид фосфора V)
Большинство неметаллов будут окислителями в реакциях с водородом:
H2 + S = H2S
H2 + Cl2 = 2HCl
3H2 + N2 = 2NH3
в) в реакциях с некоторыми сложными веществами
Окислитель – кислород, реакции горения
CH4 + 2O2 = CO2 + 2H2O
2SO2 + O2 = 2SO3
Окислитель – хлор
2FeCl2 + Cl2 = 2FeCl3
2KI + Cl2 = 2KCl + I2
CH4 + Cl2 = CH3Cl + HCl
Ch2=CH2 + Br2 = CH2Br-CH2Br
2. Восстановительные свойства
а) в реакциях с фтором
S + 3F2 = SF6
H2 + F2 = 2HF
Si + 2F2 = SiF4
б) в реакциях с кислородом (кроме фтора)
S + O2 = SO2
N2 + O2 = 2NO
4P + 5O2 = 2P2O5
C + O2 = CO2
в) в реакциях со сложными веществами – окислителями
H2 + CuO = Cu + H2O
6P + 5KClO3 = 5KCl + 3P2O5
C + 4HNO3 = CO2 + 4NO2 + 2H2O
H2C=O + H2 = CH3OH
3. Реакции диспропорционирования: один и тот же неметалл является и окислителем и восстановителем
Cl2 + H2O = HCl + HClO
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Источник
Ïîõîæèå ïîñòû

Ñóëüôèä æåëåçà(II) (FeS) – âåùåñòâî, êîòîðîå îáðàçóåòñÿ ïðè âçàèìîäåéñòâèè æåëåçà ñ ñåðîé. Ïðèìåíÿåòñÿ êàê ñûðüå â ïðîèçâîäñòâå ÷óãóíà, à òàêæå ÿâëÿåòñÿ òâåðäûì èñòî÷íèêîì ñåðîâîäîðîäà. Íà ôîòîãðàôèÿõ ìîæíî çàìåòèòü ÷àñòèöû ìåòàëëè÷åñêîãî æåëåçà, êîòîðîå íå ïðîðåàãèðîâàëî ñ ñåðîé.
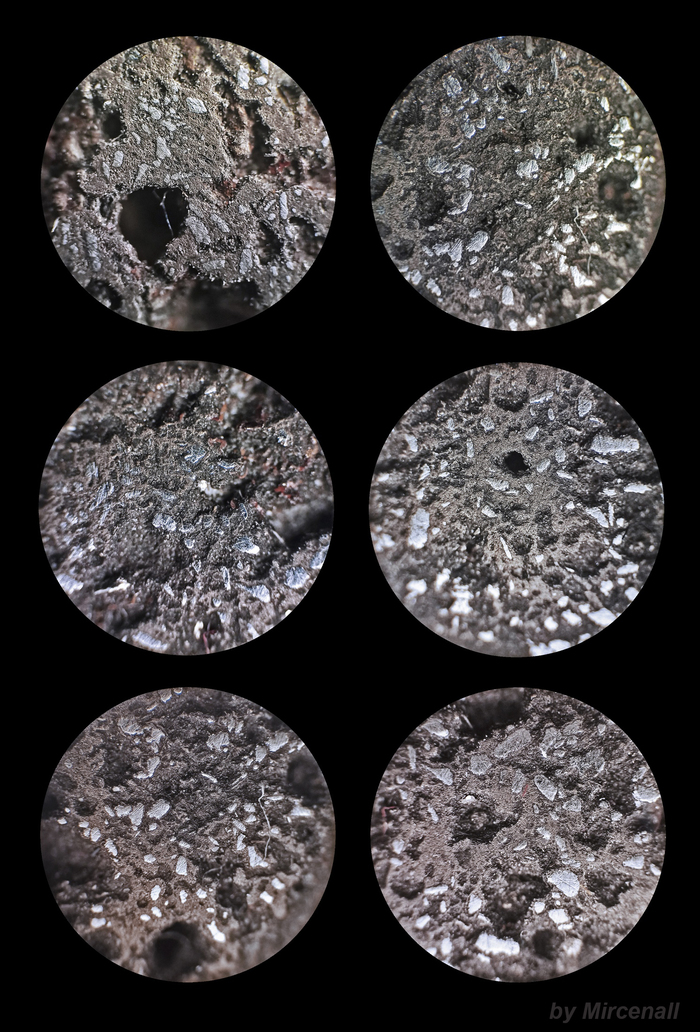
 ïðèðîäå ñóëüôèä æåëåçà(II) âñòðå÷àåòñÿ êðàéíå ðåäêî, îäíàêî ðàñïðîñòðàí¸í äèñóëüôèä æåëåçà(II) (FeS2), èçâåñòíûé êàê ìèíåðàë ïèðèò èëè ñåðíûé êîë÷åäàí.
vk.com/mircenall

Ïîêàçàòü ïîëíîñòüþ
3
Íîâûé ìåäüñîäåðæàùèé êîìïëåêñ, èäåþ ñòðîåíèÿ êîòîðîãî ïîäñêàçàëà ïðèðîäà, ýôôåêòèâíî ðàñùåïëÿåò âîäó â íåéòðàëüíîé ñðåäå. Ýòî îòêðûòèå ìîæåò ñäåëàòü áîëåå äîñòóïíûì ïîëó÷åíèå âîäîðîäà ñ ïîìîùüþ âîññòàíîâëåíèÿ âîäû.
Ìîëåêóëÿðíûé âîäîðîä äàâíî ðàññìàòðèâàþò êàê àëüòåðíàòèâó íåôòè è ãàçó. Åäèíñòâåííûé ïðîäóêò ñãîðàíèÿ âîäîðîäà âîäà, êîòîðàÿ ñàìà ìîæåò áûòü èñòî÷íèêîì âîäîðîäà. Ìíîãèå èññëåäîâàòåëüñêèå ãðóïïû ïî âñåìó ìèðó ñòàðàþòñÿ ðàçðàáîòàòü êàòàëèçàòîðû, ñïîñîáíûå ïîíèçèòü ýíåðãèþ âîññòàíîâëåíèÿ âîäû äî ìîëåêóëÿðíîãî âîäîðîäà è îáëåã÷èòü ïðîòåêàíèå ýòîé ðåàêöèè. Íàèáîëåå ýôôåêòèâíûå êàòàëèçàòîðû ðàñùåïëåíèÿ âîäû â íàñòîÿùåå âðåìÿ êîîðäèíàöèîííûå ñîåäèíåíèÿ ðóòåíèÿ è èðèäèÿ. Ê íåäîñòàòêàì îáîèõ ìåòàëëîâ ìîæíî îòíåñòè èõ íèçêèå êîíöåíòðàöèè â çåìíîé êîðå è âûñîêóþ ñòîèìîñòü.
Íîâîå èññëåäîâàíèå äåìîíñòðèðóåò, ÷òî â ïðèñóòñòâèè ïîðôèðèíîâîãî êîìïëåêñà ìåäè ýëåêòðîêàòàëèòè÷åñêîå ðàñùåïëåíèå âîäû ïðîèñõîäèò ïðè íåéòðàëüíûõ çíà÷åíèÿõ ðÍ è ïðè íèçêîì çíà÷åíèè ýëåêòðîäíîãî ïîòåíöèàëà. Ïðè 310 ì è ðÍ 7 âîäà îêèñëÿåòñÿ ñ âûäåëåíèåì ìîëåêóëÿðíîãî êèñëîðîäà, à â êèñëîé ñðåäå (ïðè òîì æå ýëåêòðîäíîì ïîòåíöèàëå) äî ïåðåêèñè âîäîðîäà. Õîòÿ ìåäíûé êîìïëåêñ è íå ïðåâîñõîäèò ïî ïðîèçâîäèòåëüíîñòè êîìïëåêñû áëàãîðîäíûõ ìåòàëëîâ, âñå æå ýòî áîëüøîé øàã âïåðåä ìåíüøàÿ ýôôåêòèâíîñòü ïðîèçâîäíûõ ìåäè êîìïåíñèðóåòñÿ åå áîëüøåé ðàñïðîñòðàíåííîñòüþ è äåøåâèçíîé. Êàòàëèçàòîðû ðàñùåïëåíèÿ âîäû íà îñíîâå ìåäè áûëè èçâåñòíû è ðàíåå, íî îíè ðàáîòàëè â ñèëüíîùåëî÷íîé ñðåäå è ïðè áîëüøîì çíà÷åíèè ýëåêòðîäíîãî ïîòåíöèàëà.
Èññëåäîâàòåëè èñõîäèëè èç òîãî, ÷òî â ïðîöåññå ôîòîñèíòåçà êëþ÷åâóþ ðîëü â îêèñëåíèè âîäû è âûäåëåíèè êèñëîðîäà èãðàåò ìàãíèéïîðôèðèíîâûé êîìïëåêñ. Òåì íå ìåíåå ñïîñîáíîñòü ìåäüïîðôèðèíîâîãî êîìïëåêñà êàòàëèçèðîâàòü îêèñëåíèå âîäû îêàçàëàñü ïðèÿòíîé íåîæèäàííîñòüþ äëÿ ìíîãèõ õèìèêîâ êàê ñïåöèàëèñòîâ ïî õèìèè ïîðôèðèíîâûõ êîìïëåêñîâ, òàê è òåõ, êòî çàíèìàëñÿ ðàñùåïëåíèåì âîäû. Åùå îäíà íåîáû÷íàÿ ÷åðòà ýòîãî êàòàëèçàòîðà îêèñëåíèå âîäû äî ïåðåêèñè âîäîðîäà ïðè íèçêèõ çíà÷åíèÿõ ðÍ. Ýòîò ïðîöåññ íå ñòîèò ðàññìàòðèâàòü êàê íîâûé ñïîñîá ïîëó÷åíèÿ H2O2, è âñå æå îí òðåáóåò âíèìàíèÿ. Óñòàíîâèâ, êàê îáðàçóåòñÿ ïåðåêèñü âîäîðîäà, èññëåäîâàòåëè ñìîãóò îïðåäåëèòü ìåõàíèçì ýòîé êàòàëèòè÷åñêîé ðåàêöèè è âûÿñíèòü, êàê ïîâûñèòü ýôôåêòèâíîñòü ðàñùåïëåíèÿ âîäû.


Ïîêàçàòü ïîëíîñòüþ
3
 îäíîì èç ïîñòîâ îá îëîâå ïèêàáóøíèêîâ çàèíòåðåñîâàëà òàêàÿ äåòàëü – ïðè òåìïåðàòóðå íèæå 13.2°C êîâêîå è ïëàñòè÷íîå îëîâî ïåðåõîäèò â äðóãóþ “ñåðóþ” àëëîòðîïíóþ ìîäèôèêàöèþ.

Ïðè ýòîì ïåðåõîä ñîïðîâîæäàåòñÿ óâåëè÷åíèåì îáúåìà íà 25,6 %, â ñâÿçè ñ ÷åì âîçíèê âîïðîñ
Ñîáñòâåííî ýòî ÿ è ðåøèë ïðîâåðèòü.
Ïåðâûì äåëîì íàøåë â ëàáîðàòîðèè ÷èñòîå îëîâî (ïðîâîëîêà ïðèïîÿ íå ïîäîéäåò, èáî îíà ñîäåðæèò ñâèíåö, êîòîðûé êàê ðàç òàêè ïðåäîòâðàùàåò ðàçðóøåíèå). Îëîâî õðàíèòñÿ â âèäå ìàëåíüêèõ ãðàíóë, íî ÿ ïåðåïëàâèë åãî â êóñîê ïîáîëüøå.

Äåëàòü èäåàëüíóþ äåðåâÿííóþ êîðîáêó áûëî áû ñëèøêîì äîëãî, òàê ÷òî ðåøèë çàëèòü êóñîê ìåòàëëà â ãèïñ è âûñòàâèòü íà ìîðîç íà äîëãîå âðåìÿ â çàêðûòîé êîðîáêå.


Êðîìå òîãî, ÷åì íèæå òåìïåðàòóðà, òåì áûñòðåå îñóùåñòâëÿåòñÿ ïåðåõîä (íàèáîëåå áûñòðîå ïðåâðàùåíèå íàáëþäàåòñÿ ïðè òåìïåðàòóðå íèæå -33°C). Ïîñêîëüêó íà÷àëî çèìû â ñòîëèöå âûäàëîñü òåïëûì, ÿ ðåøèë ïðîâîäèòü ýòîò ýêñïåðèìåíò ñ ñåðåäèíû ÿíâàðÿ. Ãèïñîâûé ñëåïîê ñ îëîâîì ÿ ïîëîæèë â êîðîáêó (äàáû çàùèòèòü åãî îò âîäû) è îñòàâèë íà ïîäîêîííèêå, ðåøèâ îòêðûòü ñïóñòÿ ìåñÿö.
×åðåç ìåñÿö ôîðìà îñòàëàñü ëåæàòü, êàê ëåæàëà. Îäíàêî êàê ðàç ñ ñåðåäèíû ôåâðàëÿ óäàðèëè ñèëüíûå ìîðîçû è ïðîöåññ äîëæåí áûë óñêîðèòüñÿ (òåì âðåìåíåì ïèêàáó íà÷àëî íàïîìèíàòü î ñåáå)
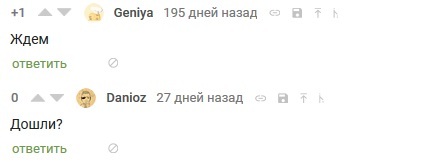

Îòêðûâ êîðîáêó óæå â ìàðòå, ÿ óâèäåë æåëàííîå èçìåíåíèå – òðåùèíó, ðàçäåëèâøóþ ñëåïîê íà äâå ïîëîâèíû!

Àêêóðàòíî äîñòàâ åãî, ÿ ðàçäåëèë ïîëîâèíêè ôîðìû è îòòóäà ïîñûïàëñÿ òåìíûé ïîðîøîê ñ ìåòàëëè÷åñêèì áëåñêîì (è îñòàòîê êóñêà áåëîãî îëîâà, ïîâåðõíîñòü êîòîðîãî áûëà òàêæå âñÿ â ñåðîé ìîäèôèêàöèè ).  êîíöå êîíöîâ îíî-òàêè ðàçîðâàëî ãèïñ.

Ñåðîå îëîâî ñêîðåå ïîõîæå íà ãðàôèò ñ áëåñêîì ñâèíöà, ÷åì íà ìåòàëë. ×òîáû íàãëÿäíî ïðîäåìîíñòðèðîâàòü îòëè÷èå, ÿ âûñûïàë ðÿäîì ïîðîøîê áåëîãî îëîâà è ïîëó÷åííîå ñåðîå. Îäíàêî âåðíóòü åìó èñõîäíîå ñîñòîÿíèå íå ñîñòàâëÿåò òðóäà – òðåáóåòñÿ ëèøü ðàñïëàâèòü α-îëîâî è ñëèòîê ñíîâà áóäåò ÿâëÿòüñÿ áåëûì β-îëîâîì

Òàêèì îáðàçîì ïðåäïîëîæåíèå î ðàçðûâàþùåì êîíòåéíåðå îëîâå ïîäòâåðæäåíî

P.S. îòäåëüíàÿ áëàãîäàðíîñòü ñåäüìîé ïàðòèè ãðàíóëèðîâàííîãî îëîâà Óðàëüñêîãî çàâîäà õèìðåàêòèâîâ îò íîÿáðÿ 1977 ãîäà. Èíà÷å áû ýêñïåðèìåíò íå ñîñòîÿëñÿ.


Ïîêàçàòü ïîëíîñòüþ
12
Êðèñòàëëû ñåðåáðà íà ìåäè.

Ñåðåáðî âûäåëÿåòñÿ íà òðåóãîëüíûõ ìåäíûõ ïëàñòèíêàõ, ïîãðóæåííûõ â ðàñòâîð íèòðàòà ñåðåáðà

Ìåäü
Öèíê

Ñåðåáðî

Îëîâî

Ñâèíåö

Ïîêàçàòü ïîëíîñòüþ
2

Îêñèãåìîãëîáèí íå ôåððîìàãíèòåí, ïîñêîëüêó ýòî ñâîéñòâî ÿâëÿåòñÿ ðåçóëüòàòîì ñîâìåñòíîãî ïîâåäåíèÿ ìàãíèòíûõ àòîìîâ, äåéñòâóþùèõ â óíèñîí. Çäåñü æå àòîìû æåëåçà âõîäÿò â ñîñòàâ î÷åíü áîëüøèõ ìîëåêóë, èç-çà ÷åãî îíè íàõîäÿòñÿ íà çíà÷èòåëüíîì ðàññòîÿíèè äðóã îò äðóãà, ïðè êîòîðîì ñâÿçü ìåæäó àòîìàìè ïðîïàäàåò è îíè ñòàíîâÿòñÿ ìàãíèòíî-íåçàâèñèìûìè.

Ê ñåðåáðÿíîé ìîíåòå, ïîêðûòîé íàëåòîì ñóëüôèäà, ïîäíîñÿò ñíà÷àëà ïðîâîä, ïîäêëþ÷åííûé ê îòðèöàòåëüíîìó êîíòàêòó áàòàðåè, à çàòåì òîò, ÷òî ïîäêëþ÷åí ê ïîëîæèòåëüíîìó. Òàêèì îáðàçîì ìåòàëë ïðîâîäà ñëóæèò âîññòàíîâèòåëåì ñóëüôèäà ñåðåáðà äî ÷èñòîãî ìåòàëëà.
Îáðàçîâàíèå êðèñòàëëîâ îëîâà ïðè ýëåêòðîëèçå ðàñòâîðà õëîðèäà îëîâà â ñåðíîé êèñëîòå

Îáðàçîâàíèå îëîâÿííûõ êðèñòàëëîâ ïîä ìèêðîñêîïîì

Îáðàçîâàíèå îëîâÿííûõ êðèñòàëëîâ ïðè íèçêîé êîíöåíòðàöèè õëîðèäà îëîâà è ìàëûõ îáúåìàõ ðàñòâîðà (òàêæå óâåëè÷åíî)

Ðåàêöèÿ îëîâà ñ àçîòíîé êèñëîòîé

Ðåàêöèÿ îëîâà ñ ñîëÿíîé êèñëîòîé

Ðåàêöèÿ îëîâà ñ öàðñêîé âîäêîé (ñìåñü àçîòíîé è ñîëÿíîé êèñëîòû) ïðîòåêàåò, îäíàêî, áîëåå áóðíî

“Îëîâÿííàÿ ÷óìà” – îñîáîå ñâîéñòâî ýëåìåíòà, êîòîðîå çàêëþ÷àåòñÿ â òîì, ÷òî ïðè òåìïåðàòóðå íèæå 13,2 °C ìåòàëëè÷åñêîå (áåëîå) îëîâî (β-Sn) ïåðåõîäèò â äðóãîå ôàçîâîå ñîñòîÿíèå ñåðîå îëîâî (α-Sn), â êðèñòàëëè÷åñêîé ðåø¸òêå êîòîðîãî àòîìû ðàñïîëàãàþòñÿ ìåíåå ïëîòíî. Ïðîèñõîäèò ýòî ïðî ïðè÷èíå óâåëè÷åíèÿ óäåëüíîãî îáú¸ìà ÷èñòîãî îëîâà íà 25,6 %

Îëîâî èìååò íåáîëüøóþ òåìïåðàòóðó ïëàâëåíèÿ (232 °C) è ëåãêî ïåðåõîäèò â æèäêîå ñîñòîÿíèå ïîä äåéñòâèåì ïëàìåíè ãîðåëêè

Ãîðåíèå ìàëåíüêîãî êóñî÷êà îëîâà (ìîìåíòàëüíîå îêèñëåíèå)

Ïîêàçàòü ïîëíîñòüþ
6

Ðîñò êðèñòàëëîâ ñåðåáðà íà ìåäíîé ïðîâîëîêå (â ðàñòâîðå íèòðàòà ñåðåáðà)

Ðåàêöèÿ ñåðåáðà ñ àçîòíîé êèñëîòîé (ñ âûäåëåíèåì äèîêñèäà àçîòà)

Îáðàçîâàíèå õëîðèäà ñåðåáðà

Ðåàêöèÿ “Ñåðåáðÿíîå çåðêàëî” (â ïðèñóòñòâèè àëüäåãèäîâ èäåò âîññòàíîâëåíèå ìåòàëëà èç àììèà÷íîãî êîìïëåêñà)

Îáðàçîâàíèå ñóëüôèäà ñåðåáðà ïðè äîáàâëåíèè òèîñóëüôàòà

Îáðàçîâàíèå õðîìàòà ñåðåáðà

Âçðûâ îò íàãðåâàíèÿ àöåòèëåíèäà ñåðåáðà

Îáðàçîâàíèå áðîìèäà è èîäèäà ñåðåáðà

Ñåðåáðî ìîæíî ðàñïëàâèòü õîðîøåé ãàçîâîé ãîðåëêîé

Ïîêàçàòü ïîëíîñòüþ
6
Ðåàêöèÿ ñìåñè æåëåçà è ñåðû îò íàãðåòîé ïàëî÷êè (îáðàçîâàíèå ñóëüôèäà)

Îáðàçîâàíèå ñèëèêàòà æåëåçà, ïðè äîáàâëåíèè õëîðèäà ê ðàñòâîðó ñèëèêàòà íàòðèÿ

Îáðàçîâàíèå êðàñèòåëÿ “Áåðëèíñêàÿ ëàçóðü” ( äîáàâëåíèå êðàñíîé êðîâÿíîé ñîëè ê ðàñòâîðó æåëåçà 2+)

Ðåàêöèÿ “Êðîâàâîå æåëåçî” (æåëåçíàÿ ïðîâîëîêà â ðàñòâîðå òèîöèàíàòà êàëèÿ, ïåðåêèñè è õëîðîâîäîðîäà)

Ãîðåíèå ñòàëüíîé âàòû


