Какие хим свойства основ
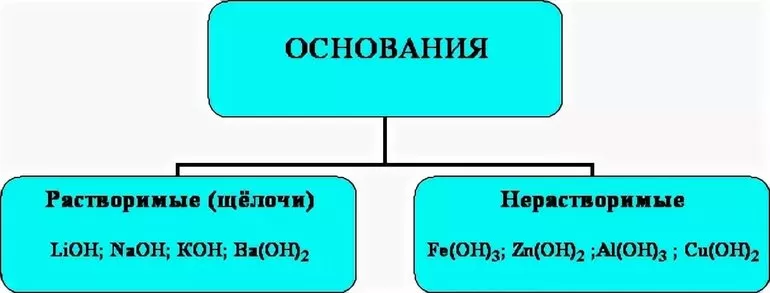
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
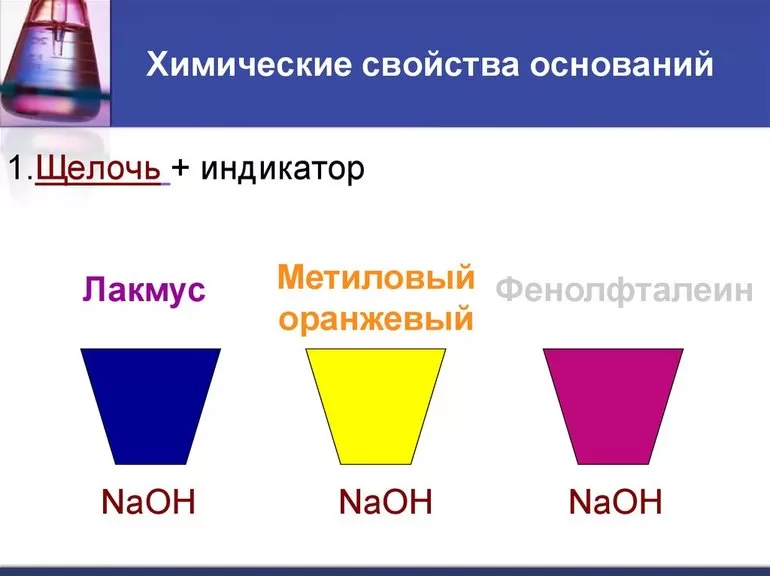
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым |
Универсальный индикатор | Универсальный индикатор становится синим |
Видеофрагмент:
Действие щелочей на индикаторы
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакции обмена между щелочами и кислотами называют реакциями нейтрализации.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+H2O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2H2O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода((IV)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+H2O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода((IV)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора((V)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3H2O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди((II)) образуются сульфат натрия и гидроксид меди((II)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+H2O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди((II)) с серной кислотой образуются сульфат меди((II)) и вода:
Cu(OH)2+H2SO4→CuSO4+2H2O.
Б) При взаимодействии гидроксида железа((III)) с соляной (хлороводородной) кислотой образуются хлорид железа((III)) и вода:
Fe(OH)3+3HCl→FeCl3+3H2O.
Видеофрагмент:
Взаимодействие гидроксида железа((III)) с соляной кислотой
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди((II)) с оксидом серы((VI)) образуются сульфат меди((II)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+H2O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди((II)) образуются оксид меди((II)) и вода:
Cu(OH)2⟶t°CuO+H2O.
Видеофрагмент:
Разложение гидроксида меди((II))
Б) Гидроксид железа((III)) при нагревании разлагается на оксид железа((III)) и воду:
2Fe(OH)3⟶t°Fe2O3+3H2O.
Источник
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
 Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH3 + H2O = NH4OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH)3, Ca(OH)2, Fe(OH)3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
Сильные основания | Слабые основания |
NaOH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) | Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH4OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т.д. (большинство гидроксидов металлов) |
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
 Химические свойства оснований
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 → Na2SiO3 + H2O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H2SO4 → K2SO4 + 2H2O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH)2 = CuO + H2O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Остались вопросы?
Задайте свой вопрос и получите ответ от профессионального преподавателя.
Источник
Немного теории
Кислоты
Кислоты ― это сложные
вещества, образованные атомами водорода, способными замещаться на атомы металла и кислотными остатками.
Кислоты – это электролиты, при диссоциации
которых образуются только катионы водорода и анионы кислотных остатков.
Классификация кислот
Классификация кислот по составу
Кислородсодержащие кислоты | Бескислородные кислоты |
H2SO4 серная кислота H2SO3 сернистая кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота | HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
Классификация кислот по числу атомов водорода
К И С Л О Т Ы | ||
Одноосновные | Двухосновные | Трехосновные |
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
Классификация кислот на сильные и слабые кислоты.
Сильные кислоты | Слабые кислоты |
HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная | HF фтороводородная H3PO4 фосфорная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
Химические свойства кислот
- Взаимодействие с основными оксидами с образованием соли и воды:
- Взаимодействие с амфотерными оксидами с образованием соли и воды:
- Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с солями, если выпадает осадок или выделяется газ:
- Сильные кислоты вытесняют более слабые из их солей:
(в данном случае образуется неустойчивая угольная кислота , которая сразу же распадается на воду и углекислый газ)
- С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
- Кислоты диссоциируют с образованием катиона водорода, что приводит к изменению окраски индикаторов:
– лакмус становится красным
– метилоранж становится красным.
1. водород+неметалл
H2+ S → H2S
2. кислотный оксид+вода
P2O5
+ 3H2O→2H3PO4
Исключение:
2NO2
+ H2O→HNO2 + HNO3
SiO2 + H2O —не реагирует
3. кислота+соль
В продукте реакции должен
образовываться осадок, газ или вода. Обычно более сильные кислоты вытесняют
менее сильные кислоты из солей. Если соль нерастворима в воде, то она реагирует
с кислотой, если образуется газ.
Na2CO3
+ 2HCl→2NaCl + H2O + CO2↑
K2SiO3
+ H2SO4→K2SO4 + H2SiO3↓
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
1. По растворимости в воде.
Растворимые основания
(щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
Практически нерастворимые основания
: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
2. По количеству гидроксильных групп в молекуле.
– Однокислотные (гидроксид натрия NaOH)
– Двукислотные (гидроксид меди(II) Cu(OH)2)
– Трехкислотные (гидроксид железа(III) In(OH)3)
3. По летучести.
– Летучие: NH3
– Нелетучие: щёлочи, нерастворимые основания.
4. По стабильности.
– Стабильные: гидроксид натрия NaOH, гидроксид бария Ba(OH)2
– Нестабильные: гидроксид аммония NH3·H2O (гидрат аммиака).
5. По степени электролитической диссоциации.
– Сильные (α > 30 %): щёлочи.
– Слабые (α < 3 %): нерастворимые основания.
- Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
- Также основание можно получить при взаимодействия щелочного или щелочноземельного металла с водой.
- Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
- Некоторые основания можно получить обменными реакциями:
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
это изменение проявляется в цветах некоторых
кислотно-основных индикаторов:
лакмус становится синим,
метилоранж — жёлтым,
фенолфталеин приобретает цвет фуксии.
- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
Примечание:
реакция не идёт, если и кислота и основание слабые.
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Растворимые основания могут реагировать с амфотерными гидроксидами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Растворимые снования вступают в обменные реакции с растворимыми солями:
Нерастворимые основания при нагреве разлагаются:
Источник

Соединения, с точки зрения распада на ионы, являются электролитами, химические свойства оснований проявляются при растворении в воде, иногда для этого требуется повышенная температура. В результате высвобождаются катионы металлов и ионы гидроксидов ОН-.
Общее понятие
Основания выступают в форме электролитов, в их растворах не содержатся анионы с отрицательным зарядом, исключение составляют гидрид ионы. Основания называются с употреблением слова гидроксид, к которому в родительном падеже добавляется название металла. Например, гидроксид кальция (Cа (ОН) 2). Ориентиром для некоторых оснований являются старые наименования, например, субстанция натрия называется едким натром.
Гидроксид натрия, едкий натр, каустическая сода, натриевая щелочь — так именуется одна и та же субстанция, которая обозначается общей химической формулой Na OH.

Гидрат натрия безводный представляет собой кристаллический порошок белого цвета, при растворении его получается прозрачная жидкость, внешне ничем не отличающаяся от воды.
Если в составе вещества есть гидроксильные группы, которые отсоединяются в виде отдельных атомов при реагировании с другими субстанциями, то такое соединение относится к группе оснований. Множество таких сочетаний содержат гидроксиды с присоединенными к ним атомами различных металлов.
Список примеров гидроксидов:
- натрия NaOH;
- калия КОН;
- железа Fe (OH)3.
Гидроксильные группы являются одновалентными, поэтому легко обозначаются формулами в зависимости от способности металлов образовывать различные химические связи.
При этом к символической записи металла приписывается число групп, которое является эквивалентным валентности вещества. Большая часть основных элементов относится к ионным сочетаниям.
Основные классификации
Основания подразделяются по нескольким признакам. В зависимости от степени разведения в водной среде они бывают растворимыми, практически нерастворимыми и другими.
Примером растворимых субстанций служат гидроксиды лития, натрия, калия, бария, стронция, рубидия и другие соединения. Не растворяются в водной среде при обычных условиях элементы Zn (OH) 2, Al (OH) 3, Mg (OH) 2, Be (OH) 2. К другим видам можно отнести гидрат аммиака NН3Н2О.

По числу содержания функциональных групп в молекулах гидроксидов:
- однокислотные (NaOH);
- двукислотные, например, Cu (OH) 2;
- трехкислотные Fe (OH)3.
Выделяют летучие вещества, например, аммиак, метиламин и нелетучие соединения (нерастворимые основания и щелочи) в зависимости от способности субстанции переходить в газообразное состояние. Гидроксиды делятся на стабильные (бария, натрия) и нестабильные группы (гидраты аммония) по способности работать в равновесии без изменения своей структуры. Выделяются категории с содержанием кислорода, например, гидроксиды стронция и калия, а также бескислородные группы (амины, аммиак).
По типу связей выделяют виды:
- неорганические соединения с включением нескольких серий ОН, иногда содержится одна функциональная группа;
- органические основания представляют гидраты, которые принимают в состав протоны в форме амидинов, аминов и иных сочетаний.

По виду химического реагирования выделяют основные и амфотерные вещества.
Первые проявляют главные характеристики гидратов, вторые субстанции дополнительно еще и кислотные особенности.
Подразделение на нерастворимые и растворимые категории почти всегда совпадает с классификацией слабых и сильных оснований.
Иногда линия аналога проводится между этим делением и разбивкой на металлические гидроксиды и переходные элементы.
Исключается из классификации литий, гидроксид которого отлично растворяется в водном растворе, но представляет собой слабое основание. Сильные элементы легко избавляются от гидроксильных групп, а слабые удерживают функциональные фракции.
Подразделение по силе
Различаются разновидности оснований по степени распада вещества и образования электролитов. Выделяются сильные субстанции (в основном щелочи с показателем a, превышающим 30%) и слабые нерастворимые соединения, у которых индекс a показывает меньше 30%.
Сила гидроксидов выражается в способности отделять протоны от кислотных элементов.
Для характеристики используется константа равновесия при реагировании между кислотами и основаниями, при этом вода используется в качестве реактивной среды.
Увеличение значения константы говорит о прибавлении силы гидроксида, т. е. вещество легко распадается на протоны и другие частицы.
Примеры оснований в зависимости от значения константы:
- к сильным субстанциям относится едкий натр, едкий калий, гашеная известь, гидроксид лития и бария;
- слабые вещества представлены гидроксидами магния, цинка, железа (II и III), аммония, других металлов.
Гидроксид кальция трудно растворяется, но к сильным основаниям (щелочам) относится та его составляющая, которая легко реагирует с водой. Показатель силы требуется для характеристики при взаимодействии оснований с кислотами, особенно слабого типа. Сильные вещества всегда реагируют с любыми видами кислот, при этом мощность последних может быть различной.
Примеры уравнений двух видов реакции:

- 2 NH 4 OH + H 2 S = (NH 4) 2 S +2 H 2 O — слабое основание и кислота при реагировании дают едва ощутимую реакцию с малым числом продуктов.
- 2 Na OH + H 2 S = Na 2 S +2 H 2 O — сильное основное вещество при реакции со слабой кислотой выделяет большее количество компонентов.
При повышении температуры проявляются типичные реакции оснований, происходит разложение на базовые оксиды и воду. Щелочные растворы окрашивают индикаторы в зависимости от их вида. Фенолфталеин получает малиновый оттенок, лакмус реагирует синим цветом, а метил оранжевый становится желтым.
Химические характеристики
Выделяются субстанции, в которых функциональные группы соединяются с катионами, но не спешат взаимодействовать с металлами. Подобное вещество называется гидратом аммония с формулой NH 4 OH. Субстанция получается в результате реакции соединения аммиака и воды, при этом первый полностью растворяется в жидкости: NH 3 + H 2 О= NH 4 O Н.
Основные оксиды, получение которых происходит после реакции со щелочноземельными и щелочными металлами, вступают во взаимодействие с водной средой. В результате образуется щелочь. Например, при контакте оксида кальция с водой получается гидроксид кальция.

Основные оксиды вступают в реакцию с кислотой, в результате появляются два вещества — вода и соль.
Примером служит реакция оксида меди и серной кислоты, итогом служит получение воды и медного сульфата.
Взаимное действие с амфотерными оксидами:
- при плавлении Na OH + Al (OH) 3 = Na Al O 2 +2Н 2 О;
- при действии раствора 2 NaOH + Al 2 O 3 =3 H 2 O +2 Na (Al (ОН) 4).
Основные оксидные группы реагируют с представителями других классов, при этом выделяется соль. Примером служит взаимодействие магниевого оксида с углекислотой с последующим выделением магния карбоната.
Взаимодействие гидроксильных соединений и кислот
Такие реакции входят в совокупность химико-физической теории фундаментального характера и описывают свойства и природу основных веществ и кислот. Эти субстанции представляют два класса веществ, которые вступают в обоюдную реакцию. В свете теории результаты реакции являются предсказуемыми, предвидится появление конечных продуктов после реагирования. Между различными теориями существуют противоречия, которые используют непохожие определения силы кислотных соединений и основных элементов.
Правила предсказания результата реакции отличаются из-за несоответствия критериев оценки реагирующих веществ. Но все существующие теории имеют применение в различных областях народного хозяйствования. Основные и кислотные реакции являются распространенными в природных условиях и широко используются в производстве и научной деятельности. Изначальное представление о кислотах и основных субстанциях главенствуют во всех химических и физических опытах.

Реакция нейтрализации выражается следующими формулами при взаимодействии кислотных элементов и основных веществ:
- 2КОН+Н 2 SO 4 = K 2 SO 4 +2Н 2 О (химические свойства растворимых оснований).
- Mg (OH) 2 +2 H Cl = Mg Cl +2Н 2 О (свойства нерастворимых веществ).
Кислоты представляют собой вещества, которые выделяют в водной среде гидратированные и положительно заряженные катионы водорода, ионы гидроксония и кислотные анионы остатка. Вещества с основными свойствами представляются субстанциями, которые подвергаются диссоциации в воде с получением положительных ионов металлов, анионов или аммония, и выделением гидроксильных анионов ОН-.
Они относятся к группе элементов, распадающихся на анионы остатка или металлические катионы.
При реагировании основных веществ и кислот образуется остаток в виде соли и выделяется вода. На основе современной теории взаимодействия разрабатывается химия неводных и водных электролитических растворов, pH—метрия в безводных средах, кислотно-основных гетерогенных анализов, базового представления кислотных функций и других.
Щелочные растворы
Щелочные растворы на ощупь скользкие и при соприкосновении с кожей разъедают ее.

Они разрушают бумагу, ткань, опасны для человека при попадании в глаза, поэтому используют защитные средства. При попадании щелочи на поверхность тела участок промывают водой, затем обрабатывают слабым раствором уксуса. Этот метод основывается на известном реагировании типа нейтрализации: Na OH + разбавленная уксусная кислота= вода + соль.
Примеры формул для обозначения получения щелочных элементов:
- Для записи реакции воды с активным металлом — 2 Na +2 H 2 O =2 Na OH + H 2; 2 H 2 O + Ca = Ca (OH) 2 + H 2; 2 H 2 O + Mg = Mg (OH) 2 + H 2.
- При обозначении реагирования основных оксидов с водной средой (только щелочноземельные и щелочные металлы) — Na 2 O + H 2 O = 2 Na OH; H 2 O + Ca O = C а (OH) 2.
- Для изложения промышленного производства щелочи (электролиза соляного раствора) — 4Н 2 О 2 Na OH + 2 Na Cl +С l 2+2 H 2.
- При записи реакции соляного раствора со щелочами (единственный вариант получения из нерастворимых веществ) — Ba (OH) 2 + Na 2 SO 4 = Ba SO 2 +2 Na; OH 2 Na OH + Mg SO 4 = Na 2 SO 4 + Mg (OH) 2.
Небольшая часть веществ с основными свойствами относится к щелочам. К ним причисляют сильные гидроксиды калия, натрия, лития, кальция, бария.
Другие субстанции плохо растворяются водой, поэтому не считаются щелочами. Соляные кислоты отщепляют водородные атомы, а вещества с основными свойствами отделяют гидроксильные сочетания. Для реакции нейтрализации годятся любые неметаллы и элементы с проявлением основных свойств, а не только щелочные и щелочноземельные металлы.
Нерастворимые элементы
Веществ с такими свойствами наблюдается в таблице Д. И. Менделеева много. Большинство из них не реагируют с водной средой в обычных условиях.

Оксиды нерастворимых металлов сначала высушиваются, а затем подвергаются нагреванию. Субстанция при термической обработке разлагается на воду и оксид металла.
Гидрат медного оксида представляет собой творожистую субстанцию с голубоватым оттенком, которая не подвергается растворению и не меняет цвет индикатора. При нагревании вещество расщепляется и раствор чернеет, что говорит о появлении оксида меди с выделением воды: Cu (OH) 2 = H 2 O + Cu O.
Гидрофильный оксид железа относится к группе веществ, которые проявляют основные свойства. Гидроксид железа, который появляется в результате реакции окисления, не отличается валентностью III степени и не растворяется в водном растворе. Этот элемент относится к нестойким категориям веществ. При добавлении щелочи выпадает осадок зеленого цвета, который быстро становится темным и изменяется в железистый осадок.
Гидрат оксида железа отличается амфотерными характеристиками, но проявляет кислотные свойства, которые едва выражены. Получается гидрат железа в результате реакции обмена щелочью и солью этого металла. Обратное соединение воды с окисью железа не происходит. Аналогичными особенностями обладает гидрат алюминиевой и цинковой окиси. Общим химическим свойством нерастворимых оснований является распад на воду и оксид металла.
Источник
