Какие характеристики живого связаны со свойствами белков

по теме: «Свойства белков».
Выполнила преподаватель: Пивкина Н.В.
г. Пенза. 2018 г.
Тема: «Свойства белков».
Цель урока: ознакомить студентов со свойствами и функциями белков, их значением в природе.
Задачи урока.
Познавательные. Сформировать знания о свойствах и функциях белков, их ведущей роли в процессах жизнедеятельности; рассказать о физических методах познания природы, в частности биологических микросистем; обобщить знания, получаемые студентами на уроках химии и биологии по теме «Белки», с использованием физических теорий.
Развивающие. Развивать умения анализировать результаты лабораторных опытов, устанавливать причинно-следственные связи между явлениями живой и неживой природы, развивать познавательный интерес студентов на основе межпредметных связей, научить применять знания, получаемые на одном предмете, при анализе явлений или процессов, изучаемых другими предметами.
Воспитательные. Формировать научное мировоззрение, представление о роли естественных наук в современном обществе, целостную картину мира.
Методы: словесные, наглядные, практическая работа.
Оборудование: таблицы, штатив для пробирок, пробирки, лоток, спиртовка, спички, лакмусовая бумажка, картофель (сырой и вареный), мясной бульон, шерстяная нить.
Реактивы: раствор куриного белка, азотная кислота, раствор аммиака, раствор щелочи, раствор сульфата меди, ацетат свинца, этиловый спирт, перекись водорода,
1. Организационный момент.
2. Изучение нового материала.
– Классификация белков.
– Состав белков.
– Свойства белков.
– Белок и окружающая среда
3. Закрепление материала.
4. Итоги урока. Домашнее задание.
Ход урока.
1. Организационный момент.
2. Изучение нового материала.
Учитель. Чем глубже химики познают природу и строение белковых тел, тем более они убеждаются в исключительном значении неисчерпаемых данных для раскрытия одной из важнейших тайн природы – тайны жизни. Раскрытие связи между структурой и функцией в белковых веществах – краеугольный камень, та основа, которая послужит в будущем исходным рубежом для нового качественного скачка в развитии биологии и медицины. Как мы видим, белки имеют сложное строение, молекулы их большие по размерам, молярные массы огромны.

1) К простым белкам (протеинам) относят альбумины, глобулины, гистоны, склеропротеины.
2) К сложным белкам (протеидам) относят: фосфопротеиды (казеин), глюкопротеиды (муцин), нуклеопротеиды, хромопротеиды, липопротеиды, флавопротеиды, металлопротеиды.
Классификация белков по их структуре
1) Фибриллярные белки – в них наиболее важна вторичная структура – нерастворимы в воде, отличаются механической прочностью. К ним относят коллаген и миозин.
2) Глобулярные белки – в них наиболее важна третичная структура. Полипептидные цепи таких белков свернуты в компактные глобулы, они растворимы в воде или солевых растворах, легко образуют коллоидные суспензии. К глобулярным белкам относят ферменты и гормоны.
3) Промежуточные белки – фибриллярной природы, но растворимы в воде, к ним относится фибриноген.
Классификация белков по их функциям
1) Структурные белки – коллаген, склеротин, эластин.
2) Каталитические белки – полимеразы, рибонуклеазы.
3) Регуляторные белки – инсулин, глюкагон.
4) Транспортные белки – гемоглобин, гемоцианин.
5) Защитные белки – антитела, фибриноген.
6) Двигательные, или мышечные, белки – миозин, актин.
7) Запасательные белки – казеин, альбумин.
8) Токсичные белки – змеиный яд, токсины.
9) Сигнальные белки – рецепторы.
Остановимся на двух очень важных функциях белков – каталитической, защитной и структурной.
Сообщения делают заранее подготовленные ученики.
Каталитическая функция белков.
Белки-ферменты катализируют протекание в организме химических реакций. Многие реакции в силу энергетических причин без катализа либо вообще не протекают, либо протекают слишком медленно. Подавляющее большинство биологических катализаторов по своей химической природе является белками.
В молекуле фермента имеется так называемый активный центр. Он состоит из двух участков – сорбционного и каталитического. Первый отвечает за связывание фермента с молекулой субстрата, а второй – за протекание собственно процесса катализа . По своей организации ферменты обладают либо третичной, либо четвертичной белковой структурой.
У живых организмов сформировались две системы иммунитета – клеточная и гуморальная. Такое разделение функций иммунной системы связано с существованием двух типов лимфоузлов – Т-клеток и В-клеток.
Клеточный иммунитет – при взаимодействии с антигеном Т-лимфоциты, несущие на мембране рецепторы, способные распознать этот антиген, начинают размножаться и образуют клон таких же Т-клеток. Клетки этого клона вступают в борьбу с несущими антиген микроорганизмами или вызывают отторжение чужеродной ткани.
В-лимфоциты распознают антиген таким же образом, как и Т-клетки, но реагируют иначе. Они синтезируют антитела, которые нейтрализуют антигены.
Строительная и структурная функция белков.
Студент (сообщение). По определению физика – наука о формах движения и взаимодействия материи. Но сюда же можно включить и различные формы движения и взаимодействия живой материи, поскольку в определении не уточняется, о каких формах материи идет речь. Например, в последнее время ученых интересуют следующие процессы в живых организмах:
– механизм восприятия световой информации;
– распространение нервного импульса;
– прочность костей и сухожилий;
– работа внутренних органов, ее механическая модель;
– явление акустики в живой природе и т.д.
В частности, большой интерес вызывают сократительная и структурная функции белков. Ведь именно в результате взаимодействия белков и процессов, происходящих внутри них, человек двигается в пространстве, сокращается и расслабляется сердце и т.п.
Структурная функция белков заключается в том, что они составляют основу строения организма (коллаген соединительной ткани, кератин волос, ногтей и кожи, эластин соединительной ткани стенок и др.). Именно от этих двух функций белков зависит устройство, масса, надежность и другие параметры живого организма.
.Плотность белков ![]() сравнима со средней плотностью водной оболочки нашей планеты. Это позволяет человеку удерживаться на поверхности воды при минимальныx затратах энергии (уравновешивание силы тяжести и Архимедовой силы – условие плавания тел).
сравнима со средней плотностью водной оболочки нашей планеты. Это позволяет человеку удерживаться на поверхности воды при минимальныx затратах энергии (уравновешивание силы тяжести и Архимедовой силы – условие плавания тел).
Большое значение величины удельной теплоемкости и теплопроводности необходимо живому организму для эффективного отвода избытка энергии из организма за счет теплообмена с окружающей средой. Меньшее значение этих величин привело бы к повышению температуры тела. Проблема переохлаждения решается еще проще.
У животных, обитающих в холодном климате, существует дополнительный жировой слой с низким значением теплопроводности. При смене температуры животное избавляется от жирового запаса, т.е. происходит саморегулирование теплового обмена с окружающей средой.
Итак, белки являются основой всего живого на Земле и выполняют в организмах многообразные функции.
– расщепления сложных молекул (катаболизм) и их синтеза (анаболизм);
– репликации и репарации ДНК и синтезе РНК;
– фермент пепсин, расщепляют белки в процессе пищеварения.
6. Сократительная
Выполняет все виды движений, к которым способны клетки и организмы.
Сокращение и расслабление сердца, движение других внутренних органов.
Сокращение мышц (сгибание,разгибание конечностей).
Движение ресничек и жгутиков.
7. Регуляторная
Регулируют обменные процессы.
Гормоны, например, инсулин (обмен глюкозы),который регулирует концентрацию глюкозы в крови и фактор некроза опухолей, и передаёт сигналы воспаления между клетками организма.
Учитель. Вещества белковой природы известны с давних времен. Начало их изучению положено в середине XVIII в. итальянцем Я.Б.Беккари, который предложил углеродную теорию. Через 100 лет ученые пришли к выводу, что белки – главный компонент живых организмов. Затем из белковых гидролизатов были получены продукты расщепления, и возникла гипотеза о том, что белки состоят из остатков аминокислот (А.Я.Данилевский). Над проблемой строения белков долгое время работал Э.Г.Фишер. На основе его работ была создана полипептидная теория строения белков. Было доказано, что в состав белков входят атомы углерода, водорода, кислорода, азота, серы, фосфора и другие.
Элементный состав белков
Второй тип повреждений – косвенный. В этом случае ущерб биологической структуре наносят реактивные частицы, которые образовались вдали от этой структуры, но приблизились к ней в результате блужданий. При таком типе поражения действие тяжелых частиц менее опасно, т. к. они создают область ионизации небольших размеров.
А вот легкие частицы, создавая небольшую концентрацию свободных ион-радикалов, более опасны. Оказывается, чем меньше концентрация ион-радикалов, тем меньше вероятность их рекомбинации, а это означает увеличение расстояния их прохождения. Возрастает время возможного проявления последствий облучения.
3. Закрепление материала.
Учитель. А теперь ответьте на вопросы.
Вопросы по разделу «Белок и окружающая среда».
1. Какое действие на организм оказывают на молекулярном уровне все виды радиации?
2. Установлено, что при достаточной калорийности пищи, но при отсутствии в ней белка у животных наблюдаются патологические явления: останавливается рост, изменяется состав крови и т.д. С чем это связано?
3. Какие характеристики живого вы связали бы со свойствами белков?
4. Итоги урока.
Учитель. Вот и подошел к концу наш урок. На нем мы попытались объединить разрозненные знания химии, физики и биологии о белках, рассмотрели строение и свойства белков, научились отличать их от других веществ, узнали о воздействии на белок внешних факторов. Вам были предложены вопросы, на которые вы ответили в ходе урока.
5. ДЗ: Учебник О.С. Габриелян
И.Г. Остроумов Химия для профессий и специальностей технического
профиля. Параграф 20.2 стр. 304-309. Ответить на вопросы параграфа.
Всем спасибо за урок!
Источник
Белки – высокомолекулярные соединения, построенные из аминокислот и являются одними из наиболее сложных по строению и составу среди всех органических соединений.
Биологическая роль белков исключительно велика: они составляют основную массу протоплазмы и ядер живых клеток. Белковые вещества находятся во всех растительных и животных организмах. О запасе белков в природе можно судить по общему количеству живого вещества на нашей планете: масса белков составляет примерно 0,01% от массы земной коры, то есть 1016 тонн.
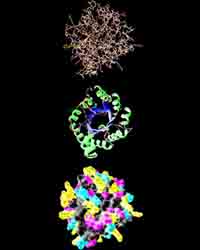 Молекулы белка
Молекулы белка
Белки по по своему элементному составу отличаются от углеводов и жиров: кроме углерода, водорода и кислорода они ещё содержат азот. Кроме того, Постоянной составной частью важнейших белковых соединений является сера, а некоторые белки содержат фосфор, железо и йод.
Свойства белков
1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз – под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
3. Денатурация – частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- – высокой температуры
- – растворов кислот, щелочей и концентрированных растворов солей
- – растворов солей тяжёлых металлов
- – некоторых органических веществ (формальдегида, фенола)
- – радиоактивного излучения
Строение белков
Строение белков начали изучать в 19 веке. В 1888г. русский биохимик А.Я.Данилевский высказал гипотезу о наличии в белках амидной связи. Эта мысль в дальнейшем была развита немецким химиком Э.Фишером и в его работах нашла экспериментальное подтверждение. Он предложил полипептидную теорию строения белка. Согласно этой теории молекула белка состоит из одной длинной цепи или нескольких полипептидных цепей, связанных друг с другом. Такие цепи могут быть различной длины.
Фишером проведена большая экспериментальная работа с полипептидами. Высшие полипептиды, содержащие 15-18 аминокислот, осаждаются из растворов сульфатом аммония (аммиачными квасцами), то есть проявляют свойства, характерные для белков. Было показано, что полипептиды расщепляются теми же ферментами, что и белки, а будучи введёнными в организм животного, подвергаются тем же превращениям, как и белки, а весь их азот выделяется нормально в виде мочевины (карбамида).
Исследования, проведённые в 20 веке, показали, что существует несколько уровней организации белковой молекулы.
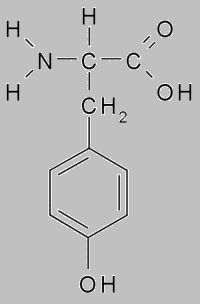 Белок тирозин
Белок тирозин
В организме человека тысячи различных белков и практически все они построены из стандартного набора 20 аминокислот. Последовательность аминокислотных остатков в молекуле белка называют первичной структурой белка. Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков – инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
В настоящее время большая часть работы по определению первичной структуры белков автоматизирована. Так была установлена первичная структура фермента лизоцима.
Тип “укладки” полипептидной цепочки называют вторичной структурой. У большинства белков полипептидная цепь свёртывается в спираль, напоминающую “растянутую пружину” (называют “А-спираль” или “А-стуктура”). Еще один распространённый тип вторичной структуры – структура складчатого листа (называют “B – структура”). Так, белок шёлка – фиброин имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв.
При всём этом практически не существует белков, молекулы которых на 100% имеют “А-структуру” или “B – структуру”.
 Белок фиброин – белок натурального шёлка
Белок фиброин – белок натурального шёлка
Пространственное положение полипептидной цепи называют третичной структурой белкой. Большинство белков относят к глобулярным, потому что их молекулы свёрнуты в глобулы. Такую форму белок поддерживает благодаря связям между разнорзаряженными ионами (-COO- и -NH3+ и дисульфидных мостиков. Кроме того, молекула белка свёрнута так, что гидрофобные углеводородные цепи оказываются внутри глобулы, а гидрофильные – снаружи.
Способ объединения нескольких молекул белка в одну макромолекулу называют четвертичной стуктурой белка. Ярким примером такого белка может быть гемоглобин. Было установлено, что, например, для взрослого человека молекула гемоглобина состоит из 4-х отдельных полипептидных цепей и небелковой части – гема.
Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые – в растворах солей, а некоторые – в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови.
Гидролиз белков
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя в конце цепочки превращения смесь A-аминокислот. Такое расщепление называется гидролизом белка. Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма!
В продуктах гидролиза белков кроме аминокислот были найдены углеводы, фосфорная кислота, пуриновые основания. Под влиянием некоторых факторов например, нагревания,растворов солей, кислот и щелочей, действия радиации, встряхивания, может нарушиться пространственная структура, присущая данной белковой молекуле. Денатурация может носить обратимый или необратимый характер, но в любом случае аминокислотная последовательность, то есть первичная структура, остаётся неизменной. В результате денатурации белок перестаёт выполнять присущие ему биологические функции.
Для белков известны некоторые цветные реакции, характерные для их обнаружения. При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок, которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует.
Ксантопротеиновая реакция заключается в том, что белок от концентрированной азотной кислоты окрашивается в жёлтый цвет. Эта реакция указывает на наличие в белке бензольной группы, которая имеется в таких аминокислотах, как фениланин и тирозин.
При кипячении с водным раствором нитрата ртути и азотистой кислоты, белок даёт красное окрашивание. Эта реакция указывает на наличие в белке тирозина. При отсутствии тирозина красного окрашивания не появляется.
Источник
Белки в живых организмах выполняют разнообразные функции, молекулы этих соединений определяют структуру и форму клетки, обеспечивают узнавание и связывание различных молекул, катализ и регуляцию химических реакций, протекающих в организме.
Функция белка теснейшим образом связана с его пространственной структурой, а она, в свою очередь, зависит от последовательности аминокислот в белке, которая закодирована в гене (ДНК).
1. Одна из важнейших функций белков — каталитическая. При той температуре и кислотности среды, которая характерна для живой клетки, скорость большинства химических реакций мала. Тем не менее реакции в клетке протекают с очень большой скоростью. Увеличение скорости химических реакций достигается за счет функционирования биологических катализаторов — ферментов.
Ферменты — самый крупный и специализированный класс белков. Именно ферменты обеспечивают протекание в клетке многочисленных химических реакций, совокупность которых составляет обмен веществ или метаболизм. В настоящее время известны десятки тысяч различных ферментов.
2. По сравнению с химическими катализаторами ферменты имеют ряд особенностей:
Их каталитическая эффективность необычайно высока: ферменты способны ускорять химические реакции в $mathrm{10^6-10^8}$раз, это значительно выше, чем эффективность химических катализаторов.
Ферменты очень специфичны: обычно фермент катализирует лишь одну реакцию (то есть превращение одного вещества, называемого субстратом) или нескольких реакций одного типа.
Кроме того, активность ферментов в большинстве случаев регулируется различными химическими соединениями, имеющимися в клетке.
Важным свойством некоторых ферментов является способность сопрягать две химические реакции и таким образом осуществлять энергетически невыгодные процессы синтеза сложных веществ за счет энергии, выделяющейся, например, при гидролизе АТФ и других высокоэнергетических соединений.
3. Вторая важная функция белков — это структурная функция. Из структурных белков формируются элементы цитоскелета. К структурным белкам относится, например, фибриллярный белок $beta$-кератин, который образует промежуточные филаменты эпителиальных клеток, входит в состав волос, когтей, рогов и копыт млекопитающих, а также фибриллярный белок коллаген, основной структурный белок соединительной и костной ткани. Химическая структура этих белков, которые выдерживают очень большую нагрузку, идеально приспособлена к выполнению механической функции.
4. Другие типы белков обеспечивают двигательную функцию. По цитоскелетным нитям — микротрубочкам и микрофиламентам — способны АТФ- или ГТФ-зависимо перемещаться моторные белки. Так, по микротрубочкам «ходят» динеины и кинезины, а по актиновым нитям — миозин. Актин и миозин входят не только в сократимые волокна мышечных клеток — миофибриллы, но и участвуют в изменении формы других типов клеток.
Рис. 1. Кинезин — моторный белок, «шагающий» по микротрубочке
5. Некоторые белки выполняют транспортную функцию.
а) Прежде всего, это белки мембран, осуществляющие активный перенос веществ из окружающей среды в клетку и обратно. К транспортным белкам относятся также некоторые белки, встроенные в биологические мембраны и формирующие в них поры (каналы).

Рис. 2. Структура калиевого канала, встроенного в мембрану
б) Это также белки крови, которые связывают и переносят различные вещества. Наиболее известным из транспортных белков является гемоглобин, который осуществляет перенос кислорода из легких в ткани.

Рис. 3. Структура гемоглобина: 4 субъединицы (тетрамер), каждая их которых содержит гем с ионом $Fe^{2+}$
Помимо кислорода с кровью переносятся и другие вещества: сывороточные липопротеиды переносят с током крови липиды, а сывороточный альбумин — свободные жирные кислоты. Ионы железа переносятся белком трансферрином, а ионы меди — белком церулоплазмином.
6. Белки способны также осуществлять защитную функцию. При попадании в организм животных или человека вирусов, бактерий, чужеродных белков или других полимеров в организме происходит синтез белков, которые называют антителами, или иммуноглобулинами. Антитела связываются с чужеродными полимерами, которые называют антигенами.

Рис. 4. Антитело (гамма-глобулин) обладает четвертичной структурой, состоит из 2 тяжелых и 2 легких цепей и имеет 2 центра связывания антигена
7. Многие живые существа (растения, грибы, бактерии, беспозвоночные, рыбы, амфибии, змеи) для обеспечения защиты и нападения выделяют также белки и пептиды, называемые токсинами. Эти белки подавляют жизненно важные процессы в клетках других организмов, могут разрушать определенные клеточные полимеры, что приводит к гибели организма.
8. Еще одной важной функцией белков является регуляторная.
а) Прежде всего, эту функцию выполняют белки — активаторы и репрессоры генов.
б) Кроме того, специализированные белки регулируют активность ферментов.
в) В специализированных клетках животных осуществляется синтез биологически активных веществ, поступающих непосредственно в кровь, — гормонов. Гормоны способны в очень малых концентрациях обеспечивать регуляцию метаболизма. Часть гормонов (но не все) являются пептидами или белками. Наиболее известным из белковых гормонов является инсулин — гормон, вырабатываемый в поджелудочной железе и регулирующий уровень глюкозы в клетках организма. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.

Рис. 5. Гексамер (6 молекул) инсулина, скоординированные ионом цинка, — основная биологически активная форма этого гормона. Желтым показаны дисульфидные мостики, которые стабилизируют структуру инсулина. Фиолетовые — остатки гистидина, связывающиеся с цинком
К белковым гормонам относятся и гормоны, продуцируемые передней долей гипофиза: гормон роста соматотропин, пролактин. Задняя доля гипофиза выделяет пептидные гормоны окситоцин и вазопрессин, каждый из которых состоит из восьми аминокислот и регулирует сокращение мускулатуры матки и сосудов соответственно.
г) Многие клетки в организме выделяют белки и пептиды, являющиеся биологически активными соединениями, которые влияют на функции соседних клеток. К ним, в частности, относятся многочисленные факторы роста, которые регулируют рост и развитие клеток определенных тканей, например фактор роста нервной ткани, фактор роста фибробластов.
д) Большая часть биологически активных соединений, оказывающих биологических эффект в очень низких концентрациях, в том числе гормоны и факторы роста, связываются со специфическими рецепторами, которые являются белками, часто гликопротеинами.
У каждого рецептора есть свой лиганд — вещество, с которым он связывается с крайне высокой специфичностью. Связывание биологически активного вещества (например, гормона или фактора роста) с соответствующим рецептором приводит к изменению конформации (пространственной структуры) рецептора, что является сигналом, инициирующим внутриклеточный каскад передачи сигнала. Результат работы каскада — изменение активности ферментов или генов.

Рис. 6. Рецептор глутамата — медиатора в нервной системе. Видна внеклеточная часть, связывающая лиганд — глутамат, трансмембранная часть и внутриклеточная часть, передающая сигнал в клетку

Рис. 7. Мембрана и встроенный в нее рецептор
Таким образом, биологически активные вещества белковой природы и их рецепторы обеспечивают регуляторную функцию белков.
9. Кроме того, белки пищи для животных выполняют энергетическую функцию и функцию источника незаменимых аминокислот. При голодании собственные белки используются в качестве энергетического субстрата в последнюю очередь — когда израсходованы запасы гликогена и жира. Это может приводить к падению мышечной массы, заболеваниям кожи, возникновению язв и др.
10. В ряде случаев белки выполняют запасающую функцию. Чаще всего это происходит в структурах, связанных с размножением. Такие белки откладываются в семенах многих растений (алейроновые зерна), в яйцах животных (овальбумин).
Таким образом, белки выполняют все основные функции в живом организме, кроме функций хранения и передачи наследственной информации.
основы ферментативного катализа
Катализаторы — это вещества, которые ускоряют реакции, но сами при этом не расходуются. В живых клетках основным и катализаторами являются ферменты. Очень немногие реакции катализируются молекулами РНК, такие РНК называются рибозимы.
Принцип работы катализатора связан со снижением энергии активации — энергии, которой должны обладать молекулы, чтобы вступить в реакцию. Без катализатора очень малая часть молекул при физиологических условиях имеет достаточно энергии, чтобы вступить в реакцию. Катализатор понижает активационный барьер, и благодаря этому больше молекул могут его преодолеть.

Рис. 8
Принцип действия ферментов основан на очень специфичном узнавании ферментом своего субстрата (исходного вещества в реакции) или нескольких субстратов и эффективном связывании. Молекулы фермента, как правило, очень велики по сравнению с молекулами низкомолекулярных субстратов (или отдельных участков высокомолекулярных субстратов, с которыми они работают). В связывании участвует только небольшой участок фермента — активный центр, который обычно имеет вид «кармана», куда «прячется» субстрат.
Рис. 9
Связывание фермент-субстрат описывали моделью «ключ-замок», однако согласно современным данным, конформация (пространственная структура) и субстрата, и фермента меняется в результате этого связывания, поэтому предложена новая модель — модель индуцированного соответствия, или модель «рука-перчатка». Именно благодаря изменению структуры субстрата при связывании с ферментом снижается энергия активации — измененный субстрат в активном центре фермента находится в напряженном, высокоэнергетическом переходном состоянии и легче переходит в продукт. Таким образом, роль фермента состоит в стабилизации переходного состояния субстрата.
Ферментативный катализ можно описать уравнением:
$E + A -> [EA] -> [EP] -> E + P,$
где E — фермент (enzyme); A — субстрат; P — продукт; [EA] — временный комплекс фермента с субстратом, [EP] — временный комплекс фермента с продуктом.
Таким образом, видно, что фермент и вступает в реакцию, и образуется в результате, т. е. в итоге не расходуется.
Специфическое связывание субстрата возможно благодаря расположению определенных аминокислотных радикалов на внутренней поверхности активного центра фермента. Остатки, несущие положительный или отрицательный заряд, взаимодействуют с разноименно заряженными группами субстрата, гидрофобные остатки — с его гидрофобными частями. За счет точного пространственного соответствия создается высокоспецифичная поверхность взаимодействия. Благодаря этому ферменты способны «отличать» свой субстрат от очень близких по строению веществ, а также «различать» оптические изомеры, взаимодействуя только с одним из них (этим объясняется поддержание хиральной чистоты, см. тему «Хиральность и оптическая изомерия биомолекул»).
регуляция активности ферментов
В зависимости от конкретных условий внешней и внутренней среды активности ферментов должны меняться в рамках поддержания гомеостаза — постоянства физико-химических параметров внутренней среды клетки и организма. Так, при поступлении глюкозы в кровь должны активироваться ферменты синтеза гликогена, в виде которого глюкоза запасается, а также ферменты гликолиза — начального этапа окисления глюкозы при клеточном дыхании.
Регуляция бывает двух типов:
положительная регуляция — активация (повышение активности фермента);
отрицательная регуляция — ингибирование (понижение активности фермента).
Различают два типа регуляции активности ферментов: конкурентное ингибирование и аллостерическая регуляция.
конкурентные ингибиторы
Конкурентные ингибиторы «имитируют» субстрат, но не вступают в химическую реакцию. «Мимикрируя» под субстрат, они занимают активный центр фермента и вытесняют субстрат из него, вследствие чего ингибируют реакцию. Иногда они связываются с ферментом очень прочно — тогда наступает необратимое ингибирование. Такие ингибиторы часто являются опасными ядами. Например, фосфорорганические соединения зарин, зоман, V-газы — боевые отравляющие вещества — ингибируют фермент ацетилхолинэстеразу (АХЭ), расщепляющую медиатор ацетилхолин в синаптической щели, что приводит к блокировке передачи нервного импульса. Другие фосфорорганические соединения, слабо токсичные для позвоночных, используются в качестве инсектицидов.
аллостерическая регуляция
Слово «аллостерический» означает «в другом месте» (греч. «аллос» — другой, «стерос» — место). Аллостерические регуляторы могут быть как активаторами, так и ингибиторами, и действуют, связываясь с ферментом не в активном центре, а в другом участке его структуры, который в этом случае называют аллостерическим центром.
Очень распространенными аллостерическими регуляторами ферментов метаболизма являются АТФ и АДФ. Соотношение концентраций АТФ и АДФ характеризует энергетический статус клетки. Так, АТФ ингибирует некоторые ферменты гликолиза (окисления глюкозы), т. к. энергии в клетке уже много. АДФ, напротив, активирует ферменты гликолиза (энергии мало, ее нужно быстрее получать окислением глюкозы). Определенные ферменты практически всех метаболических путей ингибируются конечным продуктом, получающимся в результате протекания реакций этого пути (можно сказать, чтобы этого продукта не синтезировалось слишком много).
В данном случае работает универсальный принцип отрицательной обратной связи, за счет которого поддерживается гомеостаз в биологических системах. Смысл его в том, что при любом отклонении параметров система саморегулируется так, чтобы свести отклонение к минимуму. Если есть избыток какого-то вещества — ингибируется (замедляется) его синтез и активируется расход. При недостатке определенного вещества активируется его синтез и ингибируется расход.
Источник
