Какие группы оксидов проявляют амфотерные свойства
Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]

4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Источник
Анонимный вопрос
30 мая 2019 · 35,6 K
Амфотерными называются элементы, которые в соединениях проявляют свойства металлов и неметаллов. К ним относятся элементы А-групп Периодической системы – Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп – Cr, Mn, Fe, Zn, Cd, Au и др.
Оксиды и гидроксиды этих соединений, соотвественно, будут амфотерными.
Сурьма, железо, висмут, марганец, не амфотерны, они относятся не к 4, а к 5 аналитической группе, их гидроксиды не… Читать дальше
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Амфотерные оксиды – это оксиды, у которых элемент в степени окисления +3 или +4
Например, Al2O3, ТiO2, Cr2O3, Fe2O3, PbO2
☘️Но☝️
ZnO, BeO тоже амфотерные, хотя Zn и Be в степени окисления +2. Это нужно запомнить)
☘️Гидроксиды, которые соответствуют амфотерными оксидам, тоже амофотерны ????
Какая кислота или щёлочь является самой “кислой” и разрушающей?
Существует целое семейство так называемых суперкислот, одна сильнее другой, и их можно условно подразделить на две подкатегории. Для части суперкислот придуманы материалы, способные хранить эти вещества, а для другой части таких материалов нет, и эти кислоты должны быть синтезированы непосредственно перед применением, по возможности непосредственно в реакторе, в котором должны быть применены.
К хранимым кислотам относится карборановая кислота — в миллион раз сильнее 100 % серной.
К нехранимым кислотам относится гексафтороантимонат (V) фторония H2SbF7. образующийся из гексафтороантимоната водорода в реакции с плавиковой кислотой. Сильнее серной кислоты в квинтиллион раз (в триллион раз сильнее карборановой кислоты).
Прочитать ещё 2 ответа
Как получить гидроксид кальция?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
Что такое гидроксид кальция? ????
Это сильное растворимое в воде основание)
☘️Химическая формула: Ca(OH)2
☘️Белый порошок
Как его получить?????⚗️
????Растворением щелочного металла в воде
Ca+2H2O=Ca(OH)2+H2⬆️
????Взаимодействием воды с оксидом
CaO+H2O=Ca(OH)2
Прочитать ещё 1 ответ
Как проходит гидролиз фосфата натрия?
Engineer – programmer ⚡⚡ Разбираюсь в компьютерах, технике, электронике, интернете и… · zen.yandex.ru/gruber
Гидролиз фосфата натрия (Na3PO4) представляет собой взаимодействие Na3PO4 с водой (H2O). Другими словами, гидролиз — это разложение вещества водой.
Протекает он в щелочной среде и гидролизуется по аниону.
Молекулярное уравнение гидролиза фосфата натрия:
Na3PO4 + H2O -> Na2HPO4 + NaOH
Прочитать ещё 1 ответ
С чем взаимодействуют кислоты?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
???? Растворы кислот кислые на вкус, изменяют окраску индикаторов:
???? лакмуса в красный цвет
????метилового оранжевого – в розовый
цвет фенолфталеина не изменяется
ХИМИЧЕСКИЕ СВОЙСТВА
???? Взаимодействуют с металлами
▫️Ca + 2HCl = CaCl2 + H2
⚠️ Металл должен стоять левее водорода в ряду напряжений
⚠️ Кислоты-окислители – азотная и серная конц., реагируют с металлами по-другому
????Реагируют с основными оксидами:
▫️CaO + 2HCl = CaCl2 + H2O
????С основаниями (реакция нейтрализации):
▫️H2SO4 + 2KOH = K2SO4 + 2H2O
????С солями (не обязательно растворимыми в воде):
▫️Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
⚠️ Реакция пойдёт только при условии выделения газа или выпадения осадка
???? У кислот есть и специфические свойства, которые связаны с окислительно-восстановительными реакциями
Прочитать ещё 1 ответ
Какие вещества называют оксидами?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Оксиды это соединения различных химических элементов с кислородом. При этом кислород находистя в опредленной степени окисления. В реакцию с кислородом могут вступать и металлы, и неметаллы. Чаще всего в результате реакций с неметаллами образуются кислотные оксиды, а с металлами – основания.
Источник
Тема № 10.
Химические свойства оксидов: основных, амфотерных, кислотных
Рекомендуемые видеоуроки
Теоретические сведения
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом
Номенклатура оксидов
Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
NaI2O – оксид натрия; СаIIО – оксид кальция;
SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
Классификация оксидов
По химическим свойствам оксиды делятся на две группы:
1. Несолеобразующие (безразличные) – не образуют солей, например: NO, CO, H2O;
2. Солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
Основные оксиды
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
Основным оксидам соответствуют основания.
Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Химические свойства основных оксидов
1. Основные оксиды взаимодействуют с водой с образованием оснований.
Условие протекания реакции: должны образовываться растворимые основания!
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Al2O3 + H2O → реакция не протекает, так как должен образовываться Al(OH)3, который нерастворим.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2→ CaSiO3
4. Взаимодействие с амфотерными оксидами:
СaO + Al2O3 → Сa(AlO2)2
Кислотные оксиды
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты.
Например, оксиду серы (IV) соответствует сернистая кислота H2SO3.
Химические свойства кислотных оксидов
1. Взаимодействие с водой с образованием кислоты:
Условия протекания реакции: должна образовываться растворимая кислота.
P2O5 + 3H2O → 2H3PO4
2. Взаимодействие со щелочами с образованием соли и воды:
Условия протекания реакции: с кислотным оксидом взаимодействует именно щелочь, то есть растворимое основание.
SO3 + 2NaOH → Na2SO4 + H2O
3. Взаимодействие с основными оксидами с образованием солей:
SO3 + Na2O → Na2SO4
Амфотерные оксиды
Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными.
Например: оксид алюминия Al2O3, оксид марганца (IV) MnO2.
Химические свойства амфотерных оксидов
1. C водой не взаимодействуют
2. Взаимодействие с кислотными оксидами с образованием солей при сплавлении (основные свойства):
ZnO + SiO2 → ZnSiO3
3. Взаимодействие с кислотами с образованием соли и воды (основные свойства):
ZnO + H2SO4 → ZnSO4 + H2O
4. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды (кислотные свойства):
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2NaOH → 2NaAlO2 + H2O
5. Взаимодействие с основными оксидами (кислотные свойства):
Al2O3 + CaO → Ca(AlO2)2
Интернет-источники
Источник
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
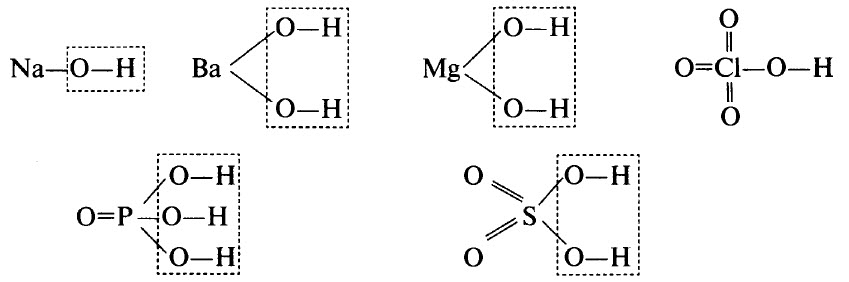
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:

ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
Источник
Понятие об
амфотерных оксидах и гидроксидах
Первоначальная классификация химических элементов на металлы и неметаллы является
неполной. Существуют химические элементы и соответствующие им вещества, которые
проявляют двойственную природу – амфотерные свойства. Могут
взаимодействовать как с кислотами и кислотными оксидами, так и с основаниями и
основными оксидами, например,
а)
2Al(OH)3 + 3SO3 = Al2(SO4)3 +
3H2O
Al2O3 + 3H2SO4 =
Al2(SO4)3 + 3H2O
б)
2Al(OH)3 + Na2O = 2NaAlO2 +
3H2O
Al2O3 + 2NaOH = 2NaAlO2 +
H2O
Al(OH)3 ↔ H3AlO3 (ортоалюминиеваякислота) –H2O↔ HAlO2 (метаалюминиеваякислота), здесь AlO2 (I) – одновалентныйкислотныйостатокметаалюминат
Так,
гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов
и оксидов, т.е. реагируют с кислотными гидроксидом и оксидом, образуя
соответствующую соль – сульфат алюминия Al2(SO4)3,
тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов
и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль –
метаалюминат натрия NaAlO2. Если указанные реакции протекают в
водном растворе:
Al(OH)3 + NaOH = Na[Al(OH)4]
Другой
пример,
а)
Zn(OH)2 + SO3 = ZnSO4 + H2O
ZnO + H2SO4 = H2O
+ ZnSO4
б)
Zn(OH)2 + Na2O = Na2ZnO2 +
H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
Zn(OH)2↔H2ZnO2,
здесь ZnO2(II) – двухвалентный кислотный остаток цинкат.
Оксиды и
гидроксиды, которые способны реагировать и с кислотами, и со щелочами, называют
амфотерными.
Химические
элементы, которым соответствуют амфотерные оксиды и гидроксиды, обладают
переходными химическими свойствами, не относящимися ни к металлам, ни к
неметаллам, их называют амфотерными.
Амфотерность (от греч. amphoteros
– и тот, и другой) – способность химических соединений проявлять и кислотные, и
основные свойства в зависимости от природы реагента, с которым амфотерное
вещество вступает в кислотно-основное взаимодействие. Амфотерные оксиды и
гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные
свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным
оксидам соответствуют амфотерные гидроксиды, например,
ВeО – Вe(ОН)2,
Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Они являются слабыми
кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и
гидроксиды металлов, в которых валентность металла III, IV иногда II.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3,
SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных
подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и
некоторые другие.
Оксиды и гидроксиды, в которых валентность металла III, IV, являются,
как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3
и Fe(OH)3. Однако последние элементы в декадах d–элементов
(например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях
окисления, например, ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
(нерастворимы в воде)
Амфотерный гидроксид | Кислотный остаток (А) | Оксид |
Zn(OH)2 | со щелочами проявляет кислотные H2ZnO2↔ZnO2 (II) кислотный остаток – цинкат | ZnO |
Al(OH)3 | со щелочами проявляет кислотные HAlO2↔AlO2 (I) кислотный остаток – метаалюминат | Al2O3 |
Be(OH)2 | со щелочами проявляет кислотные H2BeO2↔BeO2 (II) кислотный остаток – бериллат | BeO |
Cr(OH)3 | со щелочами проявляет кислотные HCrO2↔CrO2 (I) кислотный остаток – хромат | Cr2O3 |
1.Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2.Реагируют со щелочами: Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Видео “Амфотерные свойства гидроксида алюминия”
Видео “Получение и химические свойства амфотерных
гидроксидов”
Тренажёр “Амфотерные свойства оксида алюминия”
Тренажёр – виртуальная лаборатория “Амфотерные свойства оксида алюминия”
Применение
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид
алюминия:
·
лекарственные препараты, приготовленные на
основе гидроксида алюминия, врач назначает при нарушении
кислотно-щелочного баланса в пищеварительном тракте;
·
в качестве антипирена (средства для
подавления способности гореть) вещество вводят в состав пластмасс и красок;
·
путём разложения гидроксида алюминия в
металлургии получают оксид алюминия (глинозём) — сырьё для получения
металлического алюминия.
Товары, в
производстве которых используется гидроксид алюминия: лекарственный препарат
«Алмагель» и металлургический глинозём
Гидроксид цинка в
промышленности служит сырьём для получения различных соединений этого металла,
в основном — солей.
Источник
