Какие физическими свойствами характеризуются вещества с ионными

Ken Ba
12 декабря 2018 · 5,2 K
- Такие соединения очень прочные, с энергией 300-700 кДж
- Связи в таких соединениях ненаправленные и ненасыщенные
- В процессе образования молекул с ионной связью не происходит полной передачи электронов, поэтому стопроцентной ионной связи в природе не существует.
- Такие соединения твердые кристаллические вещества с высокой температурой плавления и кипения
- Большая часть таких соединений растворяется в воде, а их растворы проводят электрический ток
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Что такое ионная связь?????
Это связь,которая образуется между катионами и анионами за счёт их притяжения
????Свойства соединений с ионной связью????
✅Прочная связь( энергия ионной связи равна примерно 300-700кДж/моль)
✅Ионные соединения растворяются в воде
✅На самом деле ,чистой ионной связи не существует(соединения имеют несколько видов связей)
✅Распла… Читать далее
Как расставлять заряды ионов и Степень Окисления в Веществах?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
Что такое ион? ????
Это частица, которая образуется из атома, если ему подарят электроны????ну или отберут их????
Есть элементы, которые имеют всегда один и тот же заряд иона) у других надо смотреть по обстоятельствам????
Они находятся в 1А,2А и 3А группах в таблице Менлелеева????
????Если 1 группа А подгруппа, то всегда +1 (у них достаточно забрать всего один электрон????)
????Если 2А, то +2 (отбирают уже 2 электрона)
????Если 3А,то +3
????Что такое степень окисления? ????
Это условная величина, которая показывает заряд атома в соединении)
Максимальная степень окисления равна номеру группы, минимальная N группы-8????????
Возьмём для примера Na2SiO3????
Na имеет степень окисления +1, он лежит в 1А группе
О имеет всегда – 2,хотя и находится в 6А???? Это нужно запомнить
У Si +4, он лежит в 4А группе
А теперь с зарядами ионов разберемся)
У Na +1, но в Na2SiO3 таких ионов 2????
Значит, получаем SiO3 2-
Прочитать ещё 1 ответ
В какой молекуле наиболее прочная химическая связь?
– Внутре! Внутре смотрите, где у нея анализатор и думатель.
– Высочайшие…
Межатомная связь в молекуле азота является самой прочной из всех внутримолекулярных связей, потому что эта связь тройная. Три неспаренных электрона одного атома азота образуют связь с тремя неспаренными электронами другого атома азота – N ≡N
Прочитать ещё 1 ответ
Почему в некоторых соединениях элементы могут менять валентность?
Учёный по призванию и химик по образованию. Люблю помогать находить истину и…
Чтобы разобраться – придется перейти на новый уровень. В данном случае – рассматривать теорию комплексных соединений.
Если Вы посмотрите заряд, то он у алюминия все так же +3, но дело в том, что алюминий находится в 3м периоде, 13й группе – у него (иона) целых 8 свободных орбиталей. На эти вакантные отрбитали могут встать неподеленные пары электронов кислорода – образуется донорно-акцепторная связь. Получившуюся по такому механизму сложную частицу называют комплексом (в данном случае – комплексный ион), ион металла – центральным атомом/ионом, а гидроксид-анионы – лигандами.
Получившаяся частица относительно устойчива, т.к. донорно-акцепторные связи напоминают ковалентные по своей природе, но все же легко разрушаются. Более известный пример донорно-акцепторной связи – ион аммония – там тоже у азота валентность 4 при степени окисления -3.
Комплексов вообще известно много, наиболее простые примеры – комплексы 3d – металлов.
Могут ли или существуют ли вещества во Вселенной, которых нет в таблице Менделеева?
ALBA synchrotron, postdoc
Безусловно. Потому что в таблице Менделеева вообще нет веществ, там только элементы.
Могут ли быть элементы, которых нет в таблице Менделеева? Тоже да. Можно делать атомы не только из протонов, нейтронов и электронов. Есть позитроний, есть мюоний, есть мюонные атомы. Для них в принципе нет места в таблице, но их умеют делать и даже заставлять вступать в реакции.
Далее, по сути, любая нейтронная звезда – это огромное атомное ядро, при желании можно прикинуть количество оставшихся в живых после коллапса протонов и выдать получившемуся атому полагающееся ему место в периодической системе.
Прочитать ещё 2 ответа
Источник
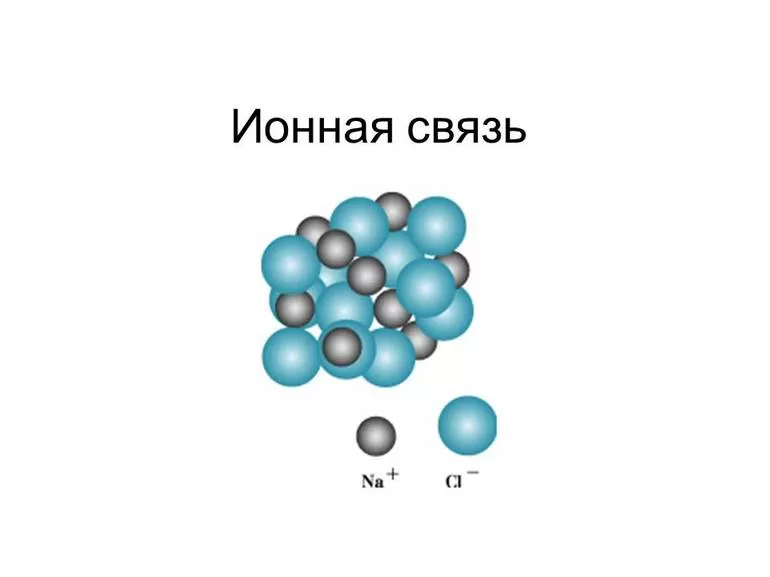
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия.
Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Вещества с ионной кристаллической решеткой обладают следующими свойствами:
1. Относительно высокой твердостью и прочностю;
2. Хрупкостью;
3. Термостойкостью;
4. Тугоплавкостью;
5. Нелетучестью.
Примеры: соли – хлорид натрия, карбонат калия, основания – гидрооксид кальция, гидрооксид натрия.
4. Механизм образования ковалентной связи (обменный и донорно-акцепторный).
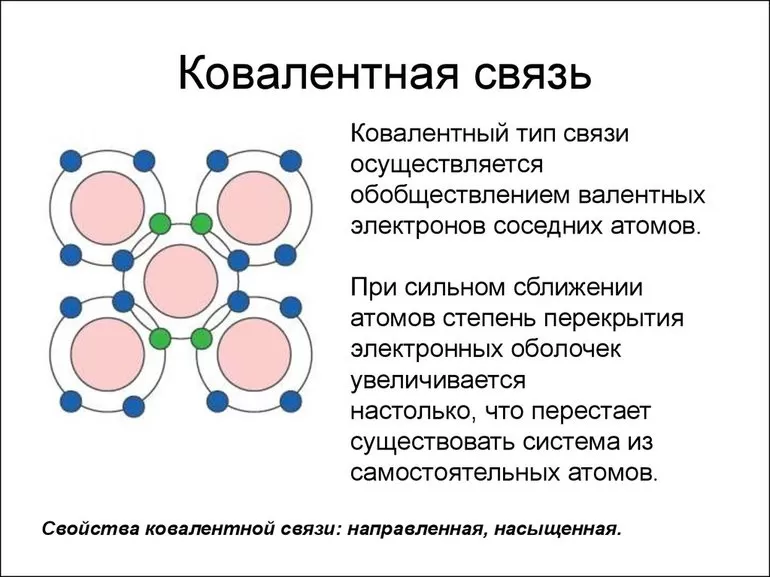
Каждый атом стремится завершить свой внешний электронный уровень, чтобы уменьшить потенциальную энергию. Поэтому ядро одного атома притягивается к себе электронную плотность другого атома и наоборот, происходит наложение электронных облаков двух соседних атомов.
Демонстрация аппликации и схемы образования ковалентной неполярной химической связи в молекуле водорода. (Учащиеся записывают и зарисовывают схемы).
Вывод: Связь между атомами в молекуле водорода осуществляется за счет общей электронной пары. Такая связь называется ковалентной.
Прочитать стр. 33 в учебнике и записать определение.
Какую связь называют ковалентной неполярной? (Учебник стр. 33).
Составление электронных формул молекул простых веществ неметаллов:
•• ••
•• CI •• CI •• – электронная формула молекулы хлора,
•• ••
CI — CI – структурная формула молекула хлора.
••
•• N •• N •• – электронная формула молекулы азота,
••
N ≡ N – структурная формула молекулы азота.
Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
Но молекулы могут образовывать и разные атомы неметаллов и в этом случае общая электронная пара будет смещаться к более электроотрицательному химическому элементу.
Изучить материал учебника на стр. 34
Вывод: Металлы имеют более низкое значение электроотрицательности, чем неметаллы. И между ними она сильно отличается.
Демонстрация схемы образования полярной ковалентной связи в молекуле хлороводорода.
Общая электронная пара смещена к хлору, как более электроотрицательному. Значит это ковалентная связь. Она образована атомами, электроотрицательности которых несильно отличаются, поэтому это ковалентная полярная связь.
Составление электронных формул молекул йодоводорода и воды:
••
H •• J •• – электронная формула молекулы йодоводорода,
••
H → J – структурная формула молекулы йодоводорода.
••
H •• O •• – электронная формула молекулы воды,
••
H
Н →О – структурная формула молекулы воды.
↑
Н
Самостоятельная работа с учебником: выписать определение электроотрицательности.
Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками
Самостоятельная работа с учебником.
Вопросы для самоконтроля
– Атом, какого химического элемента имеет заряд ядра +11
– Записать схему электронного строения атома натрия
– Внешний слой завершен?
– Как добиться завершения заполнения электронного слоя?
– Составить схему отдачи электрона
– Сравнить строение атома и иона натрия
– Сравнить строение атома и иона инертного газа неона.
– Определить атом, какого элемента с количеством протонов 17.
– Запишите схему электронного строения атома.
– Слой завершен? Как этого добиться.
– Составить схему завершения электронного слоя хлора.
Задание по группам:
1-3 группа: Cоставьте электронные и структурные формулы молекул веществ и укажите тип связи Br2 ; NH3.
4-6 группы: Cоставьте электронные и структурные формулы молекул веществ и укажите тип связи F2 ; HBr.
Два ученика работают у дополнительной доски с этим же заданием для образца к самопроверке.
Устный опрос.
1. Дайте определение понятия «электроотрицательность».
2. От чего зависит электроотрицательность атома?
3. Как изменяется электроотрицательность атомов элементов в периодах?
4. Как изменяется электроотрицательность атомов элементов в главных подгруппах?
5. Сравните электроотрицательность атомов металлов и неметаллов. Отличаются ли способы завершения внешнего электронного слоя, характерные для атомов металлов и неметаллов? Каковы причины этого?
7. Какие химические элементы способны отдавать электроны, принимать электроны?
Что происходит между атомами при отдаче и принятии электронов?
Как называют частицы, образовавшиеся из атома в результате отдачи или присоединения электронов?
8. Что произойдет при встрече атомов металла и неметалла?
9. Как образуется ионная связь?
10. Химическая связь, образуемая за счет образования общих электронных пар называется …
11. Ковалентная связь бывает … и …
12. В чем сходство ковалентной полярной и ковалентной неполярной связи? От чего зависит полярность связи?
13. В чем различие ковалентной полярной и ковалентной неполярной связи?
ПЛАН ЗАНЯТИЯ № 8
Дисциплина: Химия.
Тема:Металлическая связь. Агрегатные состояния веществ и водородная связь.
Цель занятия: Сформировать понятие об химических связях на примере металлической связи. Добиться понимания механизма образования связи.
Планируемые результаты
Предметные: формировании кругозора и функциональной грамотности человека для решения практических задач; умение обрабатывать, объяснять результаты; готовность и способность применять методы познания при решении практических задач;
Метапредметные: использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1. Металлическая связь. Металлическая кристаллическая решетка и металлическая химическая связь.
2. Физические свойства металлов.
3. Агрегатные состояния веществ. Переход вещества из одного агрегатного состояния в другое.
4. Водородная связь
Оснащение: Периодическая система химических элементов, кристаллическая решетка, раздаточный материал.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 – изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Источник
Ключевая информация
В химической науке существует четыре основных типа связи — ковалентная, ионная, металлическая и водородная. Металлическая возникает между элементами-металлами, водородная — между молекулами, состоящими из водорода и атомов с высокой электроотрицательностью (азотом, кислородом, фтором).
Самые разнообразные соединения относятся к ковалентной и ионной связям, которые представляют по своему составу смешанный тип. Для ионной связи ковалентная в определенном смысле выполняет материнскую функцию.
Наиболее частым и распространенным видом химической связи считается именно ковалентная. Это соединение, в процессе формирования которого обобществляется (перекрывается) пара валентных электронных облаков. Количество таких связей, образованных атомом элемента, — это показатель ковалентности.
Ковалентная связь бывает двух типов — неполярная и полярная. Определяющими факторами для типа связи служат значения электроотрицательности взаимодействующих атомов химических элементов. Если эти показатели у атомов:
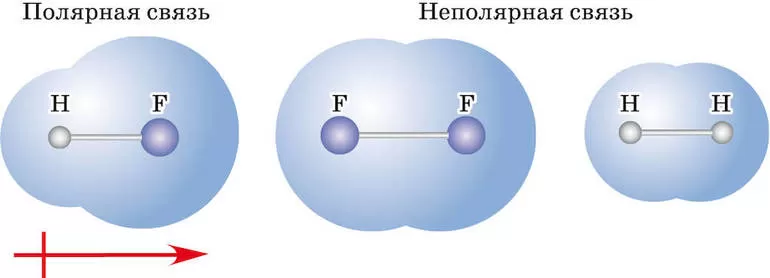
- равны или примерно равны (разница между значениями по шкале Полинга — до 0,4) — это ковалентная неполярная связь (общая электронная пара не смещается ни к одному из атомов);
- отличаются, но не сильно (разница от 0,4 до 1,7) — это ковалентная полярная связь (электронная пара смещается к одному из участвующих атомов);
- отличаются сильно (разница более 1,7) — это ионная связь (один или несколько электронов не просто смещаются, а почти полностью переходят к другому атому, причем всегда к тому, у которого значение электроотрицательности больше, при этом оба атома-участника превращаются в ионы).
Электростатическое притяжение частиц в ионной связи очень сильное. Эта особенность обусловливает высокие температуры плавления и кипения для веществ с такой связью. Однако стопроцентного ионного соединения не существует. Электронная пара не переходит к более электроотрицательному атому полностью. В качестве яркого примера наиболее сильного смещения электронов стоит привести фторид цезия CsF. Так называемая «степень ионности» в этом соединении достигает 97%.
Заряды частиц и их классификация
По определению ионная химическая связь — это соединение ионов с разным зарядом (положительным и отрицательным). Это частный случай ковалентной полярной связи или, иначе говоря, крайний случай поляризации.
Положительно заряженные ионы называются катионами. Примеры: K+ (ион калия), Fe 2 + (ион железа) и так далее. Катионы образуются в результате отдачи (потери) атомом одного электрона или нескольких. У них положительный заряд ядра превышает число отрицательно заряженных электронов.

Отрицательно заряженные ионы — это анионы. Примеры: Cl- (хлорид-ион), N 3 — (нитрид-ион) и так далее. Образование анионов происходит в результате получения (приобретения) атомом электрона (или электронов). У них ядерный заряд уступает количеству электронов.
По значению заряда ионы классифицируются на соответствующие категории (в скобках приведены примеры ионов, входящих в группу):
- однозарядную (K+, Cl- и так далее);
- двухзарядную (Ca2 +, O2 — и прочие);
- трехзарядную (Al3 + и другие).
Одна из особенностей связи разноименных ионов — при их взаимодействии друг с другом их заряды полностью разделяются. Это связано с большой разностью электроотрицательностей атомов в паре.
Процесс взаимодействия
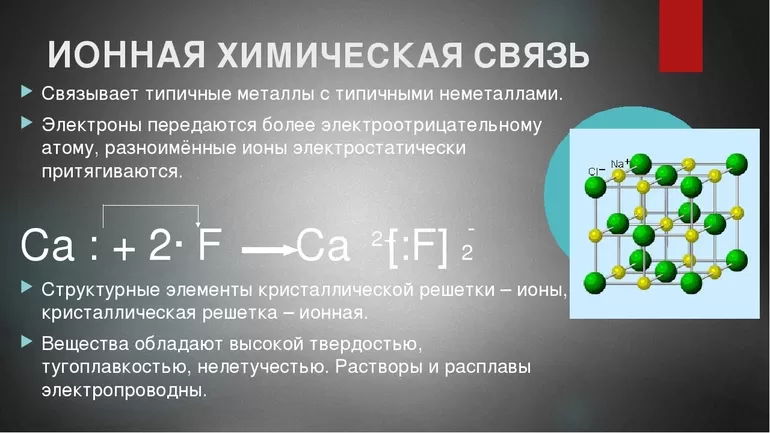
В отличие от металлической связи, где соединение образуется парой элементов-металлов, в процессе образования ионного соединения в качестве участников выступают атомы металлов и неметаллов. Типичные металлы охотно делятся электронами, а типичные неметаллы не менее охотно их принимают. Отдающий атом называется донорным, а принимающий — акцепторным.
При возникновении соединения атом неметалла забирает электроны на свой внешний энергетический уровень, достраивая его таким методом. В результате он приобретает устойчивую конфигурацию из восьми электронов (согласно правилу октета). То есть суть механизма образования ионной связи заключается в следующем: после взаимного притяжения друг к другу противоположно заряженные ионы образуют стабильное соединение.

Атомы с почти полной или почти пустой внешней (валентной) оболочкой вступают в химические реакции максимально охотно. Заполненность этого слоя играет ключевую роль в электронном обмене. Малое количество пустых орбиталей на внешней оболочке повышает шансы атома на получение электронов извне. А мизерное количество электронов, расположенных на валентной оболочке, напротив, увеличивает вероятность отдачи атомом электрона.
Электроотрицательность атома химического элемента выражается в его способности к притяжению электронов к своему внешнему слою. Именно поэтому чем полнее заполнена валентная оболочка атома, тем больше значение его электроотрицательности. Показатели электроотрицательности связаны с расположением элементов в периодической таблице Менделеева — чем дальше они находятся друг от друга (расстояние оценивают в основном по группе), тем больше разница между показателями. По этой причине ионные соединения особенно характерны для металлов и неметаллов, расположенных в системе наиболее удаленно (например, в I и VII группах).
Помимо простой связи ионов, стоит особо отметить ее молекулярную разновидность. Главная особенность такого соединения заключается в том, что в качестве ионов в ней выступают целые молекулы, а не отдельные атомы, как в обычной связи.
Примеры возникновения
Подробно рассмотреть, как взаимодействие атомов с разноименными зарядами приводит к образованию связи ионов, стоит на нескольких простых примерах.
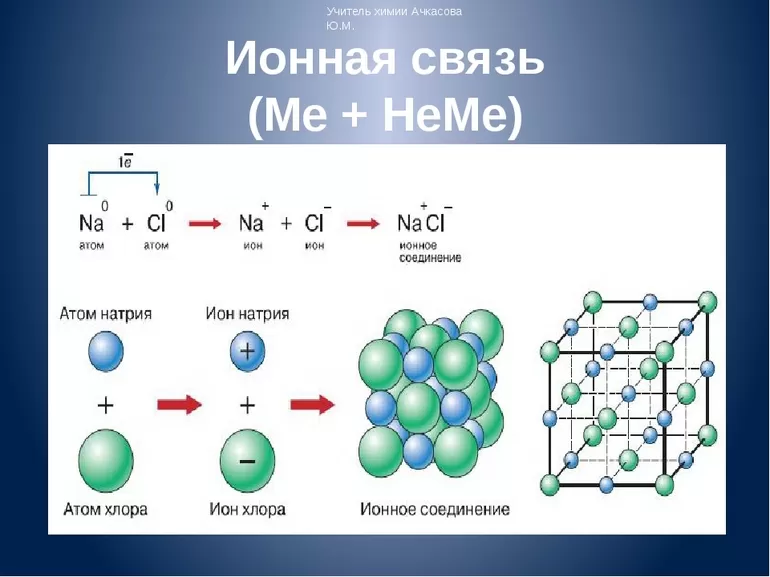
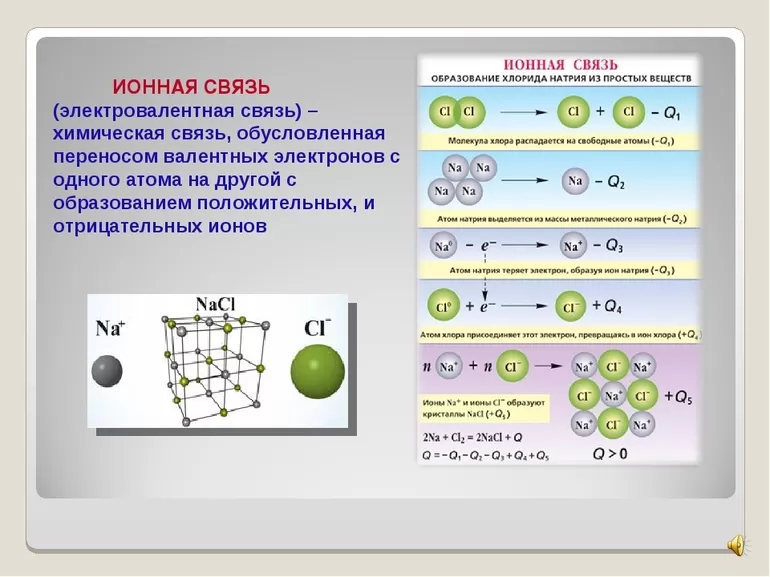
Первый пример — общее описание механизма возникновения. Для этого подойдет химическая реакция формирования такого соединения, как хлорид натрия или, проще говоря, поваренная соль. В процессе участвуют атомы щелочного металла (натрий Na) и галогена (хлор Cl). У первого на внешнем энергетическом уровне находится один электрон, а у второго — семь, то есть ему как раз нужен один электрон для завершения своего внешнего слоя.
Единственный валентный электрон атома металла имеет слабую связь с его ядром, поэтому Na легко отдает эту частицу. В результате у него освобождается место на внешнем энергетическом уровне. Таким образом оба участника соединения получили полностью заполненные внешние оболочки. После отдачи электрона атом металла превращается в катион натрия Na+, а принявший этот электрон атом неметалла преображается в хлорид-ион Cl-. Образовавшиеся ионы притягиваются друг к другу — возникает ионное соединение.
Схема процесса превращения атомов натрия и хлора в ионы соответствующих элементов и образование ими ионного соединения выглядит следующим образом (скобками отмечены электронные слои строения атома): Na0 )2e)8e)1e + Cl0 )2e)8e)7e = [Na+)2e)8e] + [Cl-)2e)8e)8e] = [Na+)2e)8e][Cl-)2e)8e)8e]. Этот же процесс в виде формулы выглядит так: Na0 + Cl0 = Na+ + Cl- = Na+Cl-
Таким образом, формула вещества с ионной связью (в приведенном примере это поваренная соль) имеет следующий вид: Na+Cl- (то есть один участник в ходе взаимодействия приобретает положительный заряд, а другой, наоборот, отрицательный). Ионные вещества всегда имеют сложный состав — они не состоят из одного элемента. Это соединение характерно для следующих веществ:
- солей;
- щелочей;
- оксидов некоторых металлов.
Они обладают кристаллическими решетками ионного типа.
Что касается элементов, то для примера ионной связи натрий — один из самых подходящих элементов периодической таблицы Менделеева. Это связано с его низкой электроотрицательностью и наличием на внешней оболочке единственного электрона. Второй пример формирования ионного соединения также будет с натрием. Рассматриваемое вещество — фторид натрия. Участники процесса — натрий Na и фтор F.
По наиболее важным для изучаемого процесса характеристикам фтор схож с хлором — у него высокая электроотрицательность и семь электронов на внешнем слое. Поэтому он также очень подходит для рассмотрения эталонной связи ионов.
Фторид натрия образуется в результате окислительно-восстановительной реакции между атомами натрия и фтора. Металл отдает свой внешний электрон неметаллу. Последняя внешняя орбиталь атома фтора заполняется, валентный слой натрия освобождается. Оба атома, превращаясь в ионы с разноименными зарядами, приобретают стабильную электронную конфигурацию. Затем между ними возникает электростатическое притяжение, в результате чего они образуют ионное соединение.
Особенности связи

Для соединений ионов характерна кристаллическая структура. Яркий пример типичной формы таких веществ — это поваренная соль NaCl.
Эти соединения очень прочные — настолько, что их крайне проблематично разрушить посредством тепловой энергии. Однако из-за довольно низкого радиуса ионного взаимодействия эти соединения получили такую незавидную характеристику, как ломкость. Что касается энергии самой связи, то она прямо пропорциональна кратности соединения, то есть числу общих электронных пар.
Соединения ионов отлично растворяются в полярных растворителях — воде, кислотах и прочих. Эта особенность обусловлена заряженностью частей молекулы. Помимо растворимости, ионные соединения обладают такими характеристиками:
- прочность;
- длина;
- поляризуемость;
- полярность;
- ненасыщаемость;
- ненаправленность.
Два последних характерных свойства ионной связи отличают ее от прочих видов химических соединений. Эти особенности обусловливают факт тяготения кристаллов ионных веществ к различным плотнейшим упаковкам соответствующих ионов.
Источник
