Какие физические свойства водорода
Атомная масса – 1 а.е.м. Молекула водорода двухатомна – Н2.
Электронная конфигурация атома водорода – 1s1. Водород относится к семейству s-элементов. В своих соединениях проявляет степени окисления -1, 0,
+1. Природный водород состоит из двух стабильных изотопов – протия 1Н (99,98%) и дейтерия 2Н (D) (0,015%) – и радиоактивного изотопа трития 3Н (Т) (следовые количества, период полураспада – 12,5 лет).
Химические свойства водорода
При обычных условиях молекулярный водород проявляет сравнительно низкую реакционную способность, что объясняется высокой прочностью связей в молекуле. При нагревании вступает во взаимодействие практически со всеми простыми веществами, образованными элементами главных подгрупп (кроме благородных газов, B, Si,
P, Al). В химических реакциях может выступать как в роли восстановителя (чаще), так и окислителя (реже).
Водород проявляет свойства восстановителя (Н20 -2е → 2Н+) в следующих реакциях:
1. Реакции взаимодействия с простыми веществами – неметаллами. Водород реагирует с галогенами, причем, реакция взаимодействия со фтором при обычных условиях, в темноте, со взрывом, с хлором – при освещении (или УФ-облучении) по цепному механизму, с бромом и йодом только при нагревании; кислородом (смесь кислорода и водорода в объемном отношении 2:1 называют «гремучим газом»), серой, азотом и углеродом:
H2 + Hal2 = 2HHal;
2H2 + O2 = 2H2O + Q (t![]() );
);
H2 + S = H2S (t![]() = 150 – 300
= 150 – 300![]() C);
C);
3H2 + N2 ↔ 2NH3 (t![]() = 500
= 500![]() C, p, kat = Fe, Pt);
C, p, kat = Fe, Pt);
2H2 + C ↔ CH4 (t![]() , p, kat).
, p, kat).
2. Реакции взаимодействия со сложными веществами. Водород реагирует с оксидами малоактивных металлов, причем он способен восстанавливать только металлы, стоящие в ряду активности правее цинка:
CuO + H2 = Cu + H2O (t![]() );
);
Fe2O3 + 3H2 = 2Fe + 3H2O (t![]() );
);
WO3 + 3H2 = W + 3H2O (t![]() ).
).
Водород реагирует с оксидами неметаллов:
H2 + CO2 ↔ CO + H2O (t![]() );
);
2H2 + CO ↔ CH3OH (t![]() = 300
= 300![]() C, p = 250 – 300 атм., kat = ZnO, Cr2O3).
C, p = 250 – 300 атм., kat = ZnO, Cr2O3).
Водород вступает в реакции гидрирования с органическими соединениями класса циклоалканов, алкенов, аренов, альдегидов и кетонов и др. Все эти реакции проводят при нагревании, под давлением, в качестве катализаторов используют платину или никель:
CH2 = CH2 + H2 ↔ CH3-CH3;
C6H6 + 3H2 ↔ C6H12;
C3H6 + H2 ↔ C3H8;
CH3CHO + H2 ↔ CH3-CH2-OH;
CH3-CO-CH3 + H2 ↔ CH3-CH(OH)-CH3.
Водород в качестве окислителя (Н2![]() +2е → 2Н—) выступает в реакциях взаимодействия со щелочными и щелочноземельными металлами. При этом образуются гидриды – кристаллические ионные соединения, в которых водород проявляет степень окисления -1.
+2е → 2Н—) выступает в реакциях взаимодействия со щелочными и щелочноземельными металлами. При этом образуются гидриды – кристаллические ионные соединения, в которых водород проявляет степень окисления -1.
2Na +H2 ↔ 2NaH (t![]() , p).
, p).
Ca + H2 ↔ CaH2 (t![]() , p).
, p).
Физические свойства водорода
Водород – легкий бесцветный газ, без запаха, плотность при н.у. – 0,09 г/л, в 14,5 раз легче воздуха, tкип = -252,8![]() С, tпл = — 259,2
С, tпл = — 259,2![]() С. Водород плохо растворим в воде и органически растворителях, хорошо растворим в некоторых металлах: никеле, палладии, платине.
С. Водород плохо растворим в воде и органически растворителях, хорошо растворим в некоторых металлах: никеле, палладии, платине.
По данным современной космохимии водород является самым распространенным элементом Вселенной. Основная форма существования водорода в космическом пространстве – отдельные атомы. По распространенности на Земле водород занимает 9 место среди всех элементов. Основное количество водорода на Земле находится в связанном состоянии – в составе воды, нефти, природного газа, каменного угля и т.д. В виде простого вещества водород встречается редко – в составе вулканических газов.
Получение водорода
Различают лабораторные и промышленные способы получения водорода. К лабораторным способам относят взаимодействие металлов с кислотами (1), а также взаимодействие алюминия с водными растворами щелочей (2). Среди промышленных способов получения водорода большую роль играют электролиз водных растворов щелочей и солей (3) и конверсия метана (4):
Zn + 2HCl = ZnCl2 + H2↑ (1);
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] +3 H2↑ (2);
2NaCl + 2H2O = H2↑ + Cl2↑ + 2NaOH (3);
CH4 + H2O ↔ CO + H2 (4).
Примеры решения задач
Источник
Гидроген Н – химический элемент, один из самых распространённых в нашей Вселенной. Масса водорода как элемента в составе веществ составляет 75 % от общего содержания атомов другого типа. Он входит в наиважнейшее и жизненно необходимое соединение на планете – воду. Отличительной особенностью водорода также является то, что он первый элемент в периодический системе химических элементов Д. И. Менделеева.

Открытие и исследование
Первые упоминания о водороде в трудах Парацельса датируются шестнадцатым веком. Но его выделение из газовой смеси воздуха и исследование горючих свойств были произведены уже в семнадцатом веке учёным Лемери. Досконально изучил гидроген английский химик, физик и естествоиспытатель Генри Кавендиш, который опытным путём доказал, что масса водорода наименьшая в сравнении с другими газами. В последующих этапах развития науки многие учёные работали с ним, в частности Лавуазье, назвавший его «рождающим воду».
Характеристика по положению в ПСХЭ
Элемент, открывающий периодическую таблицу Д. И. Менделеева, – это водород. Физические и химические свойства атома проявляют некую двойственность, так как гидроген одновременно относят к первой группе, главной подгруппе, если он ведёт себя как металл и отдаёт единственный электрон в процессе химической реакции, и к седьмой – в случае полного заполнения валентной оболочки, то есть приёме отрицательной частицы, что характеризует его как подобный галогенам.

Особенности электронного строения элемента
Свойства атома водорода, сложных веществ, в состав которых он входит, и самого простого вещества Н2 в первую очередь определяются электронной конфигурацией гидрогена. Частица имеет один электрон с Z= (-1), который вращается по своей орбите вокруг ядра, содержащего один протон с единичной массой и положительным зарядом (+1). Его электронная конфигурация записывается как 1s1, что означает наличие одной отрицательной частицы на самой первой и единственной для гидрогена s-орбитали.
При отрыве или отдаче электрона, а атом этого элемента имеет такое свойство, что роднит его с металлами, получается катион. По сути ион водорода – это положительная элементарная частица. Поэтому лишенный электрона гидроген называют попросту протоном.

Физические свойства
Если описывать физические свойства водорода кратко, то это бесцветный, малорастворимый газ с относительной атомной массой равной 2, в 14,5 раза легче, чем воздух, с температурой сжижения, составляющей -252,8 градуса Цельсия.
На опыте можно легко убедиться в том, что Н2 самый легкий. Для этого достаточно наполнить три шара различными веществами – водородом, углекислым газом, обычным воздухом – и одновременно выпустить их из руки. Быстрее всех достигнет земли тот, который наполнен СО2, после него опустится надутый воздушной смесью, а содержащий Н2 вовсе поднимется к потолку.
Маленькая масса и размер частиц водорода обосновывают его способность проникать через различные вещества. На примере того же шара в этом легко убедиться, через пару дней он сам сдуется, так как газ просто пройдёт через резину. Также водород может накапливаться в структуре некоторых металлов (палладий или платина), а при повышении температуры испаряться из неё.
Свойство малорастворимости водорода используют в лабораторной практике для его выделения способом вытеснения воды. Физические свойства водорода (таблица, изображенная ниже, содержит основные параметры) определяют сферы его применения и методы получения.
| Параметр атома или молекулы простого вещества | Значение |
| Атомная масса (молярная масса) | 1,008 г/моль |
| Электронная конфигурация | 1s1 |
| Кристаллическая решётка | Гексагональная |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Плотность при н. у. | 0,08987 г/л |
| Температура кипения | -252,76 °C |
| Удельная теплота сгорания | 120,9·106 Дж/кг |
| Температура плавления | -259,2 °C |
| Растворимость в воде | 18,8 мл/л |
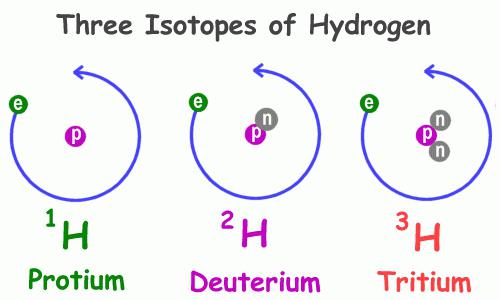
Изотопный состав
Как и многие другие представители периодической системы химических элементов, гидроген имеет несколько природных изотопов, то есть атомов с одинаковым числом протонов в ядре, но различным числом нейтронов – частиц с нулевым зарядом и единичной массой. Примеры атомов, обладающих подобным свойством – кислород, углерод, хлор, бром и прочие, в том числе радиоактивные.
Физические свойства водорода 1Н, самого распространённого из представителей данной группы, значительно отличаются от таких же характеристик его собратьев. В частности, разнятся особенности веществ, в состав которых они входят. Так, существует обычная и дейтерированная вода, содержащая в своём составе вместо атома водорода с одним-единственным протоном дейтерий 2Н – его изотоп с двумя элементарными частицами: положительной и незаряженной. Этот изотоп в два раза тяжелее обычного гидрогена, что и объясняет кардинальное различие в свойствах соединений, которые они составляют. В природе дейтерий встречается в 3200 раз реже, чем водород. Третий представитель – тритий 3Н, в ядре он имеет два нейтрона и один протон.
Способы получения и выделения
Лабораторные и промышленные методы получения водорода весьма отличаются. Так, в малых количествах газ получают в основном с помощью реакций, в которых участвуют минеральные вещества, а крупномасштабные производства в большей степени используют органический синтез.
В лаборатории применяют следующие химические взаимодействия:
- Реакция щелочных и щелочноземельных металлов с водой с образованием щёлочи и искомого газа.
- Электролиз водного раствора электролита, на аноде выделяется Н2↑, а на катоде – кислород.
- Разложение гидридов щелочных металлов водой, продуктами являются щёлочь и, соответственно, газ Н2↑.
- Взаимодействие разбавленных кислот с металлами с образованием солей и Н2↑.
- Действие щелочей на кремний, алюминий и цинк также способствует выделению водорода параллельно с образованием комплексных солей.
В промышленных интересах газ получают такими методами, как:
- Термическое разложение метана в присутствии катализатора до составляющих его простых веществ (350 градусов достигает значение такого показателя, как температура) – водорода Н2↑ и углерода С.
- Пропускание парообразной воды через кокс при 1000 градусов Цельсия с образованием углекислого газа СО2 и Н2↑ (самый распространённый метод).
- Конверсия газообразного метана на никелевом катализаторе при температуре, достигающей 800 градусов.
- Водород является побочным продуктом при электролизе водных растворов хлоридов калия или натрия.
Химические взаимодействия: общие положения
Физические свойства водорода во многом объясняют его поведение в процессах реагирования с тем или иным соединением. Валентность гидрогена равняется 1, так как он в таблице Менделеева расположен в первой группе, а степень окисления проявляет различную. Во всех соединениях, кроме гидридов, водород в с.о.= (1+), в молекулах типа ХН, ХН2, ХН3 – (1-).
Молекула газа водорода, образованная посредством создания обобщенной электронной пары, состоит из двух атомов и довольно устойчива энергетически, именно поэтому при нормальных условиях несколько инертна и в реакции вступает при изменении нормальных условий. В зависимости от степени окисления водорода в составе прочих веществ, он может выступать как в качестве окислителя, так и восстановителя.
Вещества, с которыми реагирует и которые образует водород
Элементные взаимодействия с образованием сложных веществ (часто при повышенных температурах):
- Щелочной и щелочноземельный металл + водород = гидрид.
- Галоген + Н2 = галогеноводород.
- Сера + водород = сероводород.
- Кислород + Н2 = вода.
- Углерод + водород = метан.
- Азот + Н2 = аммиак.
Взаимодействие со сложными веществами:
- Получение синтез-газа из монооксида углерода и водорода.
- Восстановление металлов из их оксидов с помощью Н2.
- Насыщение водородом непредельных алифатических углеводородов.
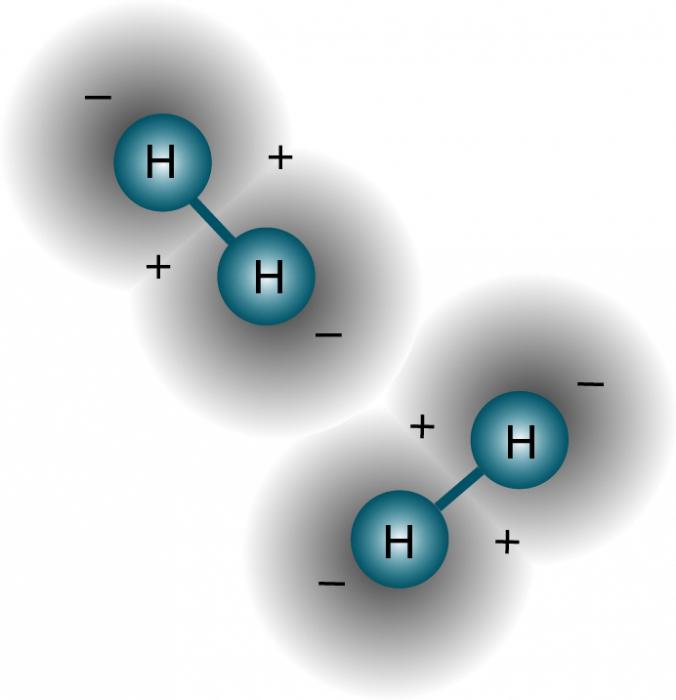
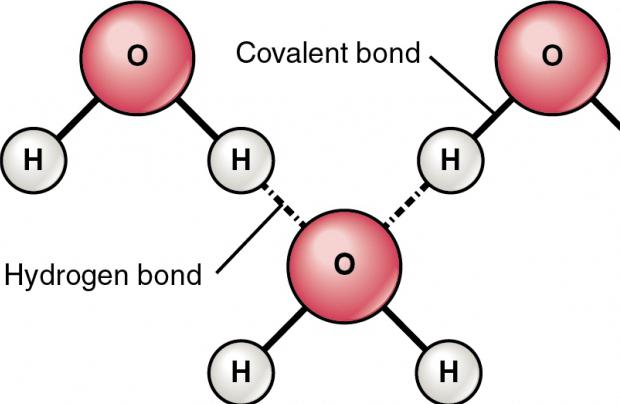
Водородная связь
Физические свойства водорода таковы, что позволяют ему, находясь в соединении с электроотрицательным элементом, образовывать особый тип связи с таким же атомом из соседних молекул, имеющих неподелённые электронные пары (например, кислородом, азотом и фтором). Ярчайший пример, на котором лучше рассмотреть подобное явление, – это вода. Она, можно сказать, прошита водородными связями, которые слабее ковалентных или ионных, но за счёт того, что их много, оказывают значительное влияние на свойства вещества. По сути, водородная связь – это электростатическое взаимодействие, которое связывает молекулы воды в димеры и полимеры, обосновывая её высокую температуру кипения.
Гидроген в составе минеральных соединений
В состав всех неорганических кислот входит протон – катион такого атома, как водород. Вещество, кислотный остаток которого имеет степень окисления больше (-1), называется многоосновным соединением. В нём присутствует несколько атомов водорода, что делает диссоциацию в водных растворах многоступенчатой. Каждый последующий протон отрывается от остатка кислоты всё труднее. По количественному содержанию водородов в среде определяется его кислотность.

Водород содержат и гидроксильные группы оснований. В них водород соединён с атомом кислорода, в результате степень окисления этого остатка щёлочи всегда равна (-1). По содержанию гидроксилов в среде определяется её основность.
Применение в деятельности человека
Баллоны с веществом, так же как и емкости с другими сжиженными газами, например кислородом, имеют специфический внешний вид. Они выкрашены в темновато-зелёный цвет с ярко-красной надписью «Водород». Газ закачивают в баллон под давлением порядка 150 атмосфер. Физические свойства водорода, в частности легкость газообразного агрегатного состояния, используют для наполнения им в смеси с гелием аэростатов, шаров-зондов и т.д.
Водород, физические и химические свойства которого люди научились использовать много лет назад, на сегодняшний момент задействован во многих отраслях промышленности. Основная его масса идёт на производство аммиака. Также водород участвует в получении металлов (гафния, германия, галлия, кремния, молибдена, вольфрама, циркония и прочих) из окислов, выступая в реакции в качестве восстановителя, синильной и соляной кислот, метилового спирта, а также искусственного жидкого топлива. Пищевая промышленность использует его для превращения растительных масел в твёрдые жиры.
Определили химические свойства и применение водорода в различных процессах гидрогенизации и гидрирования жиров, углей, углеводородов, масел и мазута. С помощью него производят драгоценные камни, лампы накаливания, проводят ковку и сварку металлических изделий под воздействием кислородно-водородного пламени.
Источник
Обобщающая схема «ВОДОРОД»
I.
Водород – химический элемент
а) Положение в ПСХЭ
- порядковый номер №1
- период 1
- группа I (главная подгруппа «А»)
- относительная масса Ar(Н)=1
- латинское название Hydrogenium (рождающий
воду)
б) Распространённость водорода в
природе
Водород – химический элемент. | В земной коре (литосфера и гидросфера) – 1% по массе (10 место |
АТМОСФЕРА – 0,0001% по числу атомов | |
Самый распространённый элемент во вселенной – 92% от числа всех атомов |
Водород – химический элемент | В соединениях | Н2О – вода (11% по массе) |
СН4 – газ метан (25% по массе) | ||
Органические вещества (нефть, горючие природные газы и В организмах животных и растений (то есть в составе белков, В теле человека в среднем содержится около 7 килограммов водорода. |
в) Валентность водорода в соединениях
I Н2 ↑,
ц, з, Mr(Н2)=2,
газ легче воздуха
H2O – вода;
Н2О2 –
перекись водорода
II. Водород – простое вещество (Н2)
Получение
1.Лаборатория А) Взаимодействие металлов с кислотами: Zn + 2HCl = ZnCl2 + H2↑ соль Б) Взаимодействие активных металлов с водой: 2Na + 2H2O = 2NaOH + H2↑ |
2. · эл. ток 2H2O = · t, Ni CH4 + 2H2O = |
Нахождение
водорода в природе.
Водород широко
распространен в природе, его содержание в земной коре (литосфера и гидросфера) составляет
по массе 1%, а по числу атомов 16%. Водород входит в состав самого
распространенного вещества на Земле – воды (11,19% Водорода по массе), в состав
соединений, слагающих угли, нефть, природные газы, глины, а также организмы
животных и растений (то есть в состав белков, нуклеиновых кислот, жиров,
углеводов и других). В свободном состоянии Водород встречается крайне редко, в
небольших количествах он содержится в вулканических и других природных газах.
Ничтожные количества свободного Водорода (0,0001% по числу атомов) присутствуют
в атмосфере. В околоземном пространстве Водород в виде потока протонов образует
внутренний (“протонный”) радиационный пояс Земли. В космосе Водород
является самым распространенным элементом. В виде плазмы он составляет около
половины массы Солнца и большинства звезд, основную часть газов межзвездной
среды и газовых туманностей. Водород присутствует в атмосфере ряда планет и в
кометах в виде свободного Н2, метана СН4, аммиака NH3,
воды Н2О, радикалов. В виде потока
протонов Водород входит в состав корпускулярного излучения Солнца и космических
лучей.
Существуют три изотопа водорода:
а) легкий водород – протий,
б) тяжелый водород – дейтерий (D),
в) сверхтяжелый водород – тритий (Т).
Тритий неустойчивый
(радиоактивный) изотоп, поэтому в природе он практически не встречается.
Дейтерий устойчив, но его очень мало: 0,015% (от массы всего земного водорода).
Валентность
водорода в соединениях
В соединениях водород
проявляет валентность I.
Физические
свойства водорода
Простое вещество
водород (Н2) – это газ, легче воздуха, без цвета, без запаха, без
вкуса, tкип = – 2530С, водород в воде нерастворим , горюч. Собирать водород можно путем вытеснения
воздуха из пробирки или воды. При этом пробирку нужно перевернуть вверх дном.
Получение
водорода
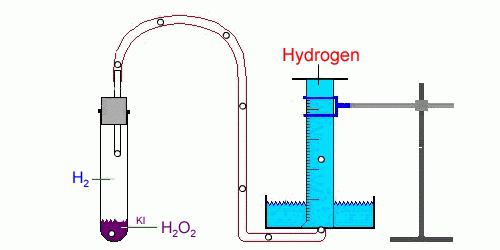
В лаборатории водород
получают в результате реакции
Видео – Эксперимент
“Получение водорода и проверка его на чистоту”
Zn + H2SO4
= ZnSO4 + H2
.
Вместо цинка можно
использовать железо, алюминий и некоторые другие металлы, а вместо серной
кислоты – некоторые другие разбавленные кислоты. Образующийся водород собирают
в пробирку методом вытеснения воды (см. рис. 10.2 б) или просто в
перевернутую колбу (рис. 10.2 а).
В промышленности в больших
количествах водород получают из природного газа (в основном это метан) при
взаимодействии его с парами воды при 800 °С в присутствии никелевого
катализатора:
CH4 + 2H2O = 4H2 +CO2
(t, Ni)
или обрабатывают при
высокой температуре парами воды уголь:
2H2O + С =
2H2 + CO2. (t)
Чистый водород получают
из воды, разлагая ее электрическим током (подвергая электролизу):
2H2O = 2H2+ O2(электролиз).
Дополнительно:
Видео – Эксперимент
“Мыльные пузыри с водородом”
ТРЕНАЖЁРЫ
Тренажёр №1- Нахождение
водорода в природе. Физические свойства
Тренажёр №2 –
Характеристика водорода по положению в Периодической системе элементов Д. И.
Менделеева
АЛГОРИТМ СОСТАВЛЕНИЯ УХР ПОЛУЧЕНИЯ ВОДОРОДА
Источник
