Какие физические свойства веществ есть в химии
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Это интересно: Химические свойства кислорода
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Источник
Кроме агрегатного состояния к важнейшим свойствам веществ относят:
- запах;
- цвет;
- вкус;
- твёрдость;
- температуру кипения и плавления;
- плотность;
- растворимость;
- ковкость;
- пластичность;
- способность проводить тепло и электричество.
Рассмотрим некоторые из них.
Запах
Есть вещества без запаха.
Например, кислород, вода, сахар, глицерин.
У некоторых веществ есть свой характерный запах.
Например, резкий удушливый запах имеют нашатырный спирт, озон, кристаллический иод.
Следует иметь в виду, что запах воспринимается людьми индивидуально. То есть то, что один человек будет воспринимать как нечто приятное, другому может показаться пахнущим отвратительно. Кроме того, некоторые люди в силу особенностей организма вообще не ощущают запахи.
Обрати внимание!
Нюхать вещества надо очень осторожно, не приближая лицо (нос) к горлышку сосуда, а направляя к себе ладонью газ или пары жидкости.
Некоторые вещества являются бесцветными.
Например, такие как кислород, вода, глицерин, кварц.
Многие вещества имеют характерную окраску.
Например:
- белого цвета крахмал, мел, сахарная пудра;
- чёрного цвета сажа;
- красного цвета медь и гемоглобин (белок крови, отвечает за транспортировку кислорода в организме);
- зелёного цвета хлорофилл (пигмент, содержащийся в растительных клетках, участвующих в процессе фотосинтеза);
- жёлтого цвета сера и золото;
- большинство металлов имеет серебристо-белый или серебристо-серый цвет.
Вкуса не имеют: стекло (мы не чувствуем вкус стекла, когда пьём воду из стакана), азот, вода.
Некоторые вещества имеют характерный вкус.
Например:
- солёный вкус имеет поваренная соль;
- кислый вкус имеют кислоты (лимонная, молочная и другие);
- сладкий вкус у сахарозы (свекловичного и тростникового сахара), глюкозы, фруктозы;
- горький вкус имеет хинин.
Обрати внимание!
Восприятие цвета и вкуса зависит от физиологического состояния человека. При различных заболеваниях и с возрастом способность человека определять запах, цвет и вкус веществ может изменяться.
Твёрдость веществ
Под твёрдостью понимается способность вещества противостоять какому-либо механическому воздействию на него, обычно царапанью или вдавливанию.
Для измерения твёрдости существует несколько шкал (методов измерения). По шкале Мооса самым твёрдым веществом является алмаз, на втором месте — корунд, а замыкает шкалу тальк.
Шкала Мооса (минералогическая шкала твёрдости):
Эталонный минерал | Твёрдость | Обрабатываемость | Другие минералы с такой твёрдостью |
| Тальк | (1) | Царапается ногтем | Графит |
| Гипс | (2) | Царапается ногтем | Галит |
| Кальцит | (3) | Царапается медной монетой | Золото, серебро |
| Флюорит | (4) | Царапается ножом, оконным стеклом | Доломит, сфалерит |
| Апатит | (5) | Царапается ножом, оконным стеклом | Гематит, лазурит |
| Ортоклаз | (6) | Царапается напильником | Опал, рутил |
| Кварц | (7) | Поддаётся обработке алмазом, царапает стекло | Гранат, турмалин |
| Топаз | (8) | Поддаётся обработке алмазом, царапает стекло | Берилл, шпинель |
| Корунд | (9) | Поддаётся обработке алмазом, царапает стекло | – |
| Алмаз | (10) | Режет стекло | – |
Температура плавления и кипения
Температура плавления и кристаллизации — температура, при которой твёрдое вещество переходит в жидкое агрегатное состояние и наоборот.
Например, температура плавления и кристаллизации воды — (0) °С.
Температуру, при которой жидкость переходит в газообразное агрегатное состояние, называют температурой кипения. При такой же температуре происходит обратный переход, то есть конденсация паров.
Например, вода кипит, а также водяной пар конденсируется при температуре (+100) °С.
Плотность — физическая величина, определяемая как отношение массы тела к занимаемому этим телом объёму.
Например, плотность воды (при температуре (+4) °С) (ρ = 1000) кг/м³, плотность алюминия — (2700) кг/м³.
Ковкость и пластичность веществ
Ковкость — это способность металлов и сплавов подвергаться ковке (высокотемпературной обработке) и другим видам обработки давлением (прокатке, волочению, прессованию, штамповке).
Ковкость характеризуется двумя показателями — пластичностью, то есть способностью металла подвергаться деформации под давлением без разрушения, и сопротивлением деформации.У ковких металлов (сталь, латунь, дюралюминий и некоторые другие медные, алюминиевые, магниевые, никелевые сплавы) относительно высокая пластичность сочетается с низким сопротивлением деформации.
К числу весьма пластичных материалов относятся медь, алюминий, латунь, золото.
Менее пластичными являются дюралюминий и бронза.
К числу слабо пластичных материалов относятся многие легированные стали.
Способность проводить тепло и электричество
Очень хорошо проводят тепло и электричество металлы (серебро, золото, медь, алюминий) и графит.
Плохо проводят тепло и практически не проводят электричество (являются изоляторами) другие вещества, например, воздух, стекло, пластмассы, резина.
Вода также практически не проводит электрический ток. Это примечание не относится к природной воде — она хороший проводник, поскольку содержит растворённые в ней соли.
Источник
ХИМИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА
Рассмотрим некоторые физические свойства вещества: агрегатное состояние, температуры плавления и кипения, кристаллическую структуру, электропроводность. Агрегатное состояние вещества определяется силой притяжения между составляющими его молекулами и температурой. В твердом теле молекулы достаточно сильно сцеплены друг с другом и их движение ограничивается колебаниями относительно фиксированных положений. С повышением температуры энергия молекул увеличивается, колебания становятся все более интенсивными, и в конце концов молекулы приобретают достаточно энергии, чтобы совершать поступательные движения. При этом твердое вещество плавится (если межмолекулярное взаимодействие остается достаточно сильным) или, сублимируясь, превращается в газ, молекулы которого движутся хаотически. Температура плавления (затвердевания) – это температура, при которой твердое вещество превращается в жидкость (или жидкость превращается в твердое вещество). Температура плавления воды равна 0° С (по шкале Цельсия) или 32° F (по шкале Фаренгейта). Поскольку при плавлении объем тела меняется незначительно, давление мало влияет на температуру плавления. Однако именно под действием высокого давления, оказываемого полозом конька, лед расплавляется, и спортсмен легко скользит по нему. Температура кипения – это температура, при которой жидкость превращается в пар (газ). Она зависит от давления, поэтому в горах вода кипит при более низкой температуре, чем на уровне моря. Температура кипения воды при давлении 760 мм рт. ст. (“стандартном” давлении, примерно равном давлению на уровне моря) составляет 100° С (или 212° F).
Кристаллические и аморфные вещества. Твердые вещества бывают аморфными и кристаллическими. У аморфных молекулы расположены случайным образом. В качестве примера аморфного вещества можно привести стекло. Как и другие подобные вещества, стекло не имеет определенной температуры плавления: при нагревании оно постепенно размягчается, пока, наконец, не становится жидким. Напротив, молекулы (или ионы) кристаллических веществ расположены строго упорядоченно.
К кристаллическим веществам относятся песок, поваренная соль, сахар, алмаз, графит и т.п. Все они плавятся при определенной температуре (если только при нагревании не претерпевают никаких химических изменений, как это случается с сахаром). Многие ионные соединения (например, поваренная соль NaCl) образуют кристаллы, в которых каждый ион окружен противоположно заряженными ионами; в результате нельзя сказать, что какая-то конкретная пара ионов образует молекулу. Вследствие взаимного притяжения ионов в кристалле поваренной соли (NaCl) это вещество плавится при высокой температуре (801° С). Каждый ион NaCl окружен шестью ближайшими соседями, имеющими противоположный заряд. Элементарная ячейка кристалла поваренной соли – это куб, у которого по углам и в центре каждой грани расположены ионы натрия. Ячейка такого типа называется гранецентрированной кубической. Кубическую форму имеют и крупные кристаллы поваренной соли.
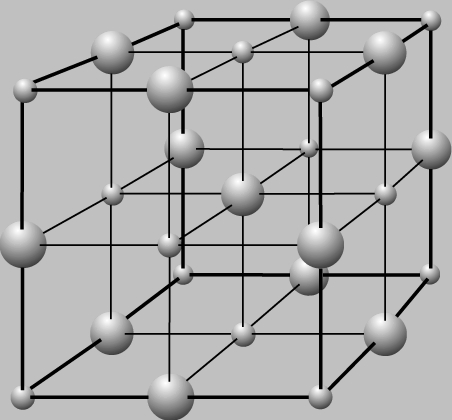
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА ПОВАРЕННОЙ СОЛИ. Маленькие шарики – ионы натрия, большие – ионы хлора. Все кристаллы поваренной соли имеют одинаковую кубическую форму.
Кристаллическая решетка алмаза, в которой каждый атом углерода ковалентно связан с четырьмя соседними атомами, также характеризуется гранецентрированной кубической элементарной ячейкой. Алмаз – очень твердое вещество, имеющее высокую температуру перехода.
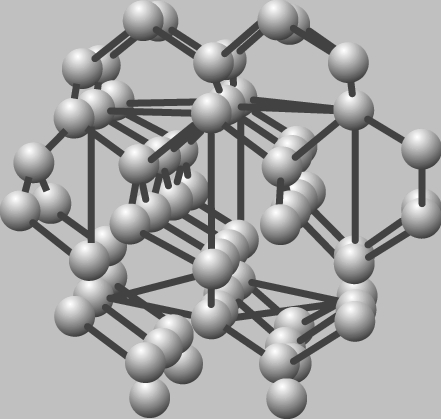
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА АЛМАЗА. Атомы углерода заключены в жесткую кристаллическую решетку, что делает алмаз чрезвычайно твердым.
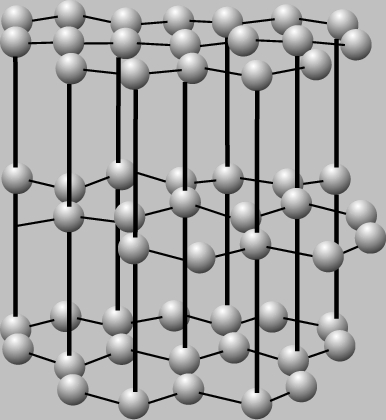
Совсем по-другому расположены атомы углерода в графите. Здесь они образуют слои, не очень прочно связанные друг с другом. Каждый слой “выстлан” шестиугольниками из углеродных атомов, аналогичными бензольному кольцу. Поскольку сцепление между слоями довольно слабое, графит мягкий. Слои легко скользят один относительно другого, благодаря чему графит является хорошим смазочным материалом. Разные кристаллические формы одного и того же элемента, такие, как графит и алмаз, называют аллотропами.
См. также АЛЛОТРОПИЯ.

КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА ГРАФИТА. Атомы углерода в графите образуют слои. Они связаны друг с другом не очень прочно и могут скользить один относительно другого.
Вещества, молекулы которых удерживаются вместе слабыми силами притяжения, а не ковалентными или ионными связями, плавятся при относительно низких температурах, редко превышающих 400° С. Таково большинство органических соединений, а также ковалентные неорганические. В качестве примеров можно привести воду и бензол: температура их плавления значительно ниже комнатной.
Электропроводность. Металлы – прекрасные проводники электричества. Носителями электрического тока в них являются электроны, свободно “плавающие” в кристаллической решетке между ионами металла, занимающими фиксированное положение в узлах решетки. Эти электроны компенсируют взаимное отталкивание положительных ионов и стабилизируют всю структуру. Если к металлу приложить разность потенциалов, то электроны будут перемещаться к положительному полюсу и возникнет электрический ток.
Энциклопедия Кольера. — Открытое общество.
2000.
Смотреть что такое “ХИМИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА” в других словарях:
Физические свойства — вещества свойства, присущие веществу вне химического взаимодействия: температура плавления, температура кипения, вязкость, плотность, диэлектрическая проницаемость, теплоёмкость, теплопроводность, электропроводность, абсорбция, цвет, концентрация … Википедия
Физические свойства — – характеризуют какую либо особенность физического состояния или отношение материала к различным физическим процессам. Эта группа включает параметры состояния, гидрофизические и теплофизические свойства, радиационную стойкость. [ Косых, А.… … Энциклопедия терминов, определений и пояснений строительных материалов
ХИМИЯ — наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций. Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей… … Энциклопедия Кольера
ХИМИЯ — ХИМИЯ, отрасль науки, изучающая свойства, состав и структуру веществ и их взаимодействие друг с другом. В настоящее время химия представляет собой обширную область знаний и подразделяется прежде всего на органическую и неорганическую химию.… … Научно-технический энциклопедический словарь
Химия — I Химия I. Предмет и структура химии Химия одна из отраслей естествознания, предметом изучения которой являются химические элементы (Атомы), образуемые ими простые и сложные вещества (молекулы (См. Молекула)), их превращения и… … Большая советская энциклопедия
Химия — I Химия I. Предмет и структура химии Химия одна из отраслей естествознания, предметом изучения которой являются химические элементы (Атомы), образуемые ими простые и сложные вещества (молекулы (См. Молекула)), их превращения и… … Большая советская энциклопедия
Химия — У этого термина существуют и другие значения, см. Химия (значения). Химия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца «черная… … Википедия
Химия — Первоначальное значение и происхождение этого слова неизвестно; возможно, что оно просто старое название северного Египта, и тогда наука Chemi значит египетская наука; но так как Chemi, кроме Египта, обозначало еще черный цвет, a μελάνοσις… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химия природных соединений — (ХПС) раздел органической химии, изучающий химические соединения, входящие в состав живых организмов, природные пути их превращений и методы искусственного получения. Как наука, химия природных соединений возникла одновременно с… … Википедия
ХИМИЯ КОЛЛОИДНАЯ — раздел физической химии, занимающийся изучением коллоидных дисперсных систем (дисперсий), в которых одно мелкораздробленное вещество дисперсная фаза равномерно распределено (диспергировано) в другой фазе дисперсионной среде. В коллоидных системах … Энциклопедия Кольера
Книги
- Общая и неорганическая химия в 2 ч. Часть 2. Химия элементов 2-е изд., пер. и доп. Учебник и практикум для СПО, Нина Георгиевна Никитина. Учебник поможет студентам сформировать адекватную современному уровню знаний научную картину мира на основе знания законов химии, состава и строения вещества, химических и физико-химических… Подробнее Купить за 559 руб электронная книга
- Химия. 11 класс. Углубленный уровень. Тетрадь для практических работ. ФГОС, Новошинский И.И.. Тетрадь для практических занятий поможет учащимся успешно выполнять практические работы по химии, на которых они будут получать вещества, изучать их свойства физические и химические.… Подробнее Купить за 124 грн (только Украина)
- Химия. 10 класс. Углубленный уровень. Тетрадь для практических работ. ФГОС, Новошинский Иван Иванович, Новошинская Нина Степановна. Тетрадь для практических занятий поможет учащимся успешно выполнять практические работы по химии, на которых они будут получать вещества, изучать их свойства – физические и химические.… Подробнее Купить за 124 грн (только Украина)
Другие книги по запросу «ХИМИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА» >>
Источник
