Какие физические свойства поваренной соли вам известны

ПОВАРЕННАЯ СОЛЬ –хлорид натрия NaCl. Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 20° С и 38,1 при 80° С. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей – хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. Плотность NaCl – 2,165 г/см3, температура плавления 800,8° С, температура кипения 1465° С.
Раньше говаривали: «Соль всему голова, без соли и жито – трава»; «Один глаз на полицу (где хлеб), другой – в солоницу (солонку)», и еще: «Без хлеба не сытно, без соли не сладко»… Бурятская народная мудрость гласит: «Собираясь пить чай, клади в него щепотку соли; от нее быстрее усваивается пища, исчезнут болезни желудка».
Вряд ли мы узнаем, когда впервые наши далекие предки вкусили соль: нас отделяют от них десять-пятнадцать тысяч лет. Тогда еще не было посуды для приготовления пищи, все растительные продукты люди вымачивали в воде и подпекали на тлеющих углях, а мясо, насаженное на палки, обжаривали в пламени костра. «Поваренной солью» первобытных людей наверняка была зола, которая неизбежно попадала в пищу во время ее приготовления. Зола содержит поташ – карбонат калия K2CO3, который в местах, удаленных от морей и соленых озер, долгое время служил пищевой приправой.
Возможно, однажды, за неимением пресной воды, мясо либо корни и листья растений были замочены в соленой морской или озерной воде, и еда оказалась вкуснее обычной. Может быть, добытое впрок мясо, чтобы защитить его от хищных птиц и насекомых, люди спрятали в морскую воду, а потом обнаружили, что оно приобрело приятный вкус. Наблюдательные охотники первобытных племен могли заметить, что животные любят лизать солонцы – белые кристаллы каменной соли, выступающие кое-где из-под земли, и попробовали добавлять соль в пищу. Могли быть и другие случаи первого знакомства людей с этим удивительным веществом.
Чистая поваренная соль, или хлорид натрия NaCl – бесцветное негигроскопичное (не поглощающее влагу из воздуха) кристаллическое вещество, растворимое в воде и плавящееся при 801° С. В природе хлорид натрия встречается в виде минерала галита – каменной соли. Слово «галит» происходит от греческого «галос», означающего и «соль», и «море». Основная масса галита чаще всего находится на глубине 5 км под поверхностью земли. Однако давление слоя горных пород, расположенных над пластом соли, превращает ее в вязкую, пластичную массу. «Всплывая» в местах пониженного давления кроющих пород, пласт соли образует соляные «купола», выходящие в ряде мест наружу.
Природный галит редко бывает чисто белого цвета. Чаще он буроватый или желтоватый из-за примесей соединений железа. Встречаются, но очень редко, кристаллы галита голубого цвета. Это означает, что они долгое время в глубинах земли находились по соседству с породами, содержащими уран, и подверглись радиоактивному облучению.
В лаборатории тоже можно получить синие кристаллы хлорида натрия. Для этого не потребуется облучения; просто в плотно закрытом сосуде надо нагреть смесь поваренной соли NaCl и небольшого количества металлического натрия Na. Металл способен растворяться в соли. Когда атомы натрия проникают в кристалл, состоящий из катионов Na+ и анионов Cl–, они «достраивают» кристаллическую решетку, занимая подходящие места и превращаясь в катионы Na+. Освободившиеся электроны располагаются в тех местах кристалла, где полагалось бы находиться хлорид-анионам Cl–?. Такие необычные места внутри кристалла, занятые электронами вместо ионов, называют «вакансиями».
При охлаждении кристалла некоторые вакансии объединяются, это и служит причиной появления синей окраски. Кстати, при растворении в воде синего кристалла соли образуется бесцветный раствор – совсем как из обычной соли.
Греческий поэт Гомер (VIII в. до н.э.), написавший Илиаду и Одиссею, называл поваренную соль «божественной». В те времена она ценилась выше золота: ведь, как гласила пословица, «без золота прожить можно, а без соли – нельзя». Из-за месторождений каменной соли происходили военные столкновения, а иногда нехватка соли вызывала «соляные бунты».
На столах императоров, царей, королей и шахов стояли солонки из золота, и заведовал ими особо доверенный человек – солоничий. Воинам часто платили жалованье солью, а чиновники получали солевой паек. Как правило, соляные источники были собственностью властителей и коронованных особ. В Библии есть выражение «пьет соль от дворца царского», означающее человека, получающего содержание от царя.
Соль издавна была символом чистоты и дружбы. «Вы – соль земли» – говорил Христос своим ученикам, имея в виду их высокие нравственные качества. Соль употреблялась при жертвоприношениях, новорожденных детей у древних евреев посыпали солью, а в католических церквах при крещении в ротик младенца клали кристаллик соли.
В обычае арабов было при утверждении торжественных договоров подавать сосуд с солью, из которого в знак доказательства и гарантии постоянной дружбы лица, заключившие договор – «завет соли» – съедали по несколько ее крупинок. «Съесть вместе пуд соли» – у славян значит хорошо узнать друг друга и подружиться. По русскому обычаю, когда подносят гостям хлеб-соль, то тем самым желают им здоровья.
Поваренная соль – не только пищевой продукт, но издавна распространенный консервант, ее применяли при обработке кожевенного и мехового сырья. А в технике она до сих пор является исходным сырьем для получения практически всех соединений натрия, в том числе соды.
Поваренная соль входила и в состав самых древних лекарств, ей приписывали целебные свойства, очищающее и дезинфицирующее действие, причем с давних пор подмечено, что поваренная соль разных месторождений имеет разные биологические свойства: самая в этом отношении полезная – морская. В Лечебнике-травнике, изданном в России в 17 в., написано: «Две сути соли, одну копали из горы, а другую находили в море, а которая из моря, та лутчи, а кроме морской соли та лутчи, которая бела».
Однако в употреблении соли надо соблюдать меру. Известно, что средний европеец ежедневно поглощает с пищей до 15 г соли, в то время как средний японец – около 40 г. Как раз японцы и держат мировое первенство по числу больных гипертонией – болезнью, одна из причин которой состоит в том, что в организме задерживается больше жидкости, чем ему необходимо. Клетки разбухают от ее излишка, сжимают кровеносные сосуды, поэтому повышается кровяное давление, от чего и сердце начинает работать с перегрузкой. Трудно становится и почкам, очищающим организм от избытка катионов натрия.
Ни одно растение не может расти на почве, покрытой солью, солончаки всегда были символом земли бесплодной и необитаемой. Когда властитель Священной Римской империи Фридрих I Барбаросса разрушил в 1155 Милан в Италии, то велел посыпать руины поверженного города солью в знак его полного уничтожения… У разных народов во все времена рассыпать соль значило накликать беду и потерять здоровье.
В древности люди использовали несколько способов добычи поваренной соли: естественное испарение морской воды в «соляных садках», где выпадал хлорид натрия NaCl – «морская» соль, вываривание воды соленых озер с получением «выварочной» соли, и выламывание «каменной» соли в подземных рудниках. Все эти способы дают соль с примесями хлорида магния MgCl2·6 H2O, сульфатов калия K2SO4 и магния MgSO4·7H2O и бромида магния MgBr2·6H2O, содержание которых достигает 8–10 %.
В морской воде в среднем на 1 л приходится до 30 г различных солей, на долю поваренной соли приходится 24 г. Технология получения хлорида натрия NaCl из морской и озерной воды всегда была довольно примитивной.
Например, в конце «бронзового века» – за три, три с половиной тысячи лет до нашей эры – древние солевары обливали бревна морской водой, а потом сжигали их и из золы выбирали соль. Позднее соленые воды стали выпаривать на больших противнях, а для удаления примесей добавляли кровь животных, собирая образующуюся пену. Примерно с конца 16 в. растворы соли очищали и концентрировали, пропуская через башни, заполненные соломой и ветками кустарников. Выпаривание раствора соли на воздухе производили и совсем примитивным способом, сливая рассол по стене, сложенной из связок хвороста и соломы.
Солеварение, старейшее из химических ремесел, возникло на Руси, по-видимому, в начале 7 века. Соляные промыслы принадлежали монахам, которым благоволили русские цари, с них даже не взимался налог на продаваемую соль. Выварка соли приносила монастырям огромные прибыли. Рассолы добывали не только из озер, но и из подземных соляных источников; буровые скважины, которые для этого строили, в 15 в. достигали длины 60–70 м. В скважины опускали трубы, изготовленные из цельного дерева, а упаривали рассолы в железных противнях на дровяной топке. В 1780 в России таким способом было выварено более ста тысяч тонн соли…
В настоящее время поваренную соль добывают из отложений соляных озер и на месторожденияхкаменной соли – галита.
Поваренная соль – не только важная пищевая приправа, но и химическое сырье: из нее получают гидроксид натрия, соду, хлор.
Людмила Аликберова
Источник
Поваренная соль — это хлорид натрия, применяемый в качестве добавки к пище, консерванта продуктов питания. Используется также в химической промышленности, медицине. Служит важнейшим сырьем для получения едкого натра, соляной кислоты, соды и других веществ. Формула соли поваренной — NaCl.
Образование ионной связи между натрием и хлором
Химический состав хлорида натрия отражает условная формула NaCl, которая дает представление о равном количестве атомов натрия и хлора. Но вещество образовано не двухатомными молекулами, а состоит из кристаллов. При взаимодействии щелочного металла с сильным неметаллом каждый атом натрия отдает валентный электрон более электроотрицательному хлору. Возникают катионы натрия Na+ и анионы кислотного остатка соляной кислоты Cl-. Разноименно заряженные частицы притягиваются, образуя вещество с ионной кристаллической решеткой. Маленькие катионы натрия расположены между крупными анионами хлора. Число положительных частиц в составе хлорида натрия равно количеству отрицательных, вещество в целом является нейтральным.
Химическая формула. Поваренная соль и галит
Соли — это сложные вещества ионного строения, названия которых начинаются с наименования кислотного остатка. Формула соли поваренной — NaCl. Геологи минерал такого состава называют «галит», а осадочную породу — «каменная соль». Устаревшей химический термин, который часто употребляется на производстве, — «хлористый натрий». Это вещество известно людям с глубокой древности, когда-то его считали «белым золотом». Современные ученики школ и студенты при чтении уравнений реакций с участием хлорида натрия называют химические знаки («натрий хлор»).
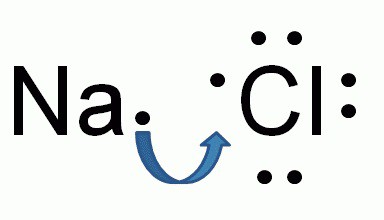
Проведем несложные расчеты по формуле вещества:
1) Mr (NaCl) = Ar (Na) + Ar (Cl) = 22,99 + 35,45 = 58,44.
Относительная молекулярная масса составляет 58,44 (в а.е.м.).
2) Численно равна молекулярному весу молярная масса, но эта величина имеет единицы измерения г/моль: М (NaCl) = 58,44 г/моль.
3) Образец соли массой 100 г содержит 60,663 г атомов хлора и 39,337 г натрия.
Физические свойства поваренной соли
Хрупкие кристаллы галита — бесцветные или белые. В природе также встречаются месторождения каменной соли, окрашенной в серый, желтый либо голубой цвет. Иногда минеральное вещество обладает красным оттенком, что обусловлено видами и количеством примесей. Твердость галита по шкале Мооса составляет всего 2-2,5, стекло оставляет на его поверхности черту.

Другие физические параметры хлорида натрия:
- запах — отсутствует;
- вкус — соленый;
- плотность — 2,165 г/ см3 (20 °C);
- температура плавления — 801 °C;
- точка кипения — 1413 °C;
- растворимость в воде — 359 г/л (25 °C);
Получение хлорида натрия в лаборатории
При взаимодействии металлического натрия с газообразным хлором в пробирке образуется вещество белого цвета — хлорид натрия NaCl (формула поваренной соли).

Химия дает представление о различных способах получения одного и того же соединения. Вот некоторые примеры:
Реакция нейтрализации: NaOH (водн.) + HCl = NaCl + H2O.
Окислительно-восстановительная реакция между металлом и кислотой:
2Na + 2HCl = 2NaCl + Н2.
Действие кислоты на оксид металла: Na2O + 2HCl (водн.) = 2NaCl + H2O
Вытеснение слабой кислоты из раствора ее соли более сильной:
Na2CO3 + 2HCl (водн.) = 2NaCl + H2O + CO2 (газ).
Для применения в промышленных масштабах все эти методы слишком дорогие и сложные.
Производство поваренной соли
Еще на заре цивилизации люди знали, что после засолки мясо и рыба сохраняются дольше. Прозрачные, правильной формы кристаллы галита использовались в некоторых древних странах вместо денег и были на вес золота. Поиск и разработка месторождений галита позволили удовлетворить растущие потребности населения и промышленности. Важнейшие природные источники поваренной соли:
- залежи минерала галита в разных странах;
- вода морей, океанов и соленых озер;
- прослойки и корки каменной соли на берегах соленых водоемов;
- кристаллы галита на стенках вулканических кратеров;
- солончаки.

В промышленности используются четыре основных способа получения поваренной соли:
- выщелачивание галита из подземного слоя, испарение полученного рассола;
- добыча в соляных шахтах;
- выпаривание морской воды или рассола соленых озер (77% от массы сухого остатка приходится на хлорид натрия);
- использование побочного продукта опреснения соленых вод.
Химические свойства хлорида натрия

По своему составу NaCl — это средняя соль, образованная щелочью и растворимой кислотой. Хлорид натрия — сильный электролит. Притяжение между ионами настолько велико, что его могут разрушить только сильно полярные растворители. В воде ионная кристаллическая решетка вещества распадается, освобождаются катионы и анионы (Na+, Cl-). Их присутствием обусловлена электропроводность, которой обладает раствор поваренной соли. Формула в этом случае записывается так же, как для сухого вещества — NaCl. Одна из качественных реакций на катион натрия — окрашивание в желтый цвет пламени горелки. Для получения результата опыта нужно набрать на чистую проволочную петлю немного твердой соли и внести в среднюю часть пламени. Свойства поваренной соли также связаны с особенностью аниона, которая заключается в качественной реакции на хлорид-ион. При взаимодействии с нитратом серебра в растворе выпадает белый осадок хлорида серебра (фото). Хлороводород вытесняется из соли более сильными кислотами, чем соляная: 2NaCl + H2SO4 = Na2SO4 + 2HCl. При обычных условиях хлорид натрия не подвергается гидролизу.
Сферы применения каменной соли
Хлорид натрия снижает температуру плавления льда, поэтому зимой на дорогах и тротуарах используется смесь соли с песком. Она впитывает в себя большое количество примесей, при таянии загрязняет реки и ручьи. Дорожная соль также ускоряет процесс коррозии автомобильных кузовов, повреждает деревья, посаженные рядом с дорогами. В химической промышленности хлорид натрия используется как сырье для получения большой группы химических веществ:
- соляной кислоты;
- металлического натрия;
- газообразного хлора;
- каустической соды и других соединений.
Кроме того, поваренная соль применяется в производстве мыла, красителей. Как пищевой антисептик используется при консервировании, засолке грибов, рыбы и овощей. Для борьбы с нарушениями работы щитовидной железы у населения формула соли поваренной обогащается за счет добавления безопасных соединений йода, например, KIO3, KI, NaI. Такие добавки поддерживают выработку гормона щитовидной железы, предотвращают заболевание эндемическим зобом.
Значение хлорида натрия для организма человека

Формула соли поваренной, ее состав приобрел жизненно важное значение для здоровья человека. Ионы натрия участвуют в передаче нервных импульсов. Анионы хлора необходимы для выработки соляной кислоты в желудке. Но слишком большое содержание поваренной соли в пище может приводить к высокому кровяному давлению и повышению риска развития заболеваний сердца и сосудов. В медицине при большой кровопотере пациентам вводят физиологический солевой раствор. Для его получения в одном литре дистиллированной воды растворяют 9 г хлорида натрия. Человеческий организм нуждается в непрерывном поступлении этого вещества с пищей. Выводится соль через органы выделения и кожу. Среднее содержание хлорида натрия в теле человека составляет примерно 200 г. Европейцы потребляют в день около 2-6 г поваренной соли, в жарких странах эта цифра выше в связи с более высоким потоотделением.
Источник
СВОЙСТВА ПОВАРЕННОЙ СОЛИ
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
Введение
Сегодня в 21 веке для людей созданы все условия для комфортной жизни – роботы, компьютеры, машины и многое другое. Почти в каждом доме есть большое количество разнообразной техники и приборов, которые облегчают жизнь людей. Но в жизни есть и простые вещи, которые мы не замечаем ( вода, сахар, зубная щетка), тем не менее они очень нужны и важны. Сюда же относится и соль. Она имеет большое значение для человека и во все времена ценилась очень дорого. Именно по этой причине мне бы хотелось рассказать вам о соли и ее видах, познакомить вас с ее физическими свойствами, на примере поваренной соли.
Свойства поваренной соли
-
Характеристика и виды соли
Поваренная соль является минеральным природным веществом и важной добавкой к человеческой пище. Она имеет форму кристалла. Без нее еда не только не вкусная, но и не полезная, однако чрезмерное употребление соли может навредить организму. Добыча поваренной соли осуществлялась еще с давних времен.
В природе соль встречается в виде минерала галита – каменной соли. Слово «галит» происходит от греческого «галос», означающего и «соль», и «море». Природный галит редко бывает чисто белого цвета. Чаще он буроватый или желтоватый из-за примесей соединений железа.
По способу добывания соль делится на несколько видов:• каменная, добывается горным способом, с помощью подземных разработок.• озёрная, добывается из пластов на дне соляных озёр;• садочная соль получается выпариванием или вымораживанием из воды.• выварочная соль получается выпариванием из подземных вод.
Чистая поваренная соль(NaCl), которую мы каждый день употребляем в пищу, это бесцветное кристаллическое вещество, способное раствориться в воде. На вкус соль – соленая, а также способна со временем разъедать кожу и некоторые твердые вещества.
2. Физические свойства соли
Физические свойства – это любые характеристики, которыми обладают все вещества, в том числе и поваренная соль.
Эксперимент и выводы
Чтобы наглядно можно было увидеть физические свойства соли, мы дома провели небольшой эксперимент. Для этого взяли стакан с простой водой, положили в нее три ложки поваренной соли и все перемешали до полного растворения соли в воде. После этого привязали нитку на карандаш и опустили свободный конец нитки в стакан с соляным раствором и оставили на несколько дней.
Вывод: Через несколько дней мы увидели, что нитка покрылась соляными кристаллами. Проведенный опыт показал, что:
соль бесцветна,
она полностью растворима в воде и способна кристаллизоваться на разных предметах.
К слову, когда я со своей семьей отдыхала на соляных озерах в г. Соль–Илецке, то на мне и на всех отдыхающих можно было увидеть белый налет на теле, после купания в любом из соляных озер.
Список использованных источников литературы
https://fb.ru
https://ru.wikipedia.org
https://obovsemponemnogu.ru
Приложение 1
Пословицы и поговорки.
– Без соли, что без воли: жизни не проживешь.
– Без соли, без хлеба – половина обеда.
– Без соли хлеб не естся.
– Из пресного сделаешь соленое, а соленого не опреснишь.
– За хлебом-солью всякая шутка хороша.
– Без соли невкусно, а без хлеба несытно.
Приложение 2
Про соль
Гласит народная молва,
Что хлеб – всему голова!
Без соли, однако, не вкусны хлеба,
Ни выпечка, ни другая еда!
Соль организму очень нужна,
В нужных количествах полезна она.
Соли разные бывают:
Одной дорогу посыпают,
Другие медикам нужны,
Чтоб вылечить больных могли.
В промышленности тоже не заменима она!
Очень полезна соль и важна!
Автор: Магафурова К. И.
Просмотров работы: 7101
Источник
